人参皂苷CK-羧甲基壳聚糖前药纳米胶束的制备方法及应用
- 国知局
- 2024-09-14 14:57:55
本发明属于纳米药物,具体涉及一种人参皂苷ck-羧甲基壳聚糖前药纳米胶束的制备方法及其应用。
背景技术:
1、肝细胞癌是最常见的原发肿瘤之一,已上升为世界第四大癌症死亡原因。肝细胞癌患者的5年总存活率仅为10-18%。目前,对于肝癌的治疗主要通过手术、化疗及放疗等方法,但治疗中的副作用较大,患者非常痛苦。为了减轻化疗药物的副作用,越来越多的人把研究焦点放到了天然活性药物上。
2、人参皂苷ck是人参中起主要作用的活性物质,具有抗衰老、抗炎、抗氧化、保护肝脏、提高免疫力以及抗肿瘤等优良生物活性。用于肿瘤治疗时,患者的接受程度较高。但因水溶性差、稳定性差、生物利用度低的原因,大大限制了其在生物医学领域中的应用。
3、前药设计是提高疏水性药物的稳定性和生物利用度,克服疏水性药物递送困难缺点的有效策略。前药是指药物经过化学结构修饰后,在体内经转化释放出活性药物而发挥药效的化合物。和传统药物相比,前药具有溶解性好、生物利用度高的优点。
4、羧甲基壳聚糖是壳聚糖的两亲性衍生物,具备更好的生物相溶性和生物降解性,易于加工成纳米颗粒,并且易于修饰,使其更适用于药物的靶向递送从而提高疗效,正受到越来越多的关注。
5、cn202311504136.1公开了一种超声增强型口服药物递送系统及其制备方法,采用旋蒸法和超声辅助法制备载药脂质体微泡。该专利制备的载药脂质体微泡粒径约1000nm,且并未提及载药量指标。单一的化疗或免疫治疗都具有治疗效果不足的缺陷,将二种以上治疗手段联用是突破缺陷的有效举措。光动力疗法(pdt)是用光敏药物和激光活化治疗肿瘤的一种新方法,特定的波长照射肿瘤部位时,精确性激活聚集在肿瘤细胞的光敏药物(如吲哚菁绿ir820),生成活性很强的单态氧杀死肿瘤细胞。但吲哚菁绿在血液中半衰期短、清除迅速、体内非特异性生物分布,在光疗过程中易引起全身毒性且治疗效率较低。
6、cn112641959a公开了一种新型多功能纳米探针的制备方法,该专利以金纳米颗粒负载钆离子和新吲哚箐绿ir820,进行光热和光动力协同治疗。但相较于天然产物以及高分子化合物,金纳米颗粒造价较高且易被氧化,失去其特性,且纳米探针没有加入主动或被动靶向功能,其实际效果有待验证。
7、cn112451663a公开了一种用于荧光成像导航肿瘤切除和光热治疗的纳米复合体的制备方法,将肿瘤靶向蛋白tp采用物理或化学修饰方法与负载有近红外染料ir820的有机硅层状结构复合形成纳米复合体。该专利考虑到靶向肿瘤部位诊治,但仅依靠光热治疗方法,未携带肿瘤治疗药物。
8、因此,开发一种羧甲基壳聚糖前药缓释纳米胶束的制备方法,提升人参皂苷ck和吲哚箐绿ir820的稳定性及在病灶的停留时间,是十分必要的。
技术实现思路
1、本发明针对上述技术的不足,提供一种人参皂苷ck-羧甲基壳聚糖前药纳米胶束的制备方法及其应用,该发明,通过交联羧基化人参皂苷ck和o-羧甲基壳聚糖形成具有酰胺键的聚合物后,再通过超声自组装成球形胶束包裹ir820。在载药纳米粒子达到肿瘤部位时,酰胺键响应肿瘤微环境断裂,释放出的人参皂苷ck和ir820,在光动力疗法的加持下,协同作用,达到协同靶向增加治疗效果的目的。
2、本发明一种人参皂苷ck-羧甲基壳聚糖前药纳米胶束的制备方法采用的技术方案是:
3、s1、人参皂苷ck的羧基化:
4、将人参皂苷ck溶解于吡啶和二氯甲烷的混合液中,加入琥珀酸酐,在室温条件下,以600r/min的搅拌速率反应24h后,旋转蒸发后,在水中沉淀,过滤后,将沉淀物质离心洗涤,在温度为35℃的条件下真空干燥,得到羧基化人参皂苷ck粉末;
5、s2、羧基化人参皂苷ck活性酯的制备:
6、将s1中得到的羧基化人参皂苷ck粉末溶于甲醇中,加入edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和nhs(n-羟基琥珀酰亚胺),在室温条件下搅拌反应1h,得到羧基化人参皂苷ck活性酯溶液;
7、s3、人参皂苷ck与o-羧甲基壳聚糖聚合物的制备:
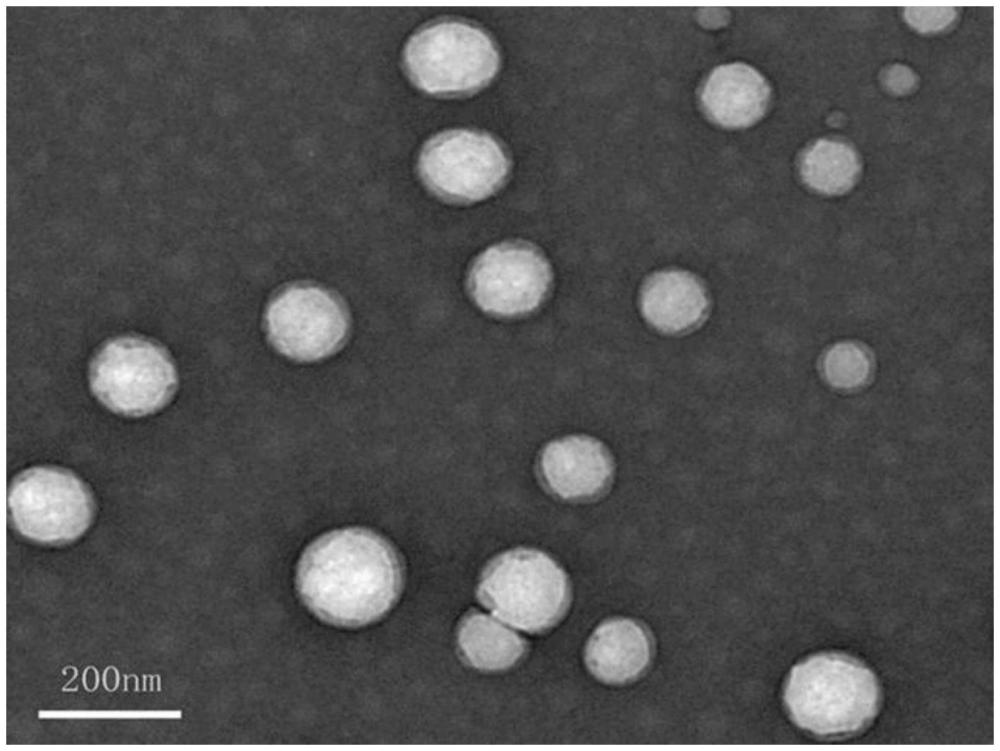
8、将将ocmc(o-羧甲基壳聚糖)搅拌溶解于纯水中,得到o-羧甲基壳聚糖水溶液;将所述o-羧甲基壳聚糖水溶液加至s2中得到的羧基化人参皂苷ck活性酯溶液中,在室温条件下以600r/min的速率搅拌反应24h,经过透析、冷冻干燥后,得到o-羧甲基壳聚糖-人参皂苷ck聚合物载体;
9、所述o-羧甲基壳聚糖-人参皂苷ck聚合物载体的结构式为:
10、
11、s4、载ir820人参皂苷ck与o-羧甲基壳聚糖前药纳米胶束制备:
12、将s3中得到的o-羧甲基壳聚糖-人参皂苷ck聚合物载体溶解于纯水中,得到o-羧甲基壳聚糖-人参皂苷ck聚合物水溶液,将ir820(新吲哚菁绿)溶解于二甲基亚砜中,得到ir820的二甲基亚砜溶液,将所述ir820的二甲基亚砜溶液加入至所述o-羧甲基壳聚糖-人参皂苷ck聚合物水溶液,搅拌混合24h,然后在冰浴的条件下超声处理,经透析、冷冻干燥,得到人参皂苷ck-羧甲基壳聚糖前药纳米胶束。
13、优选地,s1中所述人参皂苷ck和琥珀酸酐的用量比为100mg:48mg。
14、优选地,s1中所述吡啶和二氯甲烷的混合液中吡啶和二氯甲烷的体积比为1:1。
15、优选地,s2中所述羧基化人参皂苷ck粉末、甲醇、edc和nhs的用量比为33mg:16ml:40mg:24mg。
16、优选地,s3中所述o-羧甲基壳聚糖、纯水、羧基化人参皂苷ck活性酯溶液的用量比为288mg:16ml:16ml。
17、优选地,s3中透析的具体方法为:用分子量为8000-14000da的透析膜进行透析,先在体积比为1:1的甲醇和纯水条件下透析1天,后在纯水中透析2天;
18、s4中透析的具体方法为:用分子量为8000-14000da的透析膜在纯水中透析24h。
19、优选地,s4中所述o-羧甲基壳聚糖-人参皂苷ck聚合物水溶液的浓度为0.5mg/ml;所述ir820的二甲基亚砜溶液中ir820和二甲基亚砜的用量比为20mg:10ml;所述ir820的二甲基亚砜溶液和所述o-羧甲基壳聚糖-人参皂苷ck聚合物水溶液的用量比为0.5ml:1.5ml。
20、优选地,s4中所述超声的条件为:超声3次,每次2min,功率120w,工作4s,间歇2s。
21、优选地,s4中所述近红外荧光成像人参皂苷ck-羧甲基壳聚糖纳米胶的平均粒径为129.6nm。
22、本发明还提供了上述制备方法所制备的一种人参皂苷ck-羧甲基壳聚糖前药纳米胶束的应用可用于药物缓释。
23、本发明与现有技术相比具有以下优点:
24、1、本发明的人参皂苷ck-羧甲基壳聚糖前药纳米胶束达到肿瘤部位时,响应肿瘤部位酸性微环境,羧甲基壳聚糖的氨基与羧基化人参皂苷ck的羧基接枝的酰胺键响应而断裂,从而释放胶束接枝的人参皂苷ck,和光敏剂ir820。人参皂苷ck对肿瘤细胞的生长有抑制作用,同时近红外光照射ir820也会产生单态活性氧抑制肿瘤的生长,可以达到光动力治疗与药物治疗协同,增强治疗效果的目的。
25、2、本发明的制备方法中人参皂苷ck-与o羧甲基壳聚糖聚合物接枝后,能显著提高人参皂苷ck的稳定性,避免轻易流释;同时,包裹在本发明纳米胶束中ir820的光敏材料在人参皂苷ck的羧基与羧甲基壳聚糖的氨基形成的酰胺键在响应肿瘤微环境断裂,ck逐步释放的过程中,被缓慢释放出来,保证ir820在病灶部位的光热治疗效率。本发明通过光动力疗法和药物治疗的联合,显著提高肝癌治疗的靶向性和有效性。
26、下面结合附图和实施例对本发明作进一步详细说明。
本文地址:https://www.jishuxx.com/zhuanli/20240914/296531.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。