一种构像信号肽介导异源蛋白在大肠杆菌中分泌表达的方法
- 国知局
- 2024-10-21 14:31:27
本发明属于生物工程,具体涉及一种具有beta(β)桶状结构的构象信号肽,具体为超折叠绿色荧光蛋白(sfgfp)介导异源蛋白在大肠杆菌中胞外分泌表达的方法。
背景技术:
1、异源蛋白在大肠杆菌中的分泌表达可以分为两种方式:周质分泌表达和胞外分泌表达。其中周质分泌表达是指通过信号肽将重组蛋白从细胞质转运到细胞周质空间的过程。周质空间是大肠杆菌内膜和外膜之间的氧化性间隙,类似于真核细胞的内质网环境,这有助于新生肽链的正确折叠和二硫键形成,进而获得具有生物活性的重组蛋白。常用的信号肽包括phoa、ompa、ompt、lamb、6-内酰胺酶、肠毒素st-ⅱ、lt-a、lt-b、金黄色葡萄球菌蛋白a和人生长激素信号肽等,这些信号肽能够有效地将表达的蛋白质从细胞质中转运到周质。胞外分泌表达是指通过特定分泌途径将重组蛋白分泌到细胞外的过程。革兰氏阴性菌存在ⅰ型至ⅶ型七大类分泌系统,其中ⅱ型和ⅴ型分泌系统应用最为广泛。重组蛋白的胞外分泌具有显著优点:由于大肠杆菌自身分泌的蛋白质较少,重组蛋白在纯化过程中更为简便。这些分泌系统的共同特点是首先通过信号肽将目标蛋白从胞质转运到周质空间,然后在周质空间中折叠并组装成具有功能的形态。然而,由于周质空间有限,可能发生二硫键错配,导致正确折叠的蛋白含量减少。此外,外膜的阻隔也使得分泌到胞外的蛋白产量较低。
2、β-桶状结构是一种常见的蛋白质结构,通常由多条反平行的β-折叠片段通过氢键连接,形成一个中空的圆柱形或桶状结构。β-桶状结构既具有结构稳定性,其β-桶状结构通过广泛的氢键网络和疏水核心提供高度的稳定性,抵抗变性条件;还具有功能多样性,β-桶状结构可以适应多种功能,从分子通道、运输蛋白到酶和荧光蛋白,具有广泛的应用潜力。β-桶状结构在生物膜中的通道蛋白和一些荧光蛋白中尤为常见。其中,绿色荧光蛋白(gfp)是下村修等于1962年首次从维多利亚多管水母属(aequorea victoria)中分离纯化出的一种在紫外光下发出强烈绿色荧光的蛋白质。超折叠绿色荧光蛋白(sfgfp)是在gfp基础上通过六轮突变获得的,突变位点包括s30r、y39n、n105t、y145f、i171v和a206v。sfgfp在折叠性和稳定性方面显著提高,其折叠速率是普通gfp的3.5倍。sfgfp与许多蛋白融合后,融合蛋白表现出更好的荧光强度、折叠速率和溶解度。因此,sfgfp在构建高效分泌表达系统方面具有潜在应用价值。
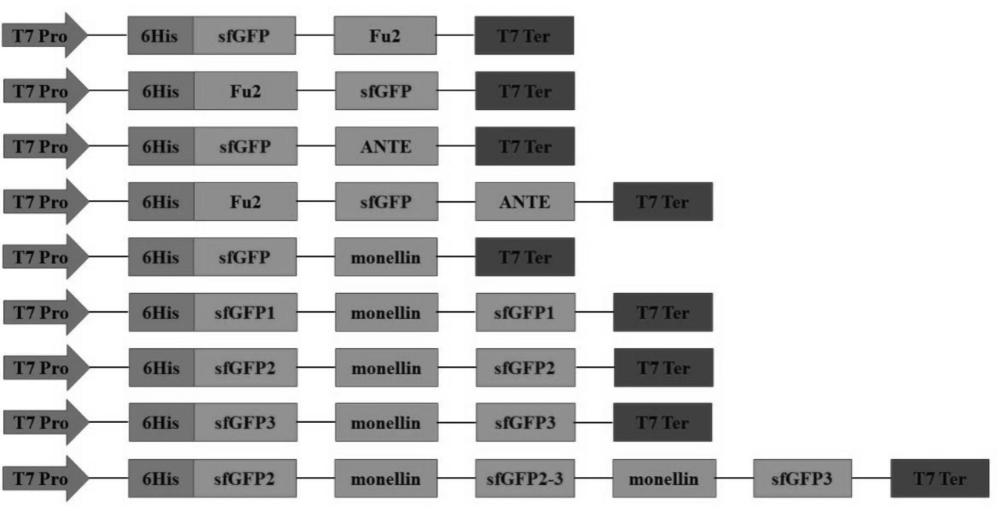
3、sfgfp中的β-桶状结构由11个反平行的β-折叠片段组成,形成一个坚固的桶状框架;桶的中央包含一个α-螺旋,螺旋中包裹着发色团,负责吸收并发射荧光。发明人的前期研究表明,将某些异源蛋白基因融合到超折叠绿色荧光蛋白羧基端并构建异源蛋白重组表达载体,该重组表达载体转化至大肠杆菌后,异源蛋白能够在大肠杆菌中实现胞外分泌表达,无需通过信号肽介导。然而,随着技术的发展,对异源蛋白的分泌表达提出了更高的要求,如更高的表达量、多种异源蛋白的融合表达等。
技术实现思路
1、有鉴于此,本发明利用sfgfp的β-桶状结构,改进了sfgfp介导异源蛋白在大肠杆菌中分泌表达的策略,以有效解决当前技术中的不足,进而促进规模化生产的发展。本发明的技术方案具体如下:
2、本发明第一方面提供了一种构像信号肽介导异源蛋白在大肠杆菌中分泌表达的方法,包括以下步骤:
3、s1、将至少两个异源蛋白同时融合至构像信号肽上并构建异源重组蛋白表达载体,所述构像信号肽具有β-桶状结构,所述融合的位点为构像信号肽的氨基端、羧基端以及多个loop环中的至少两个;
4、s2、将异源重组蛋白表达载体转化至大肠杆菌,对所得基因工程菌株进行培养表达,获得融合蛋白。
5、在本发明方法中,步骤s1中的异源蛋白可以为同一种异源蛋白,也可以为不同种异源蛋白。当为同一种异源蛋白时,通过将其整合至构像信号肽的不同位置,可以有效提高蛋白的表达量。当为不同种异源蛋白时,通过本发明方法可以将一个反应中的多种蛋白酶整合至同一个sfgfp支架上,形成一个具有多种功能的复合体。
6、在本发明方法中,构像信号肽为超折叠绿色荧光蛋白,经过发明人的分析和验证,共确定了以下3个loop环能够作为整合异源蛋白的位点:序列为ttgkl(seq id no.1)的loop1,序列为vedgs(seq id no.2)的loop2,序列为gpvll(seq id no.3)的loop3。
7、在本发明的一些实施例中,异源蛋白为纳米抗体fu2和纳米抗体ante,这两个纳米抗体均可中和sars-cov-2;将纳米抗体fu2和ante同时融合在sfgfp上(分别位于sfgfp的氨基端和羧基端)后,所得融合蛋白不仅能够在大肠杆菌中胞外分泌表达,而且相较于单独的纳米抗体fu2、纳米抗体ante,其与sars-cov-2有一个更好的亲和力。
8、在本发明的另一些实施例中,异源蛋白为甜味蛋白monellin。实施例数据表明,将monellin融合至sfgfp的loop1、loop2和loop3中的任一处,均可实现胞外分泌表达,且sfgfp作为融合标签不影响其活性;另外,将monellin整合至sfgfp的不同位置,如同时整合至loop2和loop3上,还可以有效提高蛋白的表达量。
9、在本发明的方法中,异源重组蛋白表达载体的构建方法可采用本领域常规技术进行构建,如在本发明的一些实施例中,以pet23a为基础载体,通过同源重组的方式构建了表达载体。
10、本发明第二方面提供了根据上述构像信号肽介导异源蛋白在大肠杆菌中分泌表达的方法制备的融合蛋白,其至少包括以下:
11、融合蛋白fu2-sfgfp-ante,氨基酸序列如seq id no.7所示;
12、融合蛋白sfgfp2-monellin-sfgfp2-3-monellin-sfgfp3,氨基酸序列如seq idno.12所示。
13、相对于现有技术,本发明的有益效果为:
14、(1)自分泌无需信号肽介导。相对于常规大肠杆菌胞外分泌表达需要借助于经典信号肽的引导而言,本发明利用构象信号肽作为融合标签,在不影响其β-桶状结构的情况下,借助其自分泌实现异源蛋白在大肠杆菌中胞外分泌表达。
15、(2)自分泌能力强。相对于常规大肠杆菌胞外分泌方法很难实现富含半胱氨酸的外源蛋白的分泌,本发明可以实现富含半胱氨酸的纳米抗体的分泌表达,将融合蛋白分泌至培养基和外膜中。
16、(3)对部分目的蛋白功能影响较小。融合标签蛋白往往会影响到与其相连目的蛋白的功能,需要经过后续的酶切纯化步骤才能得到具有功能的目的蛋白,存在操作过程复杂、目的蛋白得率低的问题。在本发明中sfgfp作为融合标签不影响目的蛋白的功能。
17、(4)快速优化表达条件。由于异源蛋白与sfgfp融合并不影响sfgfp发光,借助于sfgfp的这一特性,通过测量胞外分泌融合蛋白的荧光强度,快速判断融合蛋白是否表达并找到最适表达条件。
18、(5)丰富分泌表达途径。通过将异源蛋白融合至sfgfp的n端或c端以及几种不同的loop环上,实现融合蛋白的分泌表达。与经典的信号肽不同,通过将这种具体β-桶状结构的超折叠绿色荧光蛋白作为一种新型的信号肽,将异源蛋白融合至sfgfp的不同位置均可以实现异源蛋白的分泌表达,实现了将一种构象信号肽的多用化,增加了异源蛋白分泌表达的途径与手段,为分泌表达某种异源蛋白增加了候选项。
19、(6)整合表达多种异源蛋白。同时将异源蛋白融合至sfgfp的n端以及c端或loop环上,实现融合蛋白的分泌表达,便于将一个反应中的多种蛋白酶整合到同一个sfgfp支架上,形成一个具有多种功能的复合体。
20、(7)提高异源蛋白的表达量。通过将同一种异源蛋白整合至sfgfp的不同位置,可以有效的提高蛋白的表达量,提高蛋白表达的经济效益。
本文地址:https://www.jishuxx.com/zhuanli/20241021/318449.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表