一种杂交枫香磺肽素依赖性营养器官起源体胚的发生方法
- 国知局
- 2024-12-06 12:47:18
本发明涉及一种植物组织培养方法,特别涉及杂交枫香叶片起源体胚发生及获得再生植株的方法,属于植物无性繁殖。
背景技术:
1、近年来,由于农林业优良品种或无性系迫切需要大规模繁殖或深入研究,体胚发生成为了研究热点。这是因为高等植物的再生主要分为以下三种:组织修复、器官发生和体细胞胚胎发生(许智宏等,2019)。体细胞胚胎发生,又称体胚发生,其繁殖具有效率高,可以稳定大规模生产,单细胞起源等特性,其胚胎的两极性允许直接发育成植株,而不需要器官发生所必需的生根阶段(张天择等,2022)。而且,体胚发生类似合子胚胚胎发生的发育阶段,可以为研究高等植物生命周期中最早的发育事件——合子胚的发育提供可行的参考模型(guan et al.,2016)。此外,体胚发生是遗传转化和基因编辑的重要材料来源,也是生产单倍体、体细胞杂交和人工种子的最佳选择方法。
2、外植体来源直接决定体胚发生的能力,外植体到胚胎再生过程首先经过脱分化形成具有全能性的细胞,接着通过再分化形成胚胎,所以一般认为外植体距离合子胚阶段越远,就需要越多的细胞重编程过程形成胚性愈伤组织,进而诱导体胚(许智宏等,2019)。目前,林木体胚发生的外植体来源主要是生殖器官,包括合子胚、雄花等,而营养器官分化程度较高,建立体胚体系比较困难,目前只在杨树(于志水等,2005)、桉树(corredoira etal.,2015)等体胚发生较为容易的阔叶树种建立成功。然而营养器官能够代表母树本身的遗传特性,且取材方便,可以实现全年供给,供给量也非常大,因此建立营养器官起源体胚体系对于提高优良品种的生产效益非常重要。
3、目前诱导体胚发生最常用的方法是对外植体施加生物或非生物胁迫,以及改变内源和外源植物生长调节剂(pgrs)的水平进而触发体胚发生。目前最常用的是高水平的植物激素处理,除此之外还包括创伤、高温、化学小分子、渗透压等(salaün et al.,2021)。其中最常用的植物激素是生长素和细胞分裂素。此外也有很多研究证明脱落酸(chen et al.,2021;thi et al.,2005;rudus et al.,2009)、乙烯(roustan et al.,1989;kepczynskaet al.,2009;zheng et al.,2013)、水杨酸(hao etal.,2006;hutchinson et al.,1996;hong et al.,2008)和茉莉酸(rudus et al.,2005,2009;ahmadi et al.,2014)在体胚发生过程中起着非常重要的作用。然而营养器官起源的体胚发生生物过程比较复杂,传统的植物激素并不能解决尤其是林木体胚发生体系建立困难的问题,随着体胚发生研究的进一步深入,肽激素在植物生长发育中的作用研究成为新兴热点,其也成为解决林木营养器官起源体胚发生的一个方向。
4、植物中的肽激素是具有几个到几十个氨基酸的小肽,通常由含有n端信号肽的前体蛋白产生,经过切割和修饰形成成熟肽,到目前为止,成熟肽的修饰方式主要分为三种:酪氨酸磺基化、脯氨酸羟基化和阿拉伯糖基化。小肽通常是细胞间的通讯信号,以非细胞自主的方式协调植物防御和发育过程,包括分生组织维持、细胞分裂、气孔发育、繁殖和结瘤等(song et al.,2017)。目前研究发现了几种对于植物再生非常关键的肽激素,包括磺肽素(phytosulfokine)(li etal.,2024)、clavata3(clv3)/embryo surrounding region-related(cle)(yamaguchi et al.,2016)、plant peptide containing sulfatedtyrosine(psy)(ogawa-ohnishi et al.,2022)。
5、磺肽素最初是芦笋叶肉细胞增殖培养过程中作为细胞分裂因子被发现(matsubayashi et al.,1996)。体胚发生过程涉及细胞扩张与重编程,磺肽素在胡萝卜(hanai et al.,2000)与杂交鹅掌楸(陈金慧等,2013)中被发现可以通过加快胚性细胞增殖促进体胚发生,证实了磺肽素对于促进细胞增殖的显著作用。另外,有研究表明磺肽素可以促进日本落叶松(umehara et al.,2005)、小麦(asif et al.,2014)、豆类(ochatt etal.,2018)胚胎细胞的发育加快体胚发生,随后杉木研究中解释了这一现象,研究发现磺肽素可以通过维持氧化还原内稳态摆脱基因型依赖促进体胚发生,而且研究还表明磺肽素还通过参与其他生物途径调控杉木体胚发生(hao et al.,2023)。以上研究表明磺肽素可以作为一种促进体胚发生的潜在关键因子,而且这种促进作用不仅仅是通过调控细胞增殖实现的,还存在其他的途径,例如维持细胞内氧化还原稳态。
6、目前有研究建立了杂交枫香叶柄通过体胚发生方式获得再生植株的方法,但是体胚形成率和萌发率不高,并且以叶片作为外植体的体胚发生获得再生植株的体系迟迟未被攻克,叶片为无性繁殖领域优先使用的外植体,广泛被用于植物组织培养、基因工程,因此打破叶片起源体胚发生进而获得再生植株的瓶颈是非常必要的。此外,目前传统的植物激素的功能已经明确,并且一些技术不能通过传统的植物激素解决,因此挖掘一些新型的植物激素时非常必要的,本发明利用一种新型的植物小肽磺肽素打破了叶片起源体胚发生的瓶颈,并且大大提高了胚性愈伤组织形成率、体胚形成率和萌发率,对于杂交枫香无性系的发展奠定了坚实的基础,也对其他阔叶树营养器官体胚体系的建立提供了参考方案。
技术实现思路
1、本发明的目的是针对现有杂交枫香叶柄体胚发生过程中存在的胚性愈伤组织诱导率低、体胚形成率和萌发率低等技术问题,提供一种新颖的杂交枫香体胚的获得方法,本发明方法以杂交枫香的功能叶片为外植体,通过磺肽素进行体胚发生体系建立,获得杂交枫香的体胚,显著提高了杂交枫香繁殖效率;实现优良品系的大规模无性繁殖,为阔叶树体营养器官体胚发生的突破提供一个参考途径。
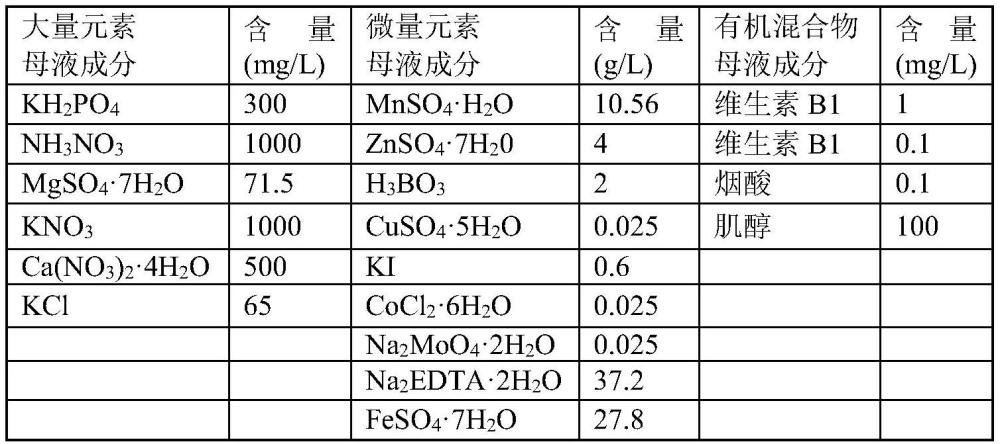
2、为实现本发明的目的,本发明一方面提供一种杂交枫香体胚的获得方法,将杂交枫香的成熟器官作为外植体,于愈伤组织诱导培养基上进行诱导培养,获得的愈伤组织再于体胚诱导培养基中进行诱导培养,获得体胚,其中,所述的体胚诱导培养基中含有磺肽素。
3、其中,所述愈伤组织诱导培养基为:改良blaydes基本培养基+水解酪蛋白1g/l+蔗糖40g/l+2,4-d 0.5-1.5mg/l+6-ba0.2-0.8mg/l+psk-α(磺肽素)0-0.2mg/l(优选为0.1-0.2mg/l)+植物凝胶1g/l,ph为5.6~5.7。
4、特别是,所述愈伤组织诱导培养基为:改良blaydes基本培养基+水解酪蛋白1g/l+蔗糖40g/l+2,4-d 0.5-1.5mg/l+6-ba 0.2-0.8mg/l+psk-α(磺肽素)0.1-0.2mg/l+植物凝胶1g/l。
5、特别是,所述体胚诱导培养基为:改良blaydes基本培养基+活性炭1g/l+蔗糖40g/l+psk-α0-0.8mg/l(优选为0.2-0.8mg/l)+植物凝胶6g/l,ph为5.6~5.7。
6、特别是,所述的杂交枫香成熟营养器官为叶片、叶柄,优选为叶片。
7、特别是,选择培养7~8个月大的杂交枫香幼苗的叶片。
8、本发明另一方面提供一种杂交枫叶片起源体胚发生的方法,包括如下顺序进行的步骤:
9、1)愈伤组织诱导处理
10、将杂交枫香无菌叶片置于愈伤组织诱导培养基上,进行愈伤组织诱导培养,获得胚性愈伤组织;
11、2)胚性愈伤组织成熟处理
12、将胚性愈伤组织置于液体胚性愈伤组织成熟培养基中,于黑暗条件下进行胚性愈伤组织的成熟培养;
13、3)体胚诱导处理
14、将成熟培养获得的胚性愈伤组织置于体胚诱导培养基上,进行体胚诱导培养;
15、4)体胚发育处理
16、将体胚诱导培养后的组织转接到体胚发育培养基中,于黑暗条件下进行体胚发育培养,获得子叶胚;
17、5)体胚萌发处理
18、将体胚发育培养获得的子叶胚置于体胚萌发培养基上,进行体胚萌发培养,获得杂交枫香再生植株。
19、其中,步骤1)中剪取杂交枫香7~8个月大试管苗的无菌叶片放置于愈伤组织诱导培养基上,进行所述的愈伤组织诱导培养。
20、特别是,所述愈伤组织诱导培养条件为:暗培养,培养温度为25±2℃;培养时间:25-35天,优选为30天。
21、特别是,所述愈伤组织诱导培养基为:改良blaydes基本培养基+水解酪蛋白1g/l+蔗糖40g/l+2,4-d 0.5-1.5mg/l+6-ba 0.2-0.8mg/l+psk-α(磺肽素)0-0.2mg/l(优选为0.1-0.2mg/l)+植物凝胶1g/l,ph为5.6~5.7。
22、特别是,还包括步骤1a):愈伤组织增殖培养:将步骤1)诱导培养获得的胚性愈伤组织转接到愈伤组织增殖培养基中,于黑暗条件下进行愈伤组织增殖培养。
23、特别是,所述愈伤组织增殖培养的温度为25±2℃。
24、特别是,所述愈伤组织增殖培养基为:改良blaydes基本培养基+水解酪蛋白1g/l+蔗糖40g/l+2,4-d 0.5mg/l+6-ba0.2mg/l+psk-α0.1-0.2mg/l+植物凝胶3g/l,ph为5.6~5.7。
25、特别是,所述愈伤组织增殖培养基为改良blaydes基本培养基+水解酪蛋白1g/l+蔗糖40g/l+2,4-d 0.5+6-ba0.2mg/l+psk-α0.2mg/l+植物凝胶3g/l,ph为5.6~5.7。
26、特别是,愈伤组织增殖培养过程在,每12-17天(优选15天)继代一次,培养30天。
27、步骤1a)中愈伤组织增殖培养15天时会长出质地更加分散,呈颗粒状的次级愈伤组织,次级愈伤组织被认定后续可以诱导体胚,此时继代一次,增殖过程培养30天,以获取数量足够多的次级胚性愈伤组织。
28、特别是,步骤2)中所述胚性愈伤组织成熟培养条件为:暗培养;成熟培养温度为25±2℃;成熟培养时间为12-17天,优选为15天;成熟培养过程中,进行悬浮培养,其中悬浮培养速率为120±20rpm。
29、特别是,所述胚性愈伤组织成熟培养基为:改良blaydes基本培养基+蔗糖40g/l+psk-α0-0.8mg/l(优选为0.2-0.8mg/l,进一步优选为0.4mg/l),ph为5.6~5.7。
30、特别是,胚性愈伤组织成熟培养过程中,每7天继代一次;成熟培养时间12-17天,优选为15天。
31、步骤2)中胚性愈伤组织悬浮培养15天(通常为12-17天),7天继代一次,成熟培养降低愈伤组织中的外源植物激素含量,便于后续的体胚诱导。
32、步骤2)中所述愈伤组织成熟培养是在液体培养基中进行悬浮培养,其中每0.2g愈伤组织放入盛有50ml液体成熟培养基。
33、特别是,步骤3)中所述的体胚诱导培养为:将胚性愈伤组织成熟处理后的体系进行过滤处理后,成熟培养的胚性愈伤组织连同滤纸一同置于固体体胚诱导培养基上进行培养。
34、特别是,步骤3)中所述体胚诱导培养的培养条件为:暗培养;培养温度为25±2℃;培养时间为25-35天,优选为30天。
35、特别是,所述体胚诱导培养基为:改良blaydes基本培养基+活性炭1g/l+蔗糖40g/l+psk-α0-0.8mg/l(优选为0.2-0.8mg/l,进一步优选为0.4mg/l)+植物凝胶6g/l,ph为5.6~5.7。
36、体胚诱导培养的目的是吸附胚性愈伤组织中的植物激素。
37、步骤3)的目的是进一步通过活性炭和高剂量的植物凝胶来吸附胚性愈伤组织中的外源植物激素,为体胚诱导提供干燥的培养环境,提高体胚诱导效率,培养30天(25-35天)时,就会有球形胚陆续产生。
38、特别是,步骤4)中所述体胚发育培养条件为:暗培养;培养温度为25±2℃。
39、特别是,体胚发育培养时间为55-65天,优选为60天,通常培养至获得子叶胚。
40、特别是,体胚发育培养过程中,每30天继代一次。体胚发育培养基中指纹凝胶含量低于体胚诱导培养基中的植物凝胶的含量,培养基中植物凝胶含量降低,降低了培养基渗透压,利于球形胚往心形胚、鱼雷形胚和子叶胚发育。
41、特别是,所述体胚发育培养基为:改良blaydes基本培养基+活性炭1g/l+蔗糖40g/l+psk-α0-0.8mg/l(优选为0.2-0.8mg/l,进一步优选为0.4mg/l)+植物凝胶3g/l,ph为5.6~5.7。
42、特别是,步骤5)中体胚萌发培养条件为:在光照条件下进行萌发培养;培养温度为25±2℃;光照强度为1000-1500lx(优选为1200lx);光照时间为14-18h/d(优选为16h/d)。
43、特别是,所述体胚萌发培养基为:wpm基本培养基+蔗糖30g/l+植物凝胶3g/l,ph为5.8~5.9。
44、步骤5)中体胚萌发培养时间为25-35天,优选为30天;体胚萌发培养过程中,培养条件由黑暗改为光照且向再生苗发育,本步骤基本培养基的使用和培养基酸碱度与其他过程有显著变化。培养15天时,子叶胚就会生长出完整的根系,子叶长出,培养30天时,子叶胚就会发育为完整的植株。
45、与现有技术相比,本发明具有如下优点:
46、1、本发明攻克了基因工程、生产应用等使用更广泛的叶片为外植体的通过体胚方式获得再生植株的技术难题,现有的叶柄为外植体的技术体系,由于叶柄表面积较小、较不容易获取,不便于利用在其他用途。
47、2、本发明将杂交枫香体胚发生的过程清晰的区分出了叶片去分化诱导愈伤组织和愈伤组织再分化形成体胚两个过程,对于研究植物组织去分化、再分化的分子机制提供了契合的体系,为基因工程育种提供了稳定高效的技术体系。
48、3、基因型差异一直是制约体胚发生的关键因素,本发明对高胚性基因型和低胚性基因型都适用,对于生产实践更有关键意义。
49、4、本发明采用新型的小肽激素-磺肽素进行胚性愈伤组织诱导培养、液体成熟培养、体胚胎诱导培养、体胚发育培养,大大提高了体胚发生效率。
50、5、本发明培养基中添加磺肽素提高了愈伤组织诱导率,利用3种低胚性基因型(“东南-1-2”、“ht-4”、“ht-10”,为实生苗)设计试验进行探究发现,在愈伤组织诱导培养基中添加了0.2mg/l磺肽素时,不同基因型植株的胚性愈伤组织诱导率虽然存在差异,但是均达到83%以上,整体愈伤组织诱导率最高。
51、6、本发明中,在诱导体胚过程中,在低胚性基因型(“东南-1-2”)中发现,培养基中未添加磺肽素时,胚性愈伤组织无法发育形成体胚,添加0.4mg/l磺肽素时,胚性愈伤组织成功诱导出体胚,并且能正常发育形成子叶胚;在高胚性基因型(“sf15sh-5a”,为体胚苗)中发现,培养基中未添加磺肽素时,每0.2g愈伤组织可以形成38个子叶胚,当添加0.4mg/l磺肽素时,每0.2g愈伤组织可以形成82个子叶胚,子叶胚形成率显著提升,并且外源添加磺肽素并不会影响后续的体胚萌发,体胚萌发率可以达到50%以上,这大大优于现有技术。
本文地址:https://www.jishuxx.com/zhuanli/20241204/342775.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表