预防或治疗冠状病毒感染的方法与流程
- 国知局
- 2024-07-12 10:28:57
本发明涉及医学和生物学,旨在通过服用“triavir”制剂来预防或治疗冠状病毒感染。
背景技术:
1、冠状病毒(cov)是一个大型病毒家族,它引起的疾病包括从普通感冒到中东呼吸综合征(mers-cov)、重症急性呼吸综合征(sars-cov)等更为严重的疾病。新型冠状病毒(ncov、covid-19、sars-cov-2)是以前从未在人体中发现的冠状病毒新毒株[10]。
2、鸡传染性支气管炎病毒(ibv)是人类已知的第一种冠状病毒,它至今仍给家禽养殖业带来很多麻烦。这种病毒于1937年被发现。目前已知的冠状病毒有39种,其中每种可能包括数十个或数百个毒株,此外还有10种尚在研究中的冠状病毒[16]。
3、在21世纪出现了几种新型冠状病毒(cov)。新型病毒的特点在于其极强的毒力和致病力,它们所引起的病变往往是致命的[1,2]。重症急性呼吸综合征冠状病毒(sars-cov)于2003年被首次发现[3]。十年后,出现了第二种新型冠状病毒——中东呼吸综合征(mers-cov),该病毒首先在沙特阿拉伯被发现[1]。自首次被发现以来,sars-cov已感染了约8000人,据报告,约有10%的感染者因此死亡[4]。mers-cov的传播范围不如sars-cov广泛,但其活性更强,因此拥有更强的致病性和毒性,在所有确诊的感染病例中,致死率高达35-50%[1,2]。
4、令人担忧的是,在动物种群中还发现了其他的cov,这增加了类似疫情再次爆发的可能性[4]。由于sars-cov和mers-cov都属于人畜共患病毒,因此它们引起的疾病比通常由cov所引起的疾病更加严重。sars-cov和mers-cov感染会导致严重的肺损伤,其表现为急性肺损伤(ali),并伴有肺水肿和呼吸衰竭。在这种情况下,ali有可能会动态发展成急性呼吸窘迫综合征(ards)[5]。
5、由sars-cov-2引起的新型冠状病毒感染也会出现上述综合征。研究发现,免疫功能紊乱在其发病机制中起着关键作用[6,7,8,9]。注意是否存在淋巴细胞减少症和中性粒细胞减少症。外周血淋巴细胞主要属于hla-dr和cd38标记细胞。它们属于穿孔素和/或粒细胞素阳性cd8+t淋巴细胞亚群或炎症性th17细胞。由于后者具有明显的组织损伤效应和免疫抑制活性,此类变化会对肺组织造成严重破坏,表现为肺泡弥漫性损伤,并加剧ards病症。此类变化与肺细胞上sars-cov-2受体的高表达一致。最近的研究表明,抗体依赖性增强(ade)是sars-cov-2肺损伤的一种生物学机制[8,9]。抗体依赖性增强不仅由中和抗体诱导,也由非中和抗体诱导。对于sars-cov-2而言,ade由cd32表达细胞诱导产生,这些细胞包括单核细胞、巨噬细胞和肺巨噬细胞。
6、2019-ncov是一种对公众健康、经济和社会政治领域造成严重影响的病毒。covid-19防控应成为所有国家的当务之急[13]。
7、由于这是一种新型传染病,目前还没有针对新型冠状病毒的注册疫苗[14]。但由于存在ade效应风险,主要引起机体体液免疫的疫苗需要在尽可能接近重现真实感染的模拟系统和临床试验中进行非常仔细的安全性测试。同时,引起保守抗原决定簇产生细胞性免疫的疫苗不会诱发ade效应。
8、在最佳治疗方法领域同样存在亟待满足满足的需求,包括特定的抗病毒疗法、免疫系统调节作用的研究以及如何为多器官功能衰竭提供最佳支持。目前,已登记有160多项随机试验和非随机试验。正使用多种药物治疗covid-19,包括皮质类固醇、各种利巴韦林配伍、洛匹那韦/利托那韦、氯喹、羟氯喹、干扰素和其他药物。一项应用雷米替韦治疗重症covid-19(nct04257656)的随机对照试验研究正在进行中。[15].治疗中同样采用中医药物。
9、除上述病毒外,还有四种感染人类的冠状病毒,其中两种(hcov-229e和hcov-oc43)在sars-cov之前就已被发现,另外两种(hcov-nl63和hcov-hku1)于2004年和2005年被发现。虽然冠状病毒感冒很常见,占全球感冒总数的15-30%,但这四种冠状不会比轻微感冒更严重的病症[16]。
10、不过,所有冠状病毒都有以下特征。
11、在电子显微镜下观察,圆形的病毒颗粒表面有突起,这些突起在病毒周边形成日冕状的包膜。这些突起是s蛋白的啮齿状分子,病毒正式需要通过它来穿透细胞。(值得注意的是,另一类病毒——冠状病毒的亲戚凸隆病毒(通常感染动物,很少感染人类)——也有“冠状”s蛋白。)有些冠状病毒有“亚冠状”突起,即从包膜上突出的额外一层较小的s蛋白。这种较小的蛋白质被称为he,即血凝素酯酶。细胞间的相互作用也需要he,除冠状病毒外,它还存在于凸隆病毒和一些流感病毒中。
12、s蛋白和he蛋白都位于病毒的脂质包膜,该包膜是病毒向宿主细胞外释放时从宿主细胞上所获得的。除了s蛋白和he蛋白外,脂质包膜中还有大量支撑和构造膜的m蛋白和少量e蛋白。包裹着病毒基因组的蛋白质脂质包膜是一条由n蛋白合成的rna分子链:它将病毒的rna盘绕成一个紧凑的螺旋结构。当rna侵染细胞后,能够立即合成蛋白质,病毒中的这种rna被标记为加号。根据这些特征,冠状病毒被归类为rna病毒,其基因组为线性单股正链的rna病毒。
13、冠状病毒接近细胞,并通过“冠状”刺突蛋白s蛋白与细胞接触。细胞表面有许多蛋白,其中包括蛋白酶,即能够切割其他蛋白质分子的酶。细胞首先通过包围与病毒相互作用的包膜来吞噬病毒——病毒进入细胞质中的囊泡。蛋白酶与s蛋白结合并对其进行切割,最终病毒s蛋白剩余部分的空间结构发生变化。变形后的s蛋白有助于病毒膜与细胞内的囊泡膜融合,两膜融合,病毒包膜破裂,病毒rna释放到细胞质中[16]。
14、现有技术中描述了以下治疗冠状病毒感染的方法。
15、阻止病毒基因组复制。
16、如果在通常的核糖核苷酸之外,在合成dna的酶中添加核糖核苷酸的类似分子,那么rna的合成就会受到破坏:酶将停止,不会完成已开始合成的rna链,或继续合成,但现在rna中往往含有错误的字母蛋白,这些字母蛋白会参与不同的化学反应,从而引发大量突变。
17、冠状病毒和其他rna病毒通过一种特定的酶,即rna依赖性rna聚合酶进行合成。细胞本身没有这种酶,细胞不参与在rna模板上合成rna分子,因此我们可以尝试在不干扰细胞的情况下对病毒聚合酶施加影响。核糖核苷酸类似物分子的合成由来已久,其中一些就是为了对抗病毒而研发的。例如,雷米迪维是针对埃博拉病毒开发的药物,但后来发现雷米迪维能够抑制mers-cov和sars-cov的繁殖。据了解,在人类和猴子细胞培养物中雷米迪维能阻止sars-cov-2感染。中国和美国正在对病人进行临床试验,至少有一名服用雷米迪维的病人已经康复,但目前还不清楚这种药物对该名病人的康复起了多大的作用。
18、另一种名为eidd-2801的核糖核苷酸类似物已被研发出来用于对抗流感病毒,据最近发表在《science translational medicine》(《科学转化医学》)上的一篇论文称,此类似物还能抑制sars-cov和mers-cov在小鼠体内的感染,以及新型sars-cov-2在人类肺细胞中的繁殖。eidd-2801能在不损伤细胞rna的情况下,诱导病毒rna发生多种突变。临床试验结果仍有待观察。
19、可以尝试阻断病毒rna聚合酶本身。氯喹被用来抑制疟原虫,有时也用来抑制致病阿米巴虫。结果发现,它也能抑制病毒聚合酶的活性:氯喹能大幅度提高细胞中锌离子的含量,而锌离子恰恰能阻断酶工作。此外,氯喹还能阻止入侵病毒将其基因组释放到细胞质中。然而,氯喹有一个严重的缺点——它会导致心律异常,药物剂量越大,引起心脏异常的风险就越高。小剂量氯喹能否阻止sars-cov-2的感染,目前尚无定论。
20、另一种方法是阻断病毒进入细胞。在细胞外的病毒无法繁殖,留在细胞间隙和血液中的病毒颗粒会被免疫系统细胞消灭。s蛋白这把“钥匙”起着打开细胞大门的作用:病毒要进入细胞,其s蛋白就必须与细胞膜表面的ace2蛋白相互作用。
21、可以给病毒s蛋白提供与ace2类似的诱饵,使其远离细胞。例如,ace2本身仅在病毒周围自由漂浮,而非静止存在于细胞上。例如,cell(《细胞》期刊四月份的一篇文章谈到了在细菌细胞中培育的人类重组ace2。其效果在类器官(由人类干细胞培育而成的肾脏和血管的微模型)上进行了测试,这种蛋白质能够阻断病毒入侵人类细胞[17]。
22、然而,预防和治疗冠状病毒感染的通用解决方案尚未找到,目前仍然迫切需要有效的手段和方法来预防或治疗新的冠状病毒感染和任何已知的以及未来再次出现的冠状病毒感染。
技术实现思路
1、“triavir”制剂配方。
2、成分名称每瓶含量100ml
3、活性成分
4、重组人干扰素α2b 100000iu
5、重组干扰素γ10000iu
6、洛匹那韦2.0mg
7、辅助成分
8、氯化钠900mg
9、乙醇2.0
10、上述配方版本并不用于限制权利要求的范围,而是用于演示实施例的具体示例。
11、制剂中使用的剂量可从以下范围中选择:洛匹那韦0.1-32mg/100ml,α干扰素50000-1000000iu\100ml,γ干扰素5000-500000iu/100ml。
12、组合吸入混合制剂“triavir”各成分的特性。
13、干扰素(ifn)是一种的多基因诱导细胞因子家族,具有抗病毒、抑制细胞增殖、抗肿瘤和调节免疫等多种功能。
14、ifn可分为三种类型:
15、ⅰ型干扰素:被称为病毒干扰素,包括ifn-α(白细胞型,由活化的单核细胞和b淋巴细胞合成)、ifn-b(成纤维细胞型,由成纤维细胞和上皮细胞、巨噬细胞合成)、ifn-w和ifn-k;
16、ⅱ型干扰素:被称为免疫干扰素,包括ifn-γ(由活化的t细胞和nk细胞产生);
17、ⅲ型干扰素:被发现的时间晚于ⅰ型和ii型,其相关信息表明ⅲ型ifn在某些类型的病毒感染中非常重要;
18、第一种类型(ifn-α)主要具有抗病毒和抑制细胞增殖作用,其次还有调节免疫的作用。它们与病原体相遇后直接产生,其作用在于定位病原体并防止其在体内扩散。这些干扰素为机体提供早期防御和非特异性防御,以抵抗病原体的侵袭。
19、第二种类型的干扰素(ifn-γ)的主要作用是参与免疫反应。在感染过程的后期阶段,干扰素开始由已经致敏的t淋巴细胞产生,并积极参与特异性免疫反应的级联反应。
20、抗病毒干扰素病毒感染过程中被诱导,有丝分裂原或抗原刺激会激活ⅱ型干扰素(ifn-γ)的合成。大多数受病毒感染的细胞类型都能在细胞培养中合成ifn a/b。与之相比,ifn-γ只能由免疫系统的某些细胞合成,包括自然杀伤(nk)细胞、cd4 t细胞和cds细胞毒性抑制细胞[18]。
21、根据《俄罗斯联邦卫生部临时方法建议》[19],“重组人干扰素α2b(ifn-α2b)可作为鼻内给药溶液使用,具有免疫调节、抗炎和抗病毒作用。其作用机制是抑制通过呼吸道进入人体的病毒进行复制”。
22、吸入ifn-α2b对covid-19的疗效也已被证明具有极高的可信度[20-23,29]。正因如此,根据中华人民共和国现行的临床指南,“在所有covld-19治疗方案中推荐吸入ifn-α2b干扰素”。同时,ifn-α2b吸入疗法被纳入不同时期和不同病症严重程度的治疗方案中,并适用于5岁以上儿童[25]。
23、因此,ifn-α2b吸入给药的效果明显优于鼻内给药,这一现象在在治疗下呼吸系统主要受到影响的covid-19时尤其明显[25,20-23,29]。值得注意的是,这种给药方法具有极高的安全性。因此,在使用定量雾化器时,成人单次吸入ifn-α2b的剂量为100万至1.2亿iu。在吸入剂量为1-1800万iu时,血浆中未检测到ifn-α2b,但在剂量为6000万iu时,血浆中检测到微量ifn-α2b。在吸入ifn-α2b剂量为1.2亿iu的患者中,检测到ifn-α2b的血药浓度为11至35iu。当吸入ifn-α2b的剂量为100万至1800万iu时,未观测到全身或局部副作用,但剂量为6000万至1.2亿iu时,患者会会出现高热、头痛和全身不适。这些症状在吸入3-6小时后开始出现,8-10小时后症状最严重,12-24小时后症状消失[26]。因此,服用ifn-α2b是治疗covid-19的传统疗法,其有效性和安全性已得到证实。除了肌肉注射和皮下注射外,γ干扰素(ifn-γ)还适用于鼻内雾化吸入,其中包括儿童[29-31,32,28,27]。与其他干扰素不同的是,ifn-γ能提升主要组织相容性复合体(mhc)ⅰ类和ⅱ类抗原在不同细胞上的表达,甚至能通过诱导使那些不表达这些分子的细胞表达这些分子。这样就提高了抗原递呈的效率和t淋巴细胞对抗原的识别能力。ifn-γ可阻断dna和rna病毒的复制、病毒蛋白质合成以及成熟病毒粒的组装。γ干扰素对病毒感染细胞施加细胞毒性作用。在新的冠状病毒感染中使用ifn-γ的原因在于,只有这种类型的ifn才能阻断导致肺纤维化的β-tgf的合成,而肺纤维化是covid-19常见的远期并发症[32,33]。目前,临床肺病学界对ifn-γ在治疗呼吸系统疾病中的潜在作用越来越感兴趣,而通过吸入给药直接将药物输送到靶器官被认为是最有效、最安全的疗法[34,35]。通过对健康志愿者进行ifn-γ吸入给药和皮下给药的比较试验表明,与吸入给药不同,肠外给药能够明显增加ifn-γ的血药浓度,但不会增加肺冲洗中ifn-γ的血药浓度[32]。大量临床数据表明,通过雾化吸入ifnα治疗呼吸道病毒感染的疗效和安全性明显更高[32,34,35]。通过雾化吸入ifnα,其有效治疗剂量比可能的中毒剂量低数千倍,成人的有效治疗剂量为125-500pg/ml(31250-125000iu/ml)。同时,由于治疗剂量的干扰素浓度低,几乎不会对局部产生任何刺激作用,可以长期(长达数月)每天多次使用[34]。因此,通过雾化吸入治疗剂量的ifn-γ,其安全性无疑已被可靠的临床试验结果所证实。此外,支持这一说法的一个重要论据在于,ifn-γ和ifn-α2b分子在功能和结构上的相似性,这决定了它们之间不存在分子间相互作用,也不存在相似的毒理学特性。
24、洛匹那韦是sars 3c样蛋白酶的抑制剂,已在sars和mers病原体方面得到了广泛的体外研究,同时在抑制这些病毒的复制方面显示出了一定的效果[29-30,35]。同时,基因对比分析表明,与sars和mers病毒相比,sars-cov-2病毒中的sars 3c样蛋白酶结构几乎完全一致[36]。
25、近期关于口服洛匹那韦/利托那韦治疗covid-19临床疗效的系统性综述[20,38,24]显示,洛匹那韦/利托那韦的临床疗效不明显。
26、因此,由于现有技术已经对洛匹那韦/利托那韦在治疗新型冠状病毒感染方面的疗效开展了研究,但洛匹那韦/利托那韦的给药效果并不令人满意,因此技术人员不会期望改变给药途径就能达到预期的治疗效果。
27、由于吸入给药已被证明对治疗covid-19有效,考虑到冠状病毒与3c样蛋白酶具有遗传亲和性,预防和治疗covid-19的疗效可以推广至到任一冠状病毒感染。
28、我们的研究表明,吸入式暴露in situ能够显著增强抗病毒效果,其原因可能在于,物质在直接暴露于病毒时,活性浓度得到显著增加。另一个支持这一观点的非常重要的论据在于,与口服给药相比,这种给药方法的安全性明显更高。这是因为洛匹那韦口服给药的最大剂量为400ml,每天两次,给药后约4小时达到血药浓度最大值(cmax)9.8±3.7μg/ml。显而易见,吸入给制剂量为400μg/ml,即低1000倍,实际上是安全的(就全身和局部刺激作用而言),与此同时抑制病毒的sars 3c样蛋白酶,且其剂量比阻断病毒感染的平均有效剂量高出40-50倍。
29、然而,现有技术中并不包含类似的设想。因此,一般专家不可能假设吸入给药比口服给药更有效。通常情况下,专家会希望通过将给药途径改为静脉注射或至少是肌肉注射来增强药物的疗效。
30、根据食品药品监督管理局(fda)的规定以及俄罗斯联邦药品注册临床前试验规定,对口服药物kaletra(洛匹那韦/利托那韦)进行了全面的安全性试验,现有的临床前毒理学研究数据表明,该活性物质属于低毒性药物(单次口服洛匹那韦的半数致死量(ld50)为超过2500mg/kg,低毒性(gras状态)。
31、按治疗剂量用药时几乎没有吸入中毒的风险[39,40]。
32、通过实施所提出的解决方案而取得的技术成果是有效预防或治疗冠状病毒感染患者。
33、我们开展了一项随机对照、平行分组、前瞻性、单中心治疗试验,试验对象是25至90岁的患者,试验内容是预防和治疗covid-19的组合吸入混合制剂此项试验的结果是研发出一种有效的吸入混合物,用于帮助25-90岁患者治疗和预防covid-19。
34、示例
35、每位患者的试验总时长不超过14天,分为3个阶段:
36、-筛选期(1天)——研究第1天;
37、-试验药物治疗期(14天(±2天)——研究第1-10天(±2天);
38、-试验结束期(1天)——研究第14天(±2天)。
39、筛选期:
40、第v0次就诊(第1天)、
41、医生研究员收集流行病学史、人口统计学数据、主诉和病史,开展体检,评估疾病的临床表现,做肺部计算机断层扫描(msct)、心电图、测量脉搏氧饱和度和spo2、通过pcr检测鼻咽和口咽拭子是否含有sars-cov-2rna;进行常规(临床)血液分析,测定白细胞水平、白细胞计数、淋巴细胞绝对值和百分比;进行血液生化分析;进行常规尿液分析;测定c-反应蛋白(crp)在血清中的水平。
42、根据所获得的结果,对纳入/未纳入标准进行了评估。
43、试验药物的治疗期:
44、第v1次就诊(1天)。
45、根据观察结果对纳入/未纳入标准进行最终评估后,
46、收集主诉、登记伴随治疗、开展体检、评估疾病的临床表现,然后决定是否将患者纳入试验,并将其随机分配到四组中的一组:
47、-第一组(控制组)患者按照俄罗斯卫生部长签发的《新型冠状病毒(covid-19)感染的预防、诊断和治疗临时指南》(第5版(2020年4月8日))接受标准治疗。
48、-第二组:除了按照俄罗斯卫生部长签发的《新型冠状病毒(covid-19)感染的预防、诊断和治疗临时指南》(第5版(2020年4月8日)接受标准治疗外,患者通过雾化器吸入组合1号吸入混合物,每天4次,每次10分钟,共持续14天。
49、-第三组:除了按照俄罗斯卫生部长签发的《新型冠状病毒(covid-19)感染的预防、诊断和治疗临时指南》(第5版(2020年4月8日)接受标准治疗外,患者通过雾化器吸入组合2号吸入混合物,每天4次,每次10分钟,共持续14天。
50、-第四组:除了按照俄罗斯卫生部长签发的《新型冠状病毒(covid-19)感染的预防、诊断和治疗临时指南》(第5版(2020年4月8日)接受标准治疗外,患者通过雾化器吸入组合3号吸入混合物,每天4次,每次10分钟,共持续14天。
51、-第五组:除了按照俄罗斯卫生部长签发的《新型冠状病毒(covid-19)感染的预防、诊断和治疗临时指南》(第5版(2020年4月8日)接受标准治疗外,患者通过雾化器吸入制剂,每天4次,每次10分钟,共持续10天。
52、为此应用spss statistics 19.0统计软件,通过随机数生成法为每位试验参与者分配了一个随机编号。该编号随机分配计划决定所使用的治疗类型(t1-t5)。在整个试验期间,该编号都属于该试验参与者。
53、患者在整个试验期间一直接受住院治疗,直到完全康复或出现其他结果。
54、从随机分配开始,每个研究日都要进行脉搏血氧观测、症状和主诉记录、体检和体温测量,以观测疾病进展。
55、随后对不良反应进行评估。
56、第v2次就诊(第v1次就诊后的第4天)。
57、此次就诊包括收集主诉(自上次就诊以来的变化)、记录伴随治疗、进行体检、评估疾病的临床表现、测量脉搏氧饱和度和spo2、通过pcr检测鼻咽和口咽拭子是否含有sars-cov-2rna。
58、第v3次就诊(第v1次就诊后的第8天)。
59、此次就诊收集主诉(自上次就诊以来的变化),记录伴随治疗,进行体检、评估疾病的临床表现、测量脉搏氧饱和度和spo2、通过pcr检测鼻咽和口咽拭子是否含有sars-cov-2rna、开展常规(临床)血液分析,测定白细胞水平、白细胞计数、淋巴细胞绝对值和百分比;进行血液生化分析;进行常规尿液分析;测定c-反应蛋白(crp)在血清中的水平。
60、第v4次就诊(第v1次就诊后第14(±2)天)。
61、此次就诊收集主诉(自上次就诊以来的变化),记录伴随治疗,进行体检、评估疾病的临床表现、做肺部计算机断层扫描(msct)、心电图、测量脉搏氧饱和度和spo2、通过pcr检测鼻咽和口咽拭子是否含有sars-cov-2rna、开展常规(临床)血液分析,测定白细胞水平、白细胞计数、淋巴细胞绝对值和百分比、进行血液生化分析;进行常规尿液分析;测定c-反应蛋白(crp)在血清中的水平。
62、参加试验的包括70名25-90岁的患中重度covid-19成年男女患者。
63、研究期间,所有患者被随机分为5组:控制组36名患者;每个研究组9名患者。
64、试验对象包括:根据鼻咽拭子和肺部计算机断层扫描(msct)结果确诊为“新型冠状病毒covid-19感染,中度重症,院外感染双侧肺炎,无呼吸衰竭”的患者。试验前7天未服用含洛匹那韦的药物。从症状(高热、咳嗽)发作到随机分配之间的间隔不超过7天。女性患者妊娠试验阴性或确认无生育能力。
65、存在任一以下情况的患者不能成为试验对象:
66、1.对药物的任何成分过敏。
67、2.出现ⅰ型或ⅱ型呼吸衰竭(rf)、急性呼吸窘迫综合征。
68、3.存在细菌性败血症并已导致肺部病变(病原体不详)
69、4.存在服用洛匹那韦的禁忌症
70、5.存在使用干扰素的禁忌症
71、6.存在导致covid-19患者严重病程及死亡的危险因素;
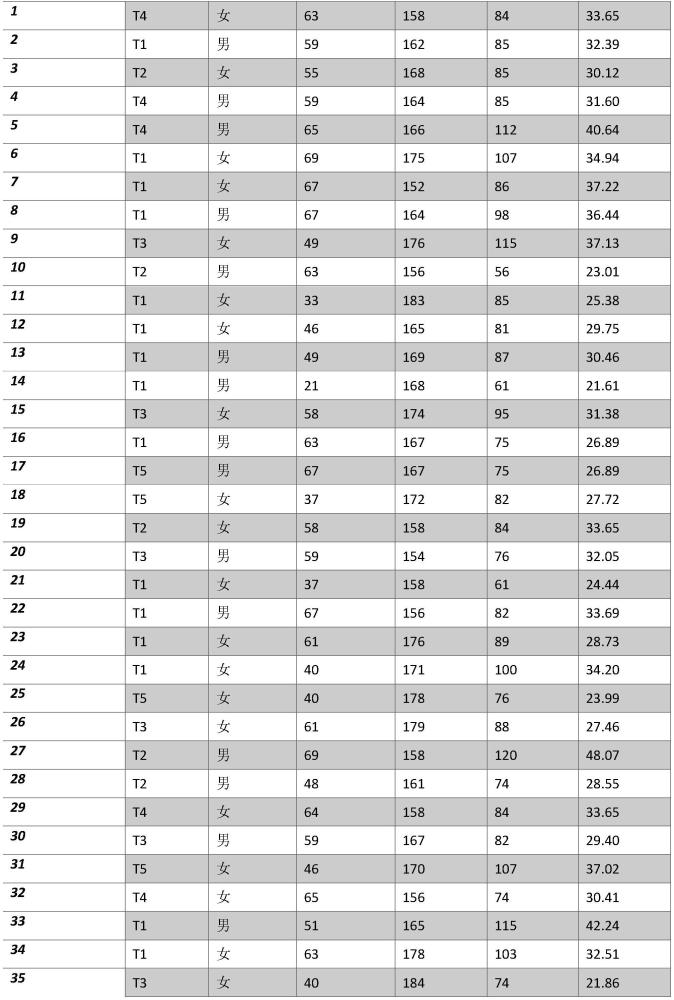
72、7.1型或2型糖尿病;
73、8.支气管哮喘;
74、9.慢性阻塞性肺病;
75、10.心肺功能不全;
76、11.存在移植器官和组织;
77、12.任何部位患有肿瘤疾病;
78、13.肥胖症;
79、14.艾滋病毒、肝炎和其他急性传染病(covid-19除外);
80、15.试验时被认定为危险因素的其他疾病和情况;
81、16.怀孕和哺乳期;
82、17.患者需要服用治疗禁用药物;
83、18.活动性肺结核、囊性纤维化、系统性结缔组织疾病;
84、19.严重的、失代偿的或不稳定的躯体疾病(任何危及患者生命或导致患者预后差或无法进行临床试验的疾病或病症);
85、20.患有妨碍治疗评估的精神疾病(包括幽闭恐惧症);
86、21.目前或曾经上有酗酒和吸毒史;
87、22.患者缺乏合作意愿;
88、23.患者在过去30天内参加过任何其他临床试验。
89、服用试验药物的时间为14天(±2天)。
90、患者随访时间为14天(±2天)。
91、在整个用药和随访过程中,对药物的安全性和耐受性进行观测。
92、观测包括对不良反应和严重不良反应的频率、性质和强度进行评估。
93、吸入混合物的组成:
94、1号吸入混合物——ifnα2b-2000iu/ml
95、2号吸入混合物——ifnγ-200iu/ml
96、3号吸入混合物——ifnα2b,2000iu/ml+ifnγ,200iu/ml
97、4号吸入混合物——(ifnα2b,1000iu/ml+ifnγ,100iu/ml+洛匹那韦80μg/ml)
98、治疗效果
99、表1.试验人群的特征
100、
101、
102、
103、
104、т1-标准疗法
105、т2-除接受标准疗法外,吸入组合1号组合吸入混合物
106、т3-除接受标准疗法外,吸入组合2号组合吸入混合物
107、т4-除接受标准疗法外,吸入组合3号吸入混合物
108、т5-除接受标准疗法外,吸入制剂
109、1号吸入混合物——ifnα2b-2000iu/ml
110、2号吸入混合物——ifnγ-200iu/ml
111、3号吸入混合物——ifnα2b,2000iu/ml+ifnγ,200iu/ml
112、“triavir”制剂(ifnα2b,1000iu/ml+ifnγ,100iu/ml+洛匹那韦80μg/ml)。
113、表2.
114、统计数据
115、
116、表3.
117、年龄
118、
119、
120、图1也反映了年龄特征。
121、表4.体重
122、
123、
124、图2也反映了体重特征。
125、表5.身高
126、
127、
128、图3也反映了身高特征。
129、表6.bmi
130、
131、
132、图4也反映了bmi的特征。
133、因此,试验组的患者样本具有同质性。
134、实验组和对照组的结果没有明显差异。
135、使用以下部分对治疗效果进行评估:
136、吸入混合物的组成:
137、1号吸入混合物——ifnα2b-2000iu/ml
138、2号吸入混合物——ifnγ-200iu/ml
139、3号吸入混合物——ifnα2b,2000iu/ml+ifnγ,200iu/ml
140、4号吸入混合物——“triavir”制剂(ifnα2b,1000iu/ml+ifnγ,100iu/ml+洛匹那韦80μg/ml),
141、根据以下标准,结果如下。
142、主要结论:
143、1.与筛查结果相比,通过肺部计算机断层扫描(msct)结果确诊感染新型冠状病毒covid-19的患者的肺部特异性变化呈良好势态。
144、2.与第1次就诊相比,脉搏氧饱和度测量结果与spo2测量结果呈良好势态。
145、3.常规临床血液分析中淋巴细胞相对数量正常化良好势态。
146、4.良好势态(血液检测中c反应蛋白水平正常化)。
147、次要结论:
148、在以pcr检测鼻咽拭子和口咽拭子是否含sars-cov-2rna的检测中,结果为阴性的患者数量。
149、恶化(肺炎恶化)的频率。
150、表7.
151、肺部计算机断层扫描(msct)研究结果
152、
153、
154、
155、表8.
156、
157、
158、试验结果结论:
159、1.包括控制组在内的所有患者都显示出正向的变化趋势。
160、2.吸入混合物治疗组的正向变化趋势更为明显(见图5-10)。
161、3.在接受“triavir”治疗的小组中,正向变化趋势的表达程度最高(见图5-10)。
162、表9.根据检测到的变化程度对ct结果进行分类
163、
164、
165、表10.covid 19病毒性肺部病变的发展阶段
166、
167、所有研究人员都强调了“磨玻璃影、结节、网状变化和病变面积等变化的重要性,一致认为这些变化反映了疾病的严重程度,可以预测疾病的进一步发展。但这些变化的组合却存在广泛的争议,从而产生了大量的分类方法。显然,肺部病变的严重程度、ct方法和疾病的临床过程之间存在着可靠的相关性,这也是对肺实质变化程度进行量化评估的现实意义所在。
168、表11.脉搏氧饱和度和spo2测量结果分析
169、
170、
171、
172、第1次就诊的统计数据
173、表12.观测总结报告
174、
175、表13.描述性统计数据
176、
177、
178、第1次就诊的茎叶图
179、小组=1.00
180、
181、第1次就诊的茎叶图
182、小组=2.00
183、
184、图11还描述了第1次就诊的情况。
185、表14.观测总结报告
186、
187、
188、表15.正态分布标准
189、
190、a.利尔耶福斯显著性校正
191、如果结果的误差概率p小于0.05,则说明分布与正态分布有显著差异。在本示例中,该分布可视为正态分布。
192、通过绘制正态分布图,即q-q图(见图11),可以直观地确定给定分布是否足够接近正态分布。在这里,每个观测值都与正态分布下的预期值进行比较。假设完全符合正态分布,则所有点都位于一条直线上。观测值位于x轴上,预期值位于y轴上,所有值均经过标准化处理(z变换)。在本示例中,观测值与直线非常接近。
193、在排除趋势图中,观测值与正态分布下预期值的偏差是观测值的函数。在正态分布情况下,所有点都位于通过零点的水平直线上。如果明显偏离直线,则表明分布与正态分布不同。在此图中,所有数值也都进行了标准化(z转换)(见图11)。
194、第4次就诊的统计数据
195、表16.观测总结报告
196、
197、表17.描述性统计数据
198、
199、
200、第4次就诊的茎叶图小组=1.00
201、
202、第4次就诊的茎叶图小组=2.00
203、
204、
205、图12还描述了第4次就诊的情况。
206、表18.正态分布标准
207、
208、a.利尔耶福斯显著性校正
209、第1次就诊
210、表19.小组统计数据
211、
212、表20.独立样本标准
213、
214、第4次就诊
215、表21.小组统计数据
216、
217、表22.独立样本标准
218、
219、分析结果如下:由于p值≤0.05,因此可得出结论,治疗前后血红蛋白氧饱和度的表达水平存在显著的统计差异;考虑到t标准值为负=-4.171,因此可以得出结论,治疗后spo2值出现了显著的统计增长;也就是说,所进行的治疗是有效的。
220、得出的结果包括:
221、√两组的观测数、平均值、标准偏差和平均值的标准误差、
222、√列文方差齐性标准检验结果。
223、通常,如果列文检验得出的p值小于0.05(方差异质性),则不接受方差相等(同质性)的假设。对于同质性(均等)和异质性(不均等)两种情况,可得出以下特征:
224、t检验结果:分布值t、自由度数值、误差概率p(标注为“显著性(双侧)”)以及均值差、其标准误差和置信区间。在本例中,治疗方案对患者血液中氧气含量的影响存在显著差异(p=0.000)。
225、表23.配对样本的统计数据
226、
227、表24.配对样本相关性
228、
229、表25.配对样本标准
230、
231、在整个治疗期间,氧气含量都发生了显著变化(p=0.001)。
232、表26.配对样本的统计数据
233、
234、表27.配对样本相关性
235、
236、表28.配对样本标准
237、
238、
239、以及对照组内的差异。
240、结论:由于p值≤0.05,因此得出结论,治疗前后血红蛋白氧饱和度的表达水平存在显著的统计差异;-考虑到t标准值为负=-10.073(所有患者)和-11.441(对照组),我们可以说治疗后spo2值有显著的统计增长;也就是说,进行的治疗,尤其是使用吸入混合物进行的治疗是有效的。
241、表29.描述性统计数据spo2
242、
243、表30.方差齐性标准
244、
245、表31.
246、anova
247、spo2
248、
249、在本例中,方差分析得出了显著的结果(p=0.003)。
250、spo2数据还显示在图13a—spo2结果汇总(计算小组平均值)和小组比较图13b中。
251、表32.
252、通过pcr检测sars-cov-2rna
253、
254、
255、
256、图14显示了治疗结束后各组pcr检测结果为阴性和阳性样本的情况。
257、图15显示了第1-3次就诊时各组pcr结果的比较。
258、pcr标准的结果给出的差异并不是可靠的,这显然与有效性测定标准本身的不可靠性有关(假阴性结果的水平相当于45%)。
259、常规(临床)血液分析,测定白细胞水平、白细胞计数
260、表33.淋巴细胞百分比
261、
262、
263、表34.描述性统计数据
264、
265、表35.anova
266、
267、
268、淋巴细胞的含量也反映在图16中。
269、上述数据充分表明,与对照组相比,控制组的治疗效果更好。同时,在控制组中,组的疗效最好。
270、表36.血清c反应蛋白(crp)水平。
271、
272、
273、
274、表37.描述性统计数据
275、
276、表38.anova
277、
278、上述数据也体现在图17。
279、上表和图17充分表明,与对照组相比,控制组的治疗效果更好。在这种情况下,在控制组中,组的疗效最好。同时,在控制组中,组的疗效最好。上述例子清楚地证明,提出申请的发明在工业上具有适用性,因为这些例子显示了用途的可重复性和可实现性。同时,它们还充分地证实了申请权利要求的广泛性的有效性,因为根据国家法律,为了证实申请人在公开发明基本特征时所使用的概括程度的有效性,需要提供有关实现发明基本特征的特定形式的信息。上文介绍了足够多的本发明实施例,这些实施例证实了在使用本发明基本特征的私人实现形式时获得申请人所述技术结果的可能性。如上所述,所有冠状病毒在结构、渗透机制和生命活动方面都具有基本的相似性。根据国家立法,可以参照图形材料举出一个例子。所给出的实施例说明了实现本发明技术成果的可能性,不应限制申请人的权利范围。综上所述,本发明实现技术成果的基本特征是以雾化吸入的形式服用“triavir”制剂。在这种情况下,专家可以根据病人的体重和病情选择有效剂量、使用时间和频率。如上所述,上述信息是在病情一般、体重不超标的患者身上获得的。因此,对于其他患者群体,可根据医学上常用的方法修改使用频率和剂量以及治疗时间。
280、从以上信息可以看出,“triavir”既可用于联合预防或治疗,也可单独用药作用于初期和轻度感染或单药预防。联合用药和单独用药的给药方式和剂量将由专科医生根据患者的病情进行选择。
本文地址:https://www.jishuxx.com/zhuanli/20240614/87211.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表