USP1抑制剂的制作方法
- 国知局
- 2024-06-20 10:49:48
本发明属于药物化学领域,涉及具有usp1抑制活性的新型化合物,含有所述化合物的药物组合物、制备所述化合物的有用中间体,以及利用本发明化合物治疗癌症的方法。
背景技术:
1、泛素是一个小的,高度保守的蛋白质76个氨基酸,是翻译后缀合底物蛋白质,包括本身,通过三步酶反应。最初的共价附着主要发生在泛素的c-末端甘氨酸和靶蛋白的赖氨酸残基的ε-氨基之间。1另外的泛素分子可以连接到泛素的七种内部赖氨酸之一,导致不同的泛素链拓扑结构。泛素化的生物学结果是由长度和连接拓扑决定的。与其他类型的翻译后修饰类似,泛素化是一种被称为去泛素化酶(dubs)的酶反调节的可逆过程,其催化从修饰的蛋白质中去除泛素。更重要的是,泛素依赖性信号通路的功能障碍与各种人类疾病有关,提示抑制泛素途径成分是药物发现的新的治疗靶点。
2、泛素-蛋白酶体系统为治疗干预提供了额外的机会,可以提高特异性和改善临床疗效的可能性。最明显的目标包括参与泛素缀合和去缀合(即泛素连接酶和dub)的酶,蛋白酶体介导的蛋白降解的上游过程。在dub中,泛素特异性蛋白酶1(usp1)因参与调节dna损伤反应途径而成为一个有吸引力的抗癌靶点。usp1与uaf1(usp1相关因子1)结合,产生去泛素化酶活性所需的异二聚体usp1/uaf1复合物。已经显示usp1/uaf1复合物通过pcna(增殖细胞核抗原)11和fancd2(fanconi贫血互补组d2)的去泛素化来调节dna交联剂诱导的dna损伤的耐受性,其分别是在跨损伤合成和fanconi贫血途径中起作用的蛋白质。
3、目前根据此类作用机制进行的研究很多,但是并未发现usp1抑制剂类药物上市,因此急需开发有效的usp1抑制剂应用于临床患者。
技术实现思路
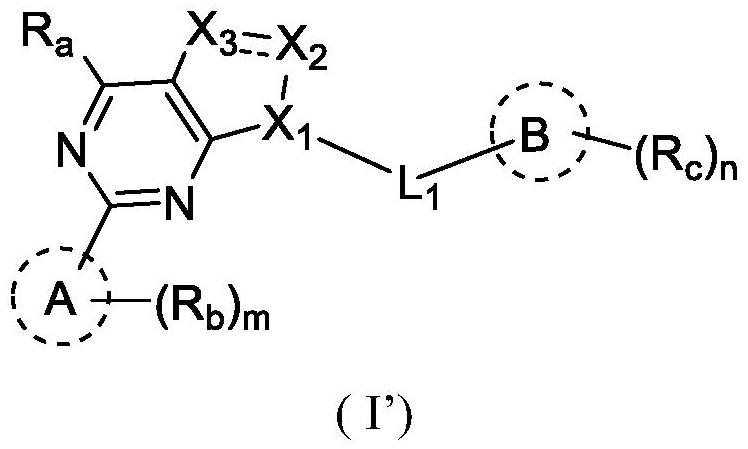
1、本发明提供了式(i’)所示化合物、其异构体及其药学上可接受的盐:
2、
3、其中,
4、x1为ch、n;x2、x3各自独立的为ch、n或cr’,其中,r’为取代或未取代的c3-6环烷基、5-6元杂芳基、苯基、卤素、c1-4卤代烷基、羟基c1-4烷基、-nh-ar、4-6元杂环基、-nh-co-c3-6环烷基、8-14元稠杂环基、7-11元螺杂环基、7-14元桥杂环基;
5、ra为氢或c1-4烷基;
6、环a为5-6元杂芳基,rb各自独立的为卤素、c1-4烷基、c1-4烷氧基、c3-6环烷基;m为0、1、2、3或4;
7、环b为苯基或11-18三元稠杂环基;rc为卤素、c1-4烷基、c1-4卤代烷基、c1-4烷氧基、或两个相邻rc形成取代或未取代的c3-6元环烷基;
8、所述环c为含有1-4个氮原子的5-10元杂芳基、8-14元稠杂环基;所述rd各自独立的为c1-4烷基、c1-4卤代烷基、c1-4烷氧基、卤素、c3-6环烷基;n为1、2、3或4;p为1、2、3或4;l1为c1-4亚烷基、c3-6亚环烷基。
9、本发明提供了式(i’)所示化合物、其异构体及其药学上可接受的盐:
10、
11、其中,
12、x1为ch、n;x2、x3各自独立的为ch、n或cr’,其中,r’为取代或未取代的c3-6环烷基、5-6元杂芳基;
13、ra为氢或c1-4烷基;
14、环a为5-6元杂芳基,rb各自独立的为卤素、c1-4烷基、c1-4烷氧基、c3-6环烷基;m为0、1、2、3或4;
15、环b为苯基或11-18元三环稠杂环基;rc为c1-4烷基、c1-4卤代烷基、c1-4烷氧基、或卤素,
16、所述环c为含有1-4个氮原子的5-10元杂芳基、8-14元稠杂环基;所述rd各自独立的为c1-4烷基、c1-4卤代烷基、c1-4烷氧基、卤素、c3-6环烷基;n为1、2、3或4;p为1、2、3或4;l1为c1-4亚烷基、c3-6亚环烷基。
17、本发明提供了式(i’)所示化合物及药学上可接受的盐:
18、
19、其中,
20、x1为ch、n;x2、x3各自独立的为ch、n或cr’,其中,r’为取代或未取代的c3-6环烷基、5-6元杂芳基;
21、ra为氢或c1-4烷基;
22、环a为5-6元杂芳基,rb各自独立的为卤素、c1-4烷基、c1-4烷氧基、c3-6环烷基;m为1、2、3或4;
23、环b为苯基或11-14元三环稠杂环基;rc为c1-4烷基、c1-4卤代烷基、c1-4烷氧基或所述环c为含有1-4个氮原子的5-10元杂芳基;所述rd各自独立的为c1-4烷基、c1-4卤代烷基、c1-4烷氧基;n为1、2、3或4;p为1、2、3或4;
24、l1为c1-4亚烷基、c3-6亚环烷基。
25、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,r’为
26、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,中,其特征在于,r’为-cl、-chf2、
27、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,,其特征在于,环a为
28、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环a为
29、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,rb为cl-、ch3-、ch(ch3)2-、ch3o-、
30、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,结构单元为
31、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,结构单元为
32、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环b为苯基,rc为环c,其中环c可以被p个rd取代;所述环c为含有1-4个氮原子的5-10元杂芳基、5-10元杂环基;所述rd各自独立的为c1-4烷基、c1-4卤代烷基、c1-4烷氧基、卤素、c3-6环烷基;n为1、2、3或4;p为1、2、3或4。
33、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环b为苯基,rc为环c,其中环c可以被p个rd取代;所述环c为含有1-4个氮原子的5-10元杂芳基;所述rd各自独立的为c1-4烷基、c1-4卤代烷基、c1-4烷氧基、卤素、c3-6环烷基;n为1、2、3或4;p为1、2、3或4。
34、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环b为11-18元三环稠杂环基;rc为c1-4烷基、c1-4卤代烷基、c1-4烷氧基、卤素;n为1、2、3或4。
35、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环b为11-14元三环稠杂环基;rc为c1-4烷基、c1-4卤代烷基、c1-4烷氧基;n为1、2、3或4。
36、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环b为
37、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环b为
38、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,rc为-cf3、-och3、-f、
39、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,结构单元为
40、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,rd为-ch3、-ch(ch3)2、-cf3、-och2ch3。
41、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,rd为-cl、-f、
42、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,环c为
43、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,结构单元为
44、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,l1为-ch2-。
45、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,其特征在于,结构单元为
46、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,,其特征在于,所述化合物、其异构体及药学上可接受的盐选自,
47、
48、其中环a、环b、ra、rb、rc、r’、l1、m、n如前述所述定义。
49、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,选自,
50、
51、其中环a、环c、ra、rb、r’、l1、rd、p、m如前述所述定义。
52、在本发明的一些方案中,上述式(i’)化合物、其异构体及其药学上可接受的盐,选自,
53、
54、其中r’如前述所述定义。
55、本发明还提供了下列所示化合物、其异构体及其药学上可接受的盐,
56、
57、
58、
59、
60、
61、本发明还提供一种药物组合物,其含有治疗有效量的上述化合物或其药学上可接受的盐和药学上可接受的载体。
62、“药学上可接受的载体”指本领域通常可接受的用于将生物活性药剂递送给动物、特别是哺乳动物的介质,根据给药方式和剂型的性质包括例如佐剂、赋形剂或赋形物,例如稀释剂、防腐剂、填充剂、流动调节剂、崩解剂、润湿剂、乳化剂、助悬剂、甜味剂、调味剂、芳香剂、抗菌剂、抗真菌剂、润滑剂和分散剂。药学上可接受的载体在本领域普通技术人员的眼界范围内根据大量因素配制。其包括但不限于:配制的活性药剂的类型和性质,要将含有该药剂的组合物给药的对象,组合物的预期给药途径,和目标治疗适应症。药学上可接受的载体包括含水介质和非水介质这两者以及多种固体和半固体剂型。除了活性药剂以外,这样的载体包括许多不同的成分和添加剂,因多种原因(例如稳定活性药剂、粘合剂等)在处方中包括的这样的另外的成分对于本领域普通技术人员是众所周知的。
63、本发明还提供上述化合物或其药学上可接受的盐或上述的药物组合物在制备治疗usp1介导的疾病药物中的应用,所述usp1介导的相关疾病包括癌症。
64、技术效果
65、本发明化合物有明显的usp1酶学抑制活性,可用于癌症的治疗。
66、说明和定义
67、除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。
68、术语“药学上可接受的”指在合理的医学判断范围内适合与人类和动物的组织接触使用而无过度的毒性、刺激、过敏反应或其它的问题或并发症,与合理的收益/风险比相当的那些化合物、材料、组合物和/或剂型。
69、术语“药学上可接受的盐”是指本发明化合物与相对无毒的酸或碱制备得到的衍生物。这些盐可以在化合物合成、分离、纯化期间就被制备,或者单独使用经过纯化的化合物的游离形式与适合的酸或碱反应。当化合物中含有相对酸性的官能团时,与碱金属、碱土金属氢氧化物或有机胺反应得到碱加成盐,包括基于碱金属与碱土金属的阳离子以及无毒的铵、季铵和胺阳离子,还涵盖氨基酸的盐等。当化合物中含有相对碱性的官能团时,与有机酸或无机酸反应得到酸加成盐。
70、术语“药学上可接受的载体”是指本领域通常可接受的用于将生物活性药剂递送给动物、特别是哺乳动物的介质,根据给药方式和剂型的性质包括例如佐剂、赋形剂或赋形物,例如稀释剂、防腐剂、填充剂、流动调节剂、崩解剂、润湿剂、乳化剂、助悬剂、甜味剂、调味剂、芳香剂、抗菌剂、抗真菌剂、润滑剂和分散剂。药学上可接受的载体在本领域普通技术人员的眼界范围内根据大量因素配制。其包括但不限于:配制的活性药剂的类型和性质,要将含有该药剂的组合物给药的对象,组合物的预期给药途径,和目标治疗适应症。药学上可接受的载体包括含水介质和非水介质这两者以及多种固体和半固体剂型。除了活性药剂以外,这样的载体包括许多不同的成分和添加剂,因多种原因(例如稳定活性药剂、粘合剂等)在处方中包括的这样的另外的成分对于本领域普通技术人员是众所周知的。
71、术语“赋形剂”通常是指配制有效的药物组合物所需要载体、稀释剂和/或介质。
72、术语“有效预防或治疗量”是指本发明化合物或其药学上可接受的盐以适用于任何医学治疗和/或预防的合理效果/风险比治疗障碍的足够量的化合物。但应认识到,本发明式i’所示化合物或其药学上可接受的盐和组合物的总日用量须由主诊医师在可靠的医学判断范围内作出决定。对于任何具体的患者,具体的治疗有效剂量水平须根据多种因素而定,所述因素包括所治疗的障碍和该障碍的严重程度;所采用的具体化合物的活性;所采用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体化合物的给药时间、给药途径和排泄率;治疗持续时间;与所采用的具体化合物组合使用或同时使用的药物;及医疗领域公知的类似因素。例如,本领域的做法是,化合物的剂量从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。
73、除非另有规定,通式中是指可以是单键,也可以是双键。
74、除非另有规定,通式中“ar”是指具有共轭π电子体系的单环或双环基团。所述“ar”的实例包括但不限于苯基、萘基。
75、除非另有规定,术语“5-10元杂芳基”,表示由5-10个环原子组成的具有共轭π电子体系的单环或双环基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子。其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)p,p是1或2)。5-10元杂芳基可通过杂原子或碳原子连接到分子的其余部分。所述“5-10元杂芳基”可以为稠杂芳基,优选的可以为5-6元杂芳基并5-6元杂芳基、苯基并5-6元杂芳基,更优选的可以为5元杂芳基并5元杂芳基、5元杂芳基并6元杂芳基。所述5-10元杂芳基的实例包括但不限于吡咯基(包括n-吡咯基、2-吡咯基和3-吡咯基等)、吡唑基(包括2-吡唑基和3-吡唑基等)、咪唑基(包括n-咪唑基、2-咪唑基、4-咪唑基和5-咪唑基等)、噁唑基(包括2-噁唑基、4-噁唑基和5-噁唑基等)、三唑基(1h-1,2,3-三唑基、2h-1,2,3-三唑基、1h-1,2,4-三唑基和4h-1,2,4-三唑基等)、四唑基、异噁唑基(3-异噁唑基、4-异噁唑基和5-异噁唑基等)、噻唑基(包括2-噻唑基、4-噻唑基和5-噻唑基等)、呋喃基(包括2-呋喃基和3-呋喃基等)、噻吩基(包括2-噻吩基和3-噻吩基)、吡啶基、嘧啶基、苯并咪唑基、吡啶并咪唑基等。
76、除非另有规定,术语“三环稠杂环基”是指三个环相互间共用两个相邻的环原子所形成的环状结构,且其中至少一个环为杂环;所述的稠杂环基可由选自苯基、环烷基、杂环基、杂芳基的环状基团稠合而成,且其中至少一个是杂环基或杂芳环基,具体稠合方式包括但不限于苯并杂环基并杂芳基、苯并杂芳基并杂芳基、杂芳基并杂环基并杂芳基等。三环稠杂环基的实例,包括但不限于
77、除非另有规定,术语“c1-4亚烷基”用于表示c1-4直链或支链的饱和亚烃基。亚烷的实例包括,但不限于-ch2-、-(ch2)2-、-(ch2)3、-(ch2)4-、-ch(ch3)-、-c(ch3)2-。
78、除非另有规定,术语“羟基c1-4烷基”指c1-4烷基中的氢原子任意被羟基取代的结构,“c1-4烷基-oh”的实例包括但不仅限于-ch2oh、-ch2ch2oh、-ch(oh)ch3、-ch2ch2ch2oh、-ch2ch(oh)ch3、、-ch2ch2ch2ch2oh、-ch2ch(oh)ch2ch3、-ch2ch2ch(oh)ch3、等。
79、除非另有规定,术语“c3-6亚环烷基”用于表示c3-6环状亚烃基。环状亚烃基的实例包括,但不限于
80、除非另有规定,术语“卤素”表示氟、氯、溴或碘原子。
81、除非另有规定,术语“c1-4的烷基”用于表示c1-4直链或支链的饱和烃基。烷基的实例包括,但不限于甲基、乙基、正丙基、异丙基、丁基、异丁基等。
82、除非另有规定,术语“c1-4烷氧基”是指通过氧桥连接的c1-4烷基,化合物包括但不限于甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基。
83、除非另有规定,“c3-6环烷基”是指3-6元单环烷基,优选5-6元环烷基,这些单环烷基的实例包括但不限于,环丙基、环丁基、环戊基、环己基、环庚基、环辛基。
84、除非另有规定,术语“含有1-4个氮原子的5-6元杂芳基”是指环中5-6元杂芳基中的环原子中含有1,2,3或者4个氮原子,实例包括但不仅限于
85、除非另有规定,“取代或未取代的c3-6环烷基、5-6元杂芳基”,是指c3-6环烷基、5-6元杂芳基可以被一个或多个取代基取代,也可以不被取代,所述的取代基可选自卤素、c1-4烷基、c1-4烷氧基、卤代c1-4烷基等;这些“取代或未取代的c3-6环烷基、5-6元杂芳基”的实例包括,但不限于
86、除非另有规定,术语“杂环基”是指含有至少一个杂原子作为环原子、去除一个氢原子所衍生的、非芳族的环状基团,杂原子选自co、n、o、s、no、so、s(o)2。包括饱和或部分饱和的单环杂环基和多环杂环基;所述杂环基与连接位置无关(即,可以通过碳原子或杂原子结合)。所述多环杂环基包括稠杂环基、螺杂环基、桥杂环基。所述“杂环基”优选5-6元单杂环基、8-14元稠杂环基、7-11元螺杂环基、5至14元桥杂环基。所述“杂环基”的具体实例包括但不限于
87、除非另有规定,所述的“稠杂环基”是指由两个或两个以上环状结构彼此共用两个相邻的原子所形成的、含有至少一个环原子为杂原子的、饱和或部分饱和的非芳香性环状基团;所述杂原子一般选自co、n、o、s、no、so、s(o)2。本发明所述的“8-14元稠杂环基”包括“8-14元饱和稠杂环基”和“8-14元部分饱和稠杂环基”。稠和方式可以为5-6元杂环基并5-6元环烷基、5-6元杂环基并5-6元杂环基、5-6元杂芳基并5-6元杂环基、苯并5-6元杂环基。所述的稠杂环基的具体实例包括但不限于:
88、除非另有规定,所述的“螺杂环基”是指由两个或两个以上环状结构彼此共用一个环原子所形成的、含有至少一个环原子为杂原子的、饱和或部分饱和的环状结构。所述杂原子一般选自co、n、o、s、no、so、s(o)2。所述“7-11元螺杂环基”包括“7-11元饱和螺杂环基”和“7-11元部分饱和螺杂环基”。具体实例包括但不仅限于:等。
89、除非另有规定,所述的“桥杂环基”指任意两个环共用两个不直接连接的原子的多环杂环基团,其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统,其中一个或多个环原子为选自co、n、o、s、no、so、s(o)2的杂原子,其余环原子为碳。优选为5至14元,更优选为7至14元。根据组成环的数目可以分为双环、三环。具体实例包括但不仅限于:
90、
91、本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
92、本发明所使用的溶剂可经市售获得。
93、本发明的化合物结构是通过核磁共振(nmr)或/和液质联用色谱(lc-ms),或超高效液质联用色谱(uplc-ms)来确定的。nmr化学位移(δ)以百万分之一(ppm)的单位给出。nmr的测定是用bruker neo 400m或者bruker ascend 400核磁仪器,测定溶剂为氘代二甲基亚砜(dmso-d6),氘代甲醇(cd3od)和氘代氯仿(cdcl3),重水(d2o),内标为四甲基硅烷(tms)。
94、液质联用色谱lc-ms的测定用agilent 1260-6125b single quadrupole massspectrometer,质谱仪(离子源为电喷雾离子化)。
95、超高效液质联用色谱uplc-ms的测定用waters uplc h-class sqd质谱仪(离子源为电喷雾离子化)。
96、hplc的测定使用waters e2695-2998或waters arc和agilent 1260或agilentporoshell hph高效液相色谱。
97、制备hplc使用waters 2555-2489(10μm,ods250cm×5cm)或gilson trilutionlc。
98、手性hplc测定使用waters acquity upc2;柱子为daicel chi环clpak ad-h(5um,4.6*250mm)。
99、超临界流体色谱(sfc)使用waters sfc 80q。
100、本发明实施例中的起始原料是已知的并且可以在市场上买到,或者可以采用或按照本领域已知的方法来合成。
101、在无特殊说明的情况下,本发明的所有反应均在连续的磁力搅拌下,在干燥氮气或氩气气氛下进行,溶剂为干燥溶剂,反应温度单位为摄氏度。
本文地址:https://www.jishuxx.com/zhuanli/20240619/416.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。