用于通过助溶剂水溶助剂与阴离子萃取剂或螯合萃取剂的协同组合液-液萃取稀土元素或锕系元素的方法与流程
- 国知局
- 2024-06-20 13:36:07
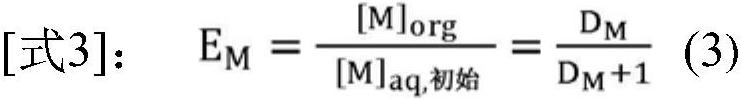
本发明涉及从含有稀土元素或锕系元素的酸性水溶液中萃取和纯化稀土元素或锕系元素的领域。根据本发明的方法特别适用于萃取铀(u)、镧(la)、钕(nd)、铕(eu)、镝(dy)、铒(er)、镱(yb)或其混合物。
背景技术:
0、技术背景
1、现代冶金学主要包括湿法冶金、火法冶金、电冶金和核方法。湿法冶金方法是萃取和纯化稀土元素和锕系元素的主要参考技术。
2、除了金、银、铜和铂的天然矿床外,自然界中发现的金属主要以盐和矿物质的形式出现,这是与周围化学元素发生自然反应过程的结果。通常,所需的金属是从矿物质或矿石中提取的。最著名的含铀矿石是晶质铀矿,以前被称为沥青铀矿。稀土元素存在于各种矿物中,如氟碳铈镧矿、独居石、磷钇矿、铈铌钙钛矿和磷灰石。采矿过程之后是机械和化学分离、富集和纯化步骤。获得的原材料,如足够纯度的稀土氧化物或用于核燃料的铀浓缩物(也称为“黄饼”),然后被用于生产产品。稀土元素对于现代消费电子产品是必不可少的化合物,也用作风力涡轮发电机或电动汽车电机的磁性化合物。因此,这些金属对于广泛的现代发明至关重要,对于开发高效、无碳和环保的技术极其重要。这些金属是现代氢化物电池、混合动力和电动汽车、智能手机、高清屏幕、激光技术、原油精炼、催化以及作为发电机中磁性化合物的永磁体的重要成分。
3、锕系元素是周期表中从锕(第89号)到铹(第103号)的15种化学元素的家族。这些重金属因其相关的化学性质而得名于该家族的第一种元素锕。除了铹属于d区元素外,其余锕系元素都是f区元素。所有锕系元素都具有放射性,通过放射性衰变释放能量。锕系元素都能裂变为快中子,有些能裂变为热中子。铀、钍和钚是地球上最丰富的锕系元素。与自然界中含量可观的镧系元素不同(钷除外),大多数锕系元素都是非常稀有的元素。最丰富的自然元素是钍和铀;最容易合成的是钚。其他的锕系元素只能以痕量发现。
4、因此,稀土元素和锕系元素的可获取性对于开发和推广无二氧化碳技术至关重要。核电站使生产能源而不排放二氧化碳成为可能。法国政府于2015年通过的能源转型法案(the energy transition act)旨在实现更加多元化的低碳发电组合。计划到2030年,核能的总份额将达到50%左右。因此,核电和核燃料循环将继续在法国能源政策中发挥重要作用。
5、此外,任何产品的寿命都是有限的。对于包含稀土元素的电子设备,如智能手机,寿命通常估计为两到三年,而包含稀土元素的磁体可以使用大约15年。核燃料棒的停留时间取决于反应堆的类型和使用的燃料,但燃料通常会在反应堆中停留4年至6年。当含金属产品达到报废状态时,回收策略对于减少产生的废物量和增加可再利用材料的数量非常重要。对于核燃料和稀土元素,有各种回收和废物管理策略。
6、任何回收策略都必须有效、廉价且适用于工业规模。此外,在金属的整个生命周期中,必须考虑生态、可持续和绿色化学方面。
7、最古老且现在被认为是“成熟”的分离程序之一是液-液萃取,也称为溶剂萃取。该程序通常应用于原材料的萃取和生产之间,以及产品报废后的原材料回收和废物分类。在核燃料循环管理领域,液-液萃取用于分离和隔离放射性裂变产物(特别是法国的purex和diamex方法)。举例来说,purex(钚、铀、还原、萃取)化学方法是一种处理废核燃料的方法,自1947年以来一直用于通过液-液萃取法从次要锕系元素和裂变产物中独立分离钚和铀,其中使用由十二烷中30%磷酸三丁酯(tbp)构成的有机溶剂萃取铀和钚。然后在硝酸相中回收裂变产物,然后通过钚还原从铀/钚溶液中萃取钚。
8、这些过程使得从裂变产物(如铯)和超铀元素(镅、锔等)中分离铀和钚成为可能。尽管以前被视为废物,但这些超铀元素可以再次用于第四代发电机的封闭燃料循环。此外,液-液萃取能够从原矿和电气和电子设备废物(weee)中选择性分离稀土元素。
9、iupac(国际纯粹与应用化学联合会)将湿法冶金液-液萃取定义为将溶解物质从一种液相转移到与之接触的另一种(不混溶或部分混溶的)液相的过程。两相之间溶质种类的分布(分布系数)使得有可能估计给定萃取方法的效率。如果一种以上的化合物被溶解并可被萃取,所选方法的选择性对于获得所需结果非常重要。
10、液-液萃取过程的最终目标是选择性地将(所需的)离子从a相转移到b相,而不需要的离子保留在a相中。反萃取是相反的步骤。控制温度和ph值的连续萃取和反萃取循环构成了稀土元素或锕系元素与其他金属(例如铁)分离的基础。
11、术语“湿法冶金”是指从矿石、精矿和再循环或残余材料中回收金属。在采矿和回收阶段,主要步骤是沥滤、浓缩和回收。在湿法冶金的背景下,a相在大多数情况下代表负载了需要和不需要的离子的酸性水相。该相也称为“进料溶液”,是通过用酸处理矿石和矿物或在循环情况下有价值的废物(如电子和金属废物或用过的核燃料棒)产生。这种湿化学过程被称为“浸提”,是萃取循环的第一步。
12、在第二步即所谓的浓缩步骤中,进料溶液与配制的有机相接触。该步骤旨在将所需的离子萃取到有机相中,这是使用三元或四元配方的液-液萃取领域。在目前已知和使用的所有方法中,有机相含有一种或多于一种纯的或稀释在稀释剂中的络合萃取剂,并且通常含有相改性剂。
13、在用所需金属装载有机相之后,第三步是“反萃取”,在此期间,所述金属从有机相(“萃取物”)中被反萃取到新的水相中。回收有机溶剂,并可再次用于另一个萃取循环。
14、任何液-液萃取过程的成功都取决于化合物在两相之间的分布。根据iupac关于水性/有机体系的惯例,这种分布由摩尔浓度标度上的分配比(da)来描述。该分配比被定义为“元素在有机相中的总分析浓度相对于其在水相中的总分析浓度,通常在平衡状态下测量”。分配比da对应于有机相中溶质物质a的摩尔浓度([a]org)与水相中相同溶质物质a的摩尔浓度([a]aq)之比。
15、da越高,有机相中的溶质a越多,萃取越有效。在萃取一种以上溶质(物质a和b)的情况下,溶剂萃取系统的选择性由根据以下式(1)的分离因子(s)描述:
16、[式1]
17、sa/b=da/db=[a]org·[b]aq/[a]aq·[b]org (1)
18、其中:
19、da和db分别是a和b两种物质的分配比。两个分配比da和db之间的差异越大,液-液萃取过程对具有较高d的物质的选择性越强。
20、回收稀土元素的主要障碍之一是,大多数产品中稀土元素的使用量从1毫克到几千克不等。这一点,加上其应用的复杂性,以及由于其相似的性质而难以将不同的元素相互分离以获得纯净和独特的元素,意味着目前只有不到1%的稀土元素被回收。液-液萃取是可能的改进方式,因为一些萃取镧系元素阳离子的方法已经在工业规模上应用。
21、工业中使用的主要液-液萃取方法尤其在所用溶剂类型以及萃取和洗涤方法方面有所不同。在这些过程中使用的溶剂使得以通常大于99.9%的纯度萃取各种稀土元素成为可能。商业上最常用的溶剂是有机磷萃取剂,如磷酸、膦酸和次膦酸;羧酸和烷基磷酸酯。这些是例如二-2-乙基己基磷酸(hdehp)、2-乙基己基膦酸(hehehp)、双(三甲基-2,2,4-戊基)次膦酸(如以商品名272销售的产品)、支链羧酸的混合物如以商品名versatictmacid 10和versatictm acid 911销售的产品、磷酸三正丁酯(tbp)或aliquat 336。
22、磷酸三丁酯(tbp)长期以来一直是主要工业集团在萃取过程中最常用的溶剂。季铵和叔羧酸(叔碳酸)也在商业上使用。
23、尽管在稀土元素成熟有效的生产和纯化方法中使用了这些通常用石油馏分(煤油等)稀释的配方,与这些配方的使用相关的一些问题引起了科学家和技术人员的关注。
24、从还含有溶解的三价镧系元素物质(ln3+)的硝酸盐水溶液中分离三价锕系元素阳离子(an3+)具有挑战性。分离三价锕系元素和镧系元素阳离子的困难源于离子半径和水合数的相似性。因此,在第一步中,在非常高的硝酸浓度下用purex萃余液进行ln3+/an3+共萃取。这一过程被称为diamex(diamide extraction,二酰胺萃取),使用丙二酰胺基萃取剂,如n,n′-二甲基-n,n′-二辛基己基乙氧基丙二酰胺(dmdohema)。在第二步中,使用sanex(separation of actinoides by extraction,通过萃取分离锕系元素)萃取方法在酸性较低的条件下分离镧系元素和锕系元素阳离子。次要锕系元素阳离子am3+和cm3+最终通过另一个类似于diamex的过程分离。
25、n,n-二烷基酰胺(或等同地,单酰胺萃取剂)已被证明是用于锕系元素萃取的有前途的萃取剂。n,n-二烷基酰胺对六价和四价锕系离子具有良好的亲和力,对主要裂变产物的亲和力较低。这组萃取剂微溶于水溶液,对化学降解和辐射分解稳定。合成和纯化相当简单,通过改变三个烃链可以轻松调节物理化学性质和选择性。n,n-二烷基酰胺的主要优点是可以同时萃取铀和钚,而不像tbp那样需要氧化还原步骤和额外的还原剂。铀和钚的分离可以通过调节水溶液的ph值来实现。
26、然而,据观察和模拟,增加有机相(由在脂肪族稀释剂中稀释的单酰胺构成)中铀的浓度会导致黏度增加,这对于常规萃取器中的工业应用可能是禁止的(m.pleines,"viscosity-control and prediction of microemulsions.university of montpellierthesis,"phd thesis,2018)。因此,如果这些化合物的溶剂化较差,与水相平衡的有机相分离成两个不同的相。这就是所谓的“第三相”现象。
27、无论所研究的配方的性质如何,“第三相”的形成是使用已知溶剂的主要障碍,因为在所有工业系统中,第三相是稳定的黏性乳液,其会停止液-液萃取,需要完全排空和清洗容器,这在稀土金属的情况下成本极高,在含有放射性元素的萃取情况下实际上是不可能的。出现第三相的风险是限制过程强化和成本的因素。已发表的第三相出现的罕见理论模型(c.erlinger等人,attractive interactions between reverse aggregates andphase separation in concentrated malonamide extractant solutions",langmuir,vol.15,no.7,pp.2290-2300,mar.1999,doi:10.1021/la980313w)还不足以预测作为指导,并且在实践中通过在中试或预中试工厂中进行系统的试错试验来避免第三相。这导致操作人员在酸和金属浓度低于loc(limiting organic concentration,极限有机浓度)的条件下进行操作,这实际上将常规商业溶剂的负载能力限制在100g.l-1以下。为了达到这一最大负载能力,使用了几种方法来提高loc,例如提高稀释剂的温度和极性,或在溶剂中使用相改性剂,例如脂肪醇、如todga-十二烷体系中的dhoa的单酰胺,或例如truex锕系元素(iii)/镧系元素(iii)共萃取方法的cmpo-十二烷体系中使用的tbp等磷酸盐,在所有情况下都不利于萃取效率和选择性。
28、因此,需要以高性能、低成本和环境友好的方式选择性萃取一种或多于一种属于稀土元素或锕系元素的元素的方法,同时避免这种第三相现象。
29、因此,为了满足这一需求,发明人开发了本发明主题的萃取方法。
30、出乎意料的是,根据与现有技术完全相反的推理,本发明人发现通过用非离子水溶助剂代替通常用于液-液萃取的全部或部分支链烷烃型稀释剂,可以完全避免第三相现象。
31、更确切地说,本发明涉及设计用于回收一种或多于一种属于稀土元素或锕系元素的元素的萃取方法,其中非离子水溶助剂(助溶剂)与溶剂化或离子(阳离子或阴离子)萃取剂组合用作新的萃取系统。所述新型萃取系统取代了液-液萃取过程中常规使用的有机相,该有机相包含萃取剂分子、通常为脂肪族的稀释剂和相改性剂。
32、因此,本发明的目的是用于从含有选自稀土元素和锕系元素的金属的至少一种盐的酸性水相中液-液萃取所述金属的所述至少一种盐的方法,所述方法的特征在于其至少包括以下步骤:
33、(i)制备平衡的酸性水相(phaq.e),其包含所述金属的所述至少一种盐和初始量q1的至少一种非离子水溶助剂,
34、(ii)制备有机相(phorg),其包含初始量q2的至少一种非离子水溶助剂和至少一种萃取剂,(iii)使上述步骤(ii)中制备的所述有机相与上述步骤(i)中制备的所述平衡的酸性水相接触,以获得混合物m,
35、(iv)搅拌所述混合物m,然后
36、(v)将所述有机相与平衡的酸性水相分离。
37、借助于根据本发明的液-液萃取方法,可以从酸性水相中有效地和选择性地萃取稀土元素和锕系元素的金属,同时降低当所述金属进入有机相时黏度的增加,并降低或消除当使用常规溶剂如烃实施萃取方法时通常观察到的所谓的“第三相”效应。特别地,根据本发明的萃取方法使得能够从酸性溶液中萃取可能存在于酸性溶液中的至少一种稀土元素和/或锕系元素,相对于可能也存在于所述酸性溶液中的金属杂质,特别是相对于铁,具有高萃取率和高选择性。根据本发明的方法的优点之一还在于,其可以在包括几个级(通常为2至10级)的萃取装置中实施,这些级根据本领域技术人员公知的技术逆流操作。此外,根据本发明的液-液萃取过程可以在闭合回路中进行,从而使流出物最少并显著降低成本。最后,根据本发明的方法容易适用于任何液-液萃取方法和工业上现有的任何萃取设备。
38、本发明特别适用于在制造燃料元件之前纯化铀,处理辐射核燃料,或从矿石浓缩物的磷酸盐中萃取铀。
39、本发明还能应用于稀土元素的生产,无论是从富含稀土元素的天然矿石如独居石、氟碳铈矿或磷钇矿的浓缩物,还是从除富含稀土元素的矿石以外的天然矿石处理得到的浓缩物,如来自“城市矿山”的浓缩物,即“矿山”由工业和家庭消费后的含有稀土元素的废物组成,特别是电气和电子设备(也称为“weee”或“w3e”)产生的废物,或来自含有稀土元素的产品制造的废料精矿,以及为了回收这些水溶液中存在的稀土而对浸提产生的水溶液进行处理。
40、稀土元素包括钪(sc)、钇(y)和15种镧系元素,即铈(ce)、镝(dy)、铒(er)、铕(eu)、钆(gd)、钬(ho)、镧(la)、镥(lu)、钕(nd)、镨(pr)、钷(pm)、钐(sm)、铽(tb)、铥(tm)和镱(yb)。
41、锕系元素包括从锕(第89号-ac)到铹(第103号-lr)的15种化学元素,尤其是铀(第92号-u)。
42、根据本发明的方法特别适用于萃取选自所谓的“轻”稀土元素如镧(la)和钕、所谓的“重”稀土元素如铕(eu)、镝(dy)、铒(er)和镱(yb)或甚至铀及其混合物的金属。
43、根据本发明,“水溶助剂”是指既可溶于水相又可溶于有机相的化合物。更准确地说,水溶助剂是在水溶液中溶解疏水化合物的化合物。水溶助剂通常由亲水部分和疏水部分组成(如表面活性剂),但疏水部分通常太短,不会导致自发的自聚集和胶束形成(j.mehringer,werner kunz,2021,advances in colloid and interface science 294,102476)。有酸性、碱性或盐电解质水溶助剂和非电解质水溶助剂。水溶助剂的分子体积大于0.090nm3且小于0.5nm3。
44、非离子水溶助剂尤其可以选自短链或中链伯醇、仲醇或叔醇,以及亚烷基二醇烷基醚。出于本发明的目的,“短链”是具有1个至4个碳原子的碳链,“中链”是具有5个或6个碳原子的碳链。
45、根据本发明的一个具体实施方案,步骤(i)和(ii)中使用的非离子水溶助剂选自:
46、-亚烷基二醇烷基醚,烷基选自甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基和戊基,亚烷基选自亚乙基、亚丙基和二亚丙基;和
47、-包含c2至c3烷氧基的伯醇。
48、在这些水溶助剂中,可以特别提及1-丙氧基-2-丙醇(pnp)、二丙二醇正丙基醚(dpnp)和乙二醇单戊基醚(c5e1)。其中,1-丙氧基-2-丙醇是特别优选的。
49、根据本发明的一个特别优选的实施方案,平衡的酸性水相中存在的非离子水溶助剂与有机相中存在的非离子水溶助剂相同。
50、“酸性水相”是指有机酸或无机酸的溶液,所述酸被称为“强酸”或“弱酸”。
51、酸性水相尤其可以是包含所述金属的盐的天然或城市矿石浓缩物的酸性溶液。
52、根据本发明方法的不同步骤使用的酸性水相中存在的酸可以特别选自强酸如硝酸、磷酸、硫酸、盐酸及其混合物,弱酸如乙酸、甲酸、柠檬酸和酒石酸及其混合物,以及至少一种强酸和至少一种弱酸的混合物。
53、根据本发明的一个具体实施方案,平衡的酸性水相包含至少一种浓度范围为1×10-4摩尔/升至6摩尔/升、优选约0.01摩尔/升至4摩尔/升的强酸。
54、根据一个具体实施方案,当酸性水相中存在的酸是强酸,例如硝酸时,酸浓度优选为0.01摩尔/升至3摩尔/升。
55、根据本发明的另一个具体实施方案,酸性水相包含至少一种弱酸,例如乙酸,浓度范围为1摩尔/升至6摩尔/升,优选1摩尔/升至3摩尔/升。
56、酸性水相中金属盐的浓度优选约0.01摩尔/升至1.0摩尔/升。
57、根据本发明的萃取方法,步骤(i)是预平衡步骤,向含有选自稀土元素和锕系元素的金属的至少一种盐的酸性水溶液中加入包含初始量q1的至少一种水溶助剂的预平衡相,以获得平衡的酸性水相(phaq.e)。
58、预平衡步骤使得所述酸性水相被所述预平衡相饱和,因此使得水相和有机相在萃取过程(步骤(iii)和(iv))中保持稳定。
59、根据本发明的一个特别优选的实施方案,预平衡相是纯1-丙氧基-2-丙醇(pnp)或纯二丙二醇正丙基醚(dpnp)或纯乙二醇单戊基醚(c5e1)。在这种情况下,水溶助剂的初始量q1对应于用于饱和酸性水相的纯水溶助剂的体积。
60、优选地,步骤(i)通过遵守约1:1至1:10、甚至更优选约1:3的预平衡相/酸性水相体积比来进行。
61、步骤(i)的持续时间通常为5分钟至60分钟,优选5分钟至20分钟,甚至更优选该持续时间为约10分钟。10分钟的持续时间使得能够用所述预平衡相实现水相的饱和。
62、步骤(i)通常在约20℃至50℃的温度下进行。优选地,步骤(i)在环境温度下进行,即在约20℃至25℃的温度下进行。
63、步骤(i)优选在至少等于大气压的压力下进行,甚至更优选在大气压下进行。
64、根据一个具体实施方案,在步骤(i)之前,根据本发明的方法还可以包括至少一个初步浸提步骤。该初步浸提步骤可以以常规方式进行,例如通过使包含待萃取的稀土元素和/或锕系元素的固体材料与包含高浓度强酸如硫酸、盐酸或最常见的硝酸或弱酸如乙酸的溶液接触。该浸提步骤使得能够获得选自稀土元素和锕系元素的元素的溶液。
65、根据本发明,有机相包含初始量q2的至少一种非离子水溶助剂和至少一种萃取剂。该有机相的密度通常与酸性水相的密度相差至少0.1mg/l,这使得在步骤(v)中容易分离水相和有机相。
66、在步骤(ii)中制备的有机相中存在的萃取剂可以选自带电或中性分子以及这些分子的混合物,所述带电或中性分子对从平衡的酸性水相中萃取的至少一种元素具有特异性。萃取剂尤其可以选自磷基非离子萃取剂、酰胺、羧酸盐和一些双官能分子。根据一个优选实施方案,萃取剂选自双(2-乙基己基)磷酸(hdehp)、n,n′-二甲基-n,n′-二辛基己基-乙氧基-丙二酰胺(dmdohema)、n,n-二-(2-乙基己基)异丁酰胺(dehiba)、三辛胺(toa)及其混合物。
67、根据本发明方法的一个具体实施方案,从平衡的酸性水相中待萃取的金属是镧系元素,萃取剂选自hdehp、dmdohema及其混合物。
68、根据本发明方法的一个特别有利的实施方案,当从平衡的酸性水相中待萃取的金属是镧系元素时,萃取剂是hdehp和dmdohema的混合物。事实上,如以下实施例所示,用由这种混合物组成的萃取剂获得的镧系元素的萃取率大于仅由hdehp或仅由dmdohema组成的萃取剂获得的萃取率之和,这表明hdehp和dmdohema的混合物对根据本发明的方法的稀土元素萃取率具有协同效应。
69、当萃取剂是hdehp和dmdohema的混合物时,dmdohema/hdehp混合物中dmdohema的摩尔分数优选为0.3至0.8。特别优选地,dmdohema/hdehp混合物中dmdohema的摩尔分数为0.5,这对应于最高的协同效应。
70、根据本发明方法的一个具体实施方案,从平衡的酸性水相中待萃取的金属是锕系元素,特别是铀,萃取剂选自dehiba、toa及其混合物。
71、根据本发明方法的一个优选实施方案,有机相仅由至少一种萃取剂和非离子水溶助剂组成,即有机相不包含任何其他物质,尤其是不包含有机稀释剂。在工业规模上管理双组分有机废水确实比管理多组分有机废水简单。
72、根据本发明的一个优选实施方案,存在于有机相中的水溶助剂的初始量q2为约0.1摩尔/升至10摩尔/升,甚至更优选为约1.5摩尔/升至8摩尔/升。
73、尽管这并不代表本发明方法的一个优选实施方案,但是除了萃取剂和非离子水溶助剂之外,有机相还可以包含脂肪族类型的有机稀释剂。在这种情况下,有机相优选包含至少0.5摩尔/升的非离子水溶助剂,优选至少4摩尔/升,甚至更优选5摩尔/升的非离子水溶助剂。
74、接触步骤(iii)可以通过简单混合平衡的酸性水相和有机相来进行。
75、根据一个优选实施方案,水相和有机相以1:1至1:4的体积比混合,甚至更优选以等于1:1的体积比混合。
76、搅拌步骤(iv)对应于实际的萃取步骤,在该步骤中最初存在于平衡的酸性水相中的金属盐全部或部分进入有机相。
77、步骤(iv)通常在20℃至50℃的温度下进行,优选在20℃至30℃的温度下进行,甚至更优选在20℃至25℃的温度下进行,即在环境温度下进行。
78、步骤(iv)中有机相与平衡的酸性水相的分离可以通过例如离心进行。
79、根据本发明的一个特定且优选的实施方案,该方法在包括几个级的萃取装置中实施,优选以逆流方式操作,级中的每一级都能够实施步骤(iii)至(v)。在这种情况下,在每个步骤(v)之后和每个步骤(iii)之前,该方法还包括至少一个中间步骤,将酸性水相中和有机相中存在的非离子水溶助剂的量分别重新调节至与初始值q1和q2相同的值。
80、然后可以回收从平衡的酸性水相萃取并在分离后存在于有机相中的金属盐。
81、因此,根据一个优选实施例,该方法至少还包括:
82、-步骤(vi),用于在步骤(v)结束时反萃取有机相中存在的金属盐,所述步骤(vi)包括至少使所述有机相与被称为“反萃取溶液”的水相接触,所述溶液包含初始量q3的至少一种非离子水溶助剂,然后
83、-从所述反萃取相中分离有机相以回收包含所述金属的盐的反萃取相的步骤(vii)。
84、反萃取溶液可以由水组成,特别是蒸馏水,即反萃取溶液仅包含水和所述非离子水溶助剂,或者水和至少一种酸以及所述非离子水溶助剂的混合物。
85、反萃取溶液中离子水溶助剂的初始浓度q3优选为约0.1摩尔/升至5摩尔/升,甚至更优选为约0.5摩尔/升至4摩尔/升。
86、根据本发明的一个特别有利和优选的实施方案,反萃取溶液中存在的非离子水溶助剂与有机相的非离子水溶助剂相同,其本身优选与平衡的酸性水相中存在的非离子水溶助剂相同。
87、当反萃取溶液含有酸时,所述酸优选与平衡的酸性水相中存在的酸相同。
88、根据本发明的一个优选实施方案,步骤(vi)和(vii)在多级反萃取器组中进行,优选与能够实施步骤(vi)和(vii)的级中的每一级逆流操作。在这种情况下,在每个步骤(vii)之后和每个步骤(vi)之前,根据本发明的方法还包括至少一个中间步骤,将反萃取溶液中存在的非离子水溶助剂的量重新调节至与初始值q3相同的值。
89、本发明的第二目的是如上定义的有机相的用途,即包含至少一种萃取剂和非离子水溶助剂的有机相,用于从含有选自稀土元素和锕系元素的金属和非离子水溶助剂的酸性水相中萃取所述金属的用途。
90、根据该用途,有机相优选仅包含一种或多于一种萃取剂和非离子水溶助剂。在这种情况下,所述有机相不包含任何其他物质,尤其是不包含任何有机稀释剂。
91、根据该用途的一个优选实施方案,有机相的非离子水溶助剂与酸性水相的非离子水溶助剂相同。
92、本发明的其他特征和优点将从以下实施例的详细描述中变得显而易见,因此从附图中变得显而易见,其中:
93、[图1]:图1说明了在两种不同的酸浓度下水相中酸的性质对该酸性水相中铕(eu)萃取的影响:图1(a):1m和图1(b):0.03m;
94、[图2]:图2显示了稀土元素(la、nd、eu、dy、er、yb)相对于铁的选择性系数的变化过程,表示为酸的性质的函数sln/fe。图2(a):硝酸,图2(b):磷酸,图2(c):硫酸和图2(d):盐酸;
95、[图3]:图3显示了铕萃取率随时间的变化;
96、[图4]:图4说明了萃取后pnp对有机相相对黏度的影响;
97、[图5]:图5显示了与常规萃取系统相比,含有水溶助剂的有机相的负载能力;
98、[图6]:图6说明了水相中的酸浓度和有机相中的萃取剂浓度对铕萃取的影响;
99、[图7]:图7说明了在两种不同的酸浓度下,水相中酸的性质对从该酸性水相中萃取铕(eu)的影响:图1(a):0.3m和图1(b):1m;
100、[图8]:图8显示了与含有正十二烷的有机相相比,含有水溶助剂的有机相的负载能力;
101、[图9]:图9显示了铕萃取率随时间的变化。
102、[图10]:图10显示了使用pnp对协同作用的影响;
103、[图11]:图11显示了作为dmdohema萃取剂的摩尔分数(表示为xdmdohema)的函数的分配系数(表示为dln,eq)的变化过程;
104、[图12]:图12显示了作为所用水溶助剂性质的函数的铕分配系数的变化过程;
105、[图13]:图13显示了铕分配系数与两种不同萃取剂的水相酸度的函数关系。图13(a):hdehp和图13(b):dmdohema;
106、[图14]:图14显示了两种不同萃取剂的稀土元素分配系数随水相酸度变化的过程。图14(a):hdehp和图14(b):dmdohema;
107、[图15]:图15显示了铀分配系数随萃取剂dehiba浓度变化的过程;
108、[图16]:图16显示了铀分配系数随萃取剂toa浓度变化的过程;和
109、[图17]:图17示意性地表示了根据本发明的回收方法的一个示例性实施方式,其设计用于在工业规模上从酸性水相中萃取稀土元素和铀。
110、实施例
111、以下实施例中报告的实验结果是使用酸性水相获得的,所述酸性水相包含轻稀土元素即镧(la)和/或钕(nd)以及重稀土元素即铕(eu)、镝(dy)、铒(er)和/或镱(yb)或锕系元素即铀。为了评价所研究的萃取系统的选择性,铁也被加入到水相中。
112、作为萃取剂,双(2-乙基己基)磷酸(hdehp)和n,n′-二甲基,n,n′-二辛基己基乙氧基丙二酰胺(dmdohema)已被用于萃取稀土元素,而铀则是用二乙基己基异丁酰胺(dehiba)或三辛胺(toa)萃取的。通过将含有待萃取元素的预平衡水溶液与有机相接触,从硝酸、硫酸、磷酸或盐酸的水溶液中萃取这些元素,所述有机相包含浓度为0.1摩尔/升至2摩尔/升的萃取剂,所述萃取剂稀释于以下水溶助剂(稀释剂)之一中:1-丙氧基-2-丙醇(pnp)、二丙二醇正丙基醚(dpnp)或乙二醇单戊基醚(c5e1)。然后将获得的结果与通过将相同萃取剂溶解在“常规”脂肪族或芳香族稀释剂如正十二烷、氢化四丙烯(tph)、甲苯、异辛烷或异链烷烃溶剂如(ip-175)中获得的结果进行比较。
113、以下实施例中报告的分配系数、萃取率和选择性系数是根据液-液萃取领域的惯例确定的,即:
114、金属元素m在两个分别为有机相和水相的相之间的分配系数,表示为dm,由下式(2)确定:
115、
116、其中:
117、[m]org是萃取后有机相中金属元素m的浓度,
118、[m]aq是萃取后水相中金属元素m的浓度。
119、从水相中萃取金属元素m的萃取率,表示为em,由下式(3)确定:
120、
121、其中:
122、[m]org和dm具有与前面相同的含义;而[m]aq,初始是萃取前水相中金属元素m的浓度;而金属元素m1相对于金属元素m2的选择性系数,表示为sm1/m2,由下式(4)确定:
123、
124、其中:
125、dm1是金属元素m1的分配系数,以及
126、dm2是金属元素m2的分配系数。
127、实施例1:根据本发明的方法使用阴离子萃取剂(hdehp)分离镧系元素(la、nd、eu、dy、er和yb)
128、1.1酸的性质的影响
129、旨在从酸性水相中萃取稀土的试验首先在试管中进行,使用:
130、-作为有机相:由浓度设定为0.6摩尔/升的萃取剂hdehp在pnp中稀释组成的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂的萃取实验。为了进行比较,将异链烷烃溶剂ip 175作为基准;和
131、-作为水相:仅用pnp预平衡的水溶液,包含10mm水合硝酸铕和0.03m或1m硝酸、磷酸、硫酸或盐酸,pnp/水相体积比为3:1。
132、在室温和旋转搅拌下,有机相和水相以1(v/v)的有机相(org)/水相(aq)比(org/aq)相互接触1小时。然后通过以5000rpm离心20分钟分离有机相和水相。通过电感耦合等离子体原子发射光谱法(icp-aes,由ametek销售的spectro arcos仪器)和能量色散x射线荧光光谱法(edxrf-spectro仪器,由ametek销售的xepos型号)测量了由此回收的水相和有机相中铕的浓度。
133、这些试验的结果见附图1,该图表示铕的分配系数deu与所用酸的性质的函数关系。在这些图中,白色条给出的结果对应于不根据本发明并使用isane ip 175作为溶剂进行的对比萃取方法,阴影条对应于根据本发明并使用pnp作为水溶助剂进行的萃取方法。图1(a)显示了所用不同的酸浓度设定为1m的情况,而图1(b)显示了浓度设定为0.03m的情况。
134、如图1(a)所示,在1m的酸浓度下,当hdehp萃取剂在isane ip 175中稀释时,没有观察到可测量的铕萃取。另一方面,这些结果表明通过在有机相中用pnp代替isane ip 175极大地促进了hdehp萃取剂对铕的萃取,因为观察到分配系数增加了至少10倍。
135、图1(b)显示,通过使用isane ip 175作为溶剂并在0.03m的酸浓度下萃取铕,分配系数与图1(a)相比显著增加,并且在pnp的情况下观察到萃取的明显改善,至少为2倍。这与文献一致,据发明人所知,该文献没有提到任何研究表明用常规稀释剂从酸度大于或等于1m的水相萃取稀土元素的可能性。
136、1.2相对于铁的选择性研究
137、通过在试管中使用以下物质进行测试,相对于所有方法中的主要杂质铁,对稀土元素的萃取选择性进行了评估:
138、-作为有机相:包含浓度设定为0.6摩尔/升的稀释于pnp中的hdehp作为萃取剂的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂的萃取实验。为了进行比较,将异链烷烃溶剂ip175作为基准;和
139、-作为水相:含镧(la)、钕(nd)、铕(eu)、镝(dy)、铒(er)、镱(yb)和铁(fe)的水溶液,稀土元素浓度分别为10mm,铁的浓度为30mm。这些水溶液已在含有1m硝酸、磷酸、硫酸或盐酸的酸性溶液中稀释。
140、在室温下,在旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1小时。然后通过以5000rpm离心20分钟分离有机相和水相。已经测量了由此回收的水相和有机相中稀土元素和铁的浓度(icp-aes和edxrf如上文第1.1节所示)。
141、这些测试的结果在附图2中报告,该图代表了使用不同的酸相对于铁的稀土元素的选择性系数,表示为sfln/fe:(a)硝酸、(b)磷酸、(c)硫酸和(d)盐酸。在这些图中,白色条给出的结果对应于不根据本发明并使用isane ip 175作为溶剂进行的对比萃取方法,阴影条对应于根据本发明并使用pnp作为水溶助剂进行的萃取方法。
142、如这些图所示,根据本发明的方法,用pnp代替isane ip 175后,萃取所有稀土元素相对于铁的选择性显著提高。
143、1.3萃取动力学
144、时间对萃取效率的影响已通过在试管中进行的测试进行了评估,使用:
145、-作为有机相:包含浓度设定为0.6摩尔/升的稀释于pnp中的hdehp作为萃取剂的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂的萃取实验。为了进行比较,将异链烷烃溶剂ip175作为基准;和
146、-作为水相:在超纯水(即milli-q水,25℃时电阻率大于18mω/cm)中含有0.03摩尔/升硝酸的酸性溶液中含有10mm铕(eu)的水溶液。
147、在室温和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1分钟、3分钟、10分钟、30分钟、60分钟、120分钟和180分钟。然后通过以5000rpm离心20分钟分离有机相和水相。测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf,如上文第1.1节所示)。
148、这些试验的结果见附图3,该图表示铕萃取率(e%)随时间(分钟)的变化。在该图中,实心圆曲线对应于根据不符合本发明的方法使用ip 175作为溶剂进行的实验,实心方块的曲线对应于根据本发明的方法使用pnp作为水溶助剂进行的实验。
149、如图3所示的结果所示,使用根据本发明方法的pnp,铕萃取动力学更快,10分钟后达到80%的产率平台,30分钟后达到99%的产率平台,而使用不根据本发明的方法获得相同的99%产率需要两倍的时间,即60分钟。
150、1.4萃取后有机相的黏度
151、有机相中的黏度是工业规模上需要考虑的关键参数。为此,盐和萃取剂的浓度对萃取后有机相黏度的影响已经通过在试管中进行的试验进行了评估,使用:
152、-作为有机相:含有浓度为0.6摩尔/升至2摩尔/升的萃取剂hdehp在pnp中稀释的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂的萃取实验。为了进行比较,将异链烷烃溶剂ip175作为基准;和
153、-作为水相:在超纯水(即milli-q水,25℃时电阻率大于18mω/cm)中含有0.03摩尔/升硝酸的酸性溶液中含有10mm镝(dy)的水溶液。
154、在室温和旋转搅拌下,使有机相和水相以1(v/v)的org/aa比相互接触60分钟。然后通过以5000rpm离心20分钟分离有机相和水相。使用自动滚球黏度计,参考amvn(antonpaar,格拉茨,奥地利)在25℃下测量萃取前和萃取后有机相的黏度。
155、这些试验的结果见附图4,其中相对黏度(单位为mpa.s)表示为初始镝浓度(cdy.初始单位为摩尔/升)(图4a)或作为初始萃取剂浓度的函数(chdehp.初始单位为摩尔/升)(图4b)。在这些图中,白色条给出的结果对应于不根据本发明且用isane ip 175作为溶剂进行的对比萃取方法,阴影条对应于根据本发明且使用pnp作为水溶助剂进行的萃取方法。
156、如图4所示,当按照本发明的方法进行萃取时,水相的相对黏度几乎不随水相中镝的浓度而变化,作为萃取剂浓度的函数变化很小,并且不超过萃取前有机相黏度的1.5倍。另一方面,当根据不符合本发明的对比方法使用isane ip 175进行萃取时,观察到萃取后有机相的黏度与萃取前相比可增加高达5倍。
157、1.5负载能力
158、为了评估根据本发明的萃取方法的效率,已经进行了负载能力测试并与采用“常规”稀释剂的萃取系统的负载能力进行了比较。
159、负载能力测试已在试管中进行评估,使用:
160、-作为有机相:包含浓度设定为0.6摩尔/升的稀释于pnp中的hdehp作为萃取剂的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂的萃取实验,即使用正庚烷、十二烷、异辛烷和甲苯。
161、-作为水相:在超纯水(即milli-q水,在25℃时电阻率大于18mω/cm)中含有0.03摩尔/升硝酸的酸性溶液中含有浓度为10毫摩尔/升至400毫摩尔/升的铕(eu)的水溶液。
162、在室温和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触60分钟。然后通过以5000rpm离心20分钟分离有机相和水相。测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf,如上文第1.1节所示)。
163、这些测试的结果在附图5中报道,该图表示平衡时有机相中铕浓度的变化,表示为ceu,org,并以毫摩尔/升表示,作为初始水相中铕浓度的函数(ceu,初始/毫摩尔/升)。在该图中,实线曲线对应于根据本发明的方法在pnp存在下的萃取。其他曲线对应于根据不符合本发明的方法用常规溶剂进行的萃取:实心正方形曲线:正庚烷、实心三角形顶点向上的曲线:十二烷、实心三角形顶点向下的曲线:十二烷+5% pnp、实心菱形曲线:异辛烷和空心圆圈曲线:甲苯。
164、图5显示在庚烷、十二烷、异辛烷和甲苯的情况下观察到铕萃取开始饱和,对于前三种稀释剂形成第三相。另一方面,根据本发明的方法,对于pnp既没有观察到饱和也没有观察到第三相,并且对于水相中铕的浓度大于400毫摩尔/升,能够预期负载容量大于250毫摩尔/升。在正十二烷+5% pnp混合物的情况下,负载能力低于用pnp完全替代正十二烷时的负载能力。然而,即使pnp含量为5%,在测试的浓度范围内也避免了第三相。
165、在任何情况下,这些结果表明使用高于400毫摩尔/升的pnp将稀土元素负载到有机相中的可行性,这通常代表稀土元素萃取领域中常规使用的萃取系统的负载极限。
166、1.6水相酸度和有机相中萃取剂浓度的影响
167、硝酸水相的酸度和有机相中萃取剂的浓度对该体系萃取铕能力的影响已通过在试管中进行的试验进行了评估,使用:
168、-作为有机相:包含浓度为0.01摩尔/升至3摩尔/升的稀释于pnp中的hdehp作为萃取剂的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂十二烷的萃取实验。
169、-作为水相:在超纯水(即milli-q水,25℃时电阻率大于18mω/cm)中浓度为0.1摩尔/升至3摩尔/升的硝酸溶液中含有10毫摩尔/升铕(eu)的水溶液。
170、在环境温度和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触60分钟,然后通过以5000rpm离心20分钟进行分离。测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf,如上文第1.1节所示)。
171、这些测试的结果见附图6。图6(a)显示了铕分配系数(deu,eq)随有机相中hdehp(chdehp,初始)摩尔初始浓度的变化,单位为摩尔/升。而图6(b)显示了铕分配系数(deu,eq)随水相中初始硝酸浓度(chno3,初始)的变化,单位为摩尔/升。在该图中,实心圆曲线对应于根据本发明的方法使用pnp进行的萃取,而实心正方形曲线对应于根据不属于本发明的方法使用十二烷进行的萃取。
172、图6(a)显示,根据本发明的方法,增加萃取剂的浓度提高了萃取效率,而没有出现pnp的第三相,这与根据不属于本发明一部分的方法使用常规溶剂十二烷所观察到的情况不同。图6(b)显示增加水相的酸度导致pnp对铕的萃取逐渐减少。对于用十二烷进行的萃取过程,超过1摩尔/升硝酸时,分配系数的值趋于零,而当在pnp存在下进行萃取时,分配系数的下降仍然可以忽略不计。这扩大了根据本发明的方法所使用的酸浓度的范围。
173、实施例2:分离镧系元素的方法:la、nd、eu、dy、er和yb,根据使用dmdohema作为萃取剂的本发明的方法
174、2.1酸的性质的影响
175、旨在从酸性水相中萃取稀土元素的试验首先在试管中进行,使用:
176、-作为有机相:由浓度设定为0.6摩尔/升的萃取剂dmdohema在pnp中稀释而成的相。为了能够将根据本发明方法的萃取实验结果与不属于本发明一部分的对比萃取方法进行比较,平行进行了使用常规溶剂的萃取实验。为了进行比较,将异链烷烃溶剂ip175作为基准;和
177、-作为水相:仅用pnp预平衡的水溶液,包含10mm水合硝酸铕、1m或3m硝酸、磷酸、硫酸或盐酸。
178、在室温和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1小时,然后通过以5000rpm的速度离心20分钟进行分离。已经测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf如上文1.1节中的实施例1所示)。
179、这些测试的结果在附图7中报道,该图表示铕的分配系数,表示为deu,eq,作为所用酸的性质的函数。图7(a)显示了所用不同的酸浓度设定为1m的情况,而在图7(b)中浓度设定为3m。在这些图中,白色条对应于通过使用不根据本发明的ip175实施萃取过程获得的结果,而阴影条对应于通过实施根据本发明的萃取过程并使用pnp获得的结果。
180、如图7(a)所示,在1m酸浓度下,当萃取剂在ip 175中稀释时,没有观察到可测量的铕萃取。另一方面,当在有机相中用pnp代替ip 175时,铕的萃取得到促进,并且注意到分配系数增加了至少20倍。
181、图7(b)显示,使用ip 175作为稀释剂并且在3m的萃取剂浓度下,与图7(a)相比,分配系数显著增加,并且在pnp的情况下,注意到萃取的明显改善,至少为2倍。
182、2.2负载能力
183、为了评估根据本发明的萃取过程的效率,已经进行了负载能力测试并与使用“常规”稀释剂的萃取系统的负载能力进行了比较。
184、负载能力测试已在试管中进行评估,使用:
185、-作为有机相:包含浓度设定为0.6摩尔/升的萃取剂dmdohema在pnp中稀释的相。为了能够比较结果,平行进行了用传统稀释剂十二烷进行的萃取实验。
186、-作为水相:在超纯水(即milli-q水,在25℃时电阻率大于18mω/cm)中含有3摩尔/升硝酸的酸性溶液中含有浓度为10毫摩尔/升至400毫摩尔/升铕(eu)的水溶液;
187、有机相和水相在室温和旋转搅拌下以1(v/v)的org/aq比相互接触60分钟,然后以5000rpm的速度离心20分钟进行分离。已经测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf如上文1.1节中的实施例1所示)。
188、这些测试的结果在附图8中报告,该图表示作为初始水相中铕浓度(ceu,初始,单位为毫摩尔/升)的函数,平衡时有机相中铕浓度的变化,表示为ceu,eq,单位为毫摩尔/升。在该图中,实心圆曲线对应于通过实施根据本发明的萃取过程并使用pnp获得的结果,而实心正方形曲线对应于通过实施不根据本发明的萃取过程并使用十二烷获得的结果。
189、图8显示在十二烷中观察到铕萃取开始饱和,形成第三相。另一方面,对于pnp既没有观察到饱和也没有观察到第三相,并且对于水相中铕浓度大于400毫摩尔/升,能够预期负载能力大于250毫摩尔/升。
190、在任何情况下,这些结果表明使用高于400毫摩尔/升的pnp将稀土元素负载到有机相中的可行性,这代表了稀土元素萃取领域中常规使用的萃取系统的负载极限。
191、2.3萃取动力学
192、时间对萃取效率的影响已通过在试管中进行的测试进行了评估,使用:
193、-作为有机相:含有浓度设定为0.6摩尔/升的dmdohema作为萃取剂在pnp中稀释的相。为了能够比较结果,平行进行了常规稀释剂十二烷的萃取实验;和
194、-作为水相:在超纯水(即milli-q水,25℃时电阻率大于18mω/cm)中含有3摩尔/升硝酸的酸性溶液中含有10mm铕(eu)的水溶液。
195、在环境温度和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1分钟、3分钟、10分钟、30分钟、60分钟、120分钟或180分钟,然后以5000rpm的速度离心20分钟进行分离。已经测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf如上文1.1节中的实施例1所示)。
196、获得的结果在附图9中报告,其中铕的萃取率的变化(e%)表示为时间的函数(单位为分钟)。在该图中,实心正方形曲线对应于通过使用pnp实施根据本发明的方法获得的结果,而实心圆形曲线对应于通过实施不根据本发明的方法并使用十二烷作为萃取剂的溶剂获得的结果。
197、如图9所示,根据本发明的方法,使用pnp萃取铕的动力学更快,15分钟后达到80%的产率值,60分钟后达到99%的产率平台。
198、实施例3:根据本发明的萃取方法使用阴离子和溶剂化协同作用的两种萃取剂(hdehp和dmdohema)来分离镧系元素:镧、钕、铕、镝、铒和镱
199、hdehp和dmdohema的混合物对从硝酸水溶液中萃取稀土元素的协同效应,以及该混合物的dmdohema/hdehp摩尔比对这些萃取性能的影响,已经通过使用以下相进行的萃取试验进行了评估:
200、-作为水相:通过溶解五种氧化态稀土盐(iii)获得的各种形式的相:la(no3)3、nd(no3)3、eu(no3)3、dy(no3)3和yb(no3)3,每种盐的浓度为10毫摩尔/升,溶液中含有超纯水(即milli-q水,在25℃时电阻率大于18mω/cm)中的1摩尔/升硝酸;和
201、-作为有机相:在pnp中包含0.6摩尔/升萃取剂的相,该萃取剂或者仅由dmdohema、仅由hdehp组成,或者由dmdohema和hdehp的混合物组成,其中dmdohema与hdehp的摩尔比变化(从0到1)。为了能够比较结果,平行进行了类似的萃取实验,但使用常规稀释剂ip175。
202、由于铁作为主要杂质天然存在于矿石中,尤其是天然矿石中,水相进一步包含30毫摩尔/升硝酸铁(iii)。
203、使用1(v/v)的水相/有机相(aq/org)体积比进行萃取试验。水相和有机相在恒温(25℃)下接触1小时,之后在25℃下通过离心(5000rpm)20分钟将水相和有机相彼此分离。测量了由此回收的水相和有机相中的稀土元素浓度(icp-aes和edxrf如上文第1.1节中的实施例1所示)。
204、这些测试的结果在图10和图11中给出,其中稀土元素的分配系数表示为dln,eq,是dmdohema相对于hdehp的摩尔分数的函数,表示为xdmdohema。在这些图中,实心正方形曲线对应于通过实施根据本发明的方法并使用pnp获得的结果,而实心圆形曲线对应于通过实施不根据本发明的方法并使用ip175获得的结果。
205、图10比较了在pnp(实心正方形)和ip 175(实心圆形)的情况下镧(图10(a))和铕(图10(b))的分布系数,作为dmdohema的摩尔分数x的函数,表示为xdmdohema。
206、图11显示了不同镧系元素的分布系数,表示为dln,eq,随萃取剂dmdohema的摩尔分数x,表示为xdmdohema的变化过程。在该图中,la=实心圆曲线,nd=实心正方形曲线,eu=实心三角形顶点向上的曲线,dy=实心三角形顶点向下的曲线,yb=实心菱形曲线。
207、在图10和图11中,xdmdohema=0时给出的结果对应于萃取剂仅由hdehp组成时获得的结果,而xdmdohema=1时给出的结果对应于萃取剂仅由dmdohema组成时获得的结果。
208、这些结果表明,对于所有稀土元素,用由dmdohema和hdehp的混合物组成的萃取剂获得的萃取率大于一方面由仅由dmdohema组成的萃取剂和另一方面由仅由hdehp组成的萃取剂获得的萃取率的总和,这突出了dmdohema和hdehp的混合物对所有这些稀土元素的萃取的协同效应。
209、他们还表明,与十二烷相比,dmdohema和hdehp的混合物在dmdohema摩尔分数为0.5时具有最高的协同效应,在pnp的情况下具有更高的萃取产率。
210、实施例4:根据本发明的方法萃取稀土元素并使用pnp、dpnp或c5e1作为水溶助剂
211、旨在用其他共溶剂水溶助剂代替水溶助剂pnp以从酸性水相中萃取稀土元素的试验首先在试管中进行,使用:
212、-作为有机相:包含浓度设定为0.6摩尔/升的稀释于pnp、dpnp或c5e1中的hdehp作为萃取剂的相;和
213、-作为水相:用单独使用的水溶助剂预先平衡的水溶液,包含10mm水合硝酸铕和0.03m硝酸。
214、在室温和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1小时,然后通过以5000rpm的速度离心20分钟进行分离。已经测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf如上文1.1节中的实施例1所示)。
215、这些试验的结果见附图12,该图表示铕的分配系数(表示为deu)与所用水溶助剂性质的函数关系。在该图中,给出了所用的每种水溶助剂的铕分配系数(deu.eq):白色条对应于pnp,斜线条对应于dpnp,垂直条对应于c5e1。如图12所示,所有三种水溶助剂都能有效萃取稀土元素。
216、实施例5:根据本发明的萃取方法包括初步浸提步骤,并使用弱有机酸进行浸提、萃取和反萃取
217、在本实施例中,铕的萃取是在“温和”或“绿色”条件下进行的,即不使用强酸。
218、旨在从包含弱酸如乙酸的水相中萃取稀土元素的试验首先在试管中进行,使用:
219、-作为有机相:包含浓度设定为0.6摩尔/升的稀释于pnp中的hdehp或dmdohema作为萃取剂的相。为了能够比较结果,平行进行了用传统稀释剂十二烷进行的萃取实验;和
220、-作为水相:仅用pnp预平衡的水溶液,包含10mm水合硝酸铕和1m至6m乙酸。
221、在环境温度和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1小时,然后以5000rpm的速度离心20分钟进行分离。已经测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf如上文1.1节中的实施例1所示)。
222、这些测试的结果见图13和图14。图13表示铕的分配系数,表示为deu,eq,作为乙酸浓度的函数。图13(a)显示了用hdehp作为萃取剂实施该方法的情况,而在图13(b)中使用的萃取剂是dmdohema。
223、图14显示了稀土元素分配系数(dln,eq)作为水相初始酸度(c酸,初始,单位为摩尔/升)的函数,对于两种不同的萃取剂的变化过程。图14(a):hdehp和图14(b):dmdohema。在图13和14中,曲线对应为实心圆:la;实心正方形:nd;实心三角形顶点向上:eu;实心三角形顶点向下:dy;和实心菱形:yb。
224、如图13(a)所示,用hdehp萃取铕是有效的,并且通过用pnp代替十二烷而以至少2倍的系数显著改善。
225、在图13(b)中,在萃取剂在十二烷中稀释而萃取变得有效的情况下(在6m乙酸中的分配系数从0.6增加到2.8),没有观察到铕的可测萃取。因此,根据本发明的萃取方法,使用水溶助剂不再需要强酸的存在。使用水溶助剂作为共溶剂使得能够在不合成复杂的新有机分子的情况下,用强酸实施已知的萃取方法,但该方法不够有效。在本发明方法的实施例中,观察到水合弱有机酸和所有水溶助剂的协同作用。
226、在图14(a)中,轻稀土元素的萃取效率随着酸度的增加而急剧降低,而重稀土元素的萃取效率则非常低。酸度在萃取效率中起着重要作用,并导致轻稀土元素和重稀土元素之间的选择性。图14(b)显示dmdohema的效果相反。乙酸浓度越高,萃取越有效。
227、实施例6:根据本发明的方法萃取铀
228、旨在从酸性水相中萃取铀的试验首先在试管中进行,使用:
229、-作为有机相:包含在pnp中稀释的0.01摩尔/升至2摩尔/升可变浓度的dehiba或toa作为萃取剂的相。为了能够比较结果,用常规稀释剂进行了平行萃取实验,特别是用十二烷、甲苯、tph和异辛烷。
230、-作为水相:仅用pnp预先平衡的水溶液,含有250ppm硝酸铀或硫酸铀,稀释在3m硝酸或硫酸中。
231、在环境温度和旋转搅拌下,使有机相和水相以1(v/v)的org/aq比相互接触1小时,然后以5000rpm的速度离心20分钟进行分离。已经测量了由此回收的水相和有机相中铕的浓度(icp-aes和edxrf如上文1.1节中的实施例1所示)。
232、这些试验的结果如图15所示,图中显示了铀的分配系数,表示为du(单位为摩尔/升)作为在不同溶剂中稀释的dehiba浓度的函数(实心圆:tph,实心正方形:十二烷,实心三角形顶点向上:甲苯,实心三角形顶点向下:pnp)。
233、图15显示,与常规溶剂相比,用pnp萃取铀更好,既没有出现第三相,也没有增加有机相的黏度。
234、图16表示铀分配系数(du,eq)作为稀释在不同溶剂中的toa萃取剂的浓度的函数(实心圆:十二烷,实心正方形:异辛烷,实心三角形顶点向上:甲苯,平三角形顶点向下:pnp)。
235、图16显示,用pnp萃取铀好得多,既没有出现第三相也没有增加有机相的黏度,而用常规溶剂如十二烷,例如从0.1摩尔/升的浓度开始一直出现第三相。这使得能够用更少量的试剂进行更紧凑的实施。因此,与现有方法相比,根据本发明的萃取方法使得能够确保第三相事件不会因基本原因而发生,从而避免使用溶剂改性剂,而且增加了防止临界事件的安全裕度。
236、实施例7:用于实施根据本发明的萃取方法的工业设备的实例
237、根据本发明并在以上实施例1至5中示出的萃取方法可以例如在如附图17所示的工业萃取设备1上实施。
238、设备1包括含有负载金属的酸性水相21的罐2、含有非离子水溶助剂31的罐3,罐2和3分别通过导管211和311向容器4进料,用于混合负载金属的酸性水相21和水溶助剂31,以获得平衡的酸性水相41。导管412使得非离子水溶助剂能够返回罐3。设备1还包括含有有机相51的罐5,有机相51包含至少一种萃取剂和非离子水溶助剂。包括几个级(未示出)的萃取级6的组在中间级通过导管411供给平衡的酸性水相41,在萃取器组的第一级通过导管511供给有机相51,通过导管1711供给包含非离子水溶助剂的含水洗涤溶液,并且在萃取器组的最后级离开罐17。按照这种方式,水相和有机相按照标准惯例在萃取池中逆流循环。组的每一级包括用于混合相的装置和用于在接触后分离这些相的装置(未示出)。一方面通过来自非离子水溶助剂罐18的导管1811向罐17供应非离子水溶助剂,另一方面通过来自含水洗涤溶液罐19的导管1911向罐17供应含水洗涤溶液191。罐17出口处的导管1712用于将非离子水溶助剂返回罐18。在萃取器组6中混合酸性水相21和有机相51之后,至少一些属于稀土元素或锕系元素的元素已经转移到有机相51中。然后通过导管611将如此负载有金属的有机相51转移至包括几个级(未示出)的反萃取器组7的第一步骤。经由导管612将至少部分不含属于稀土元素或锕系元素的平衡的酸性水相送到反萃取单元23。反萃取单元23使得能够回收包含在所述酸相中的非离子水溶助剂,所述非离子水溶助剂与溶剂121的混合物,优选由脂肪族化合物如isane的混合物组成。溶剂121通过导管2311被送到罐13。在反萃取单元23的出口,不含非离子水溶助剂的酸性水相(萃余液)通过导管2312转移到容器24中,然后可将其清空。
239、设备1还包括含有反萃取溶液81的罐8,反萃取溶液81包含非离子水溶助剂。通过导管911向罐8供应来自罐9的水溶液91,以及通过导管1011向罐8供应来自罐10的所述非离子水溶助剂101。导管812用于将水溶助剂返回罐10,导管811用于在反萃取器组的最后级向反萃取器组7供应反萃取溶液81。在离开反萃取器组7时,反萃取溶液经由导管711被转移到反萃取单元11,所述反萃取溶液包含至少部分属于稀土元素或锕元素的元素71。含有isane型溶剂121的罐12通过导管1211连接到罐11。将溶剂121引入反萃取单元11使得能够回收反萃取溶液81中包含的非离子水溶助剂。不含非离子水溶助剂但负载有属于稀土元素或锕系元素的反萃取溶液通过导管1112被送至容器20。溶剂121和非离子水溶助剂的混合物通过导管1111转移到罐13中,罐13本身通过导管1311连接到蒸馏单元14。蒸馏单元14使得非离子水溶助剂能够与溶剂121分离。离开蒸馏单元14的非离子水溶助剂通过导管1411在罐15中回收,然后通过导管1511返回罐16。离开蒸馏单元14的溶剂121接着通过导管1412转移到罐12。该罐12还用于向反萃取单元23供应溶剂,通过导管1212向反萃取单元23供应溶剂121。此外,在反萃取单元7的出口处,至少部分不含属于稀土元素或锕系元素的有机相经由导管712转移至罐16。罐16允许有机相中非离子水溶助剂的量在通过导管1611转移到罐5之前被重新调节。存在于容器20中的反萃取溶液中含有的属于稀土元素或锕系元素的元素然后可以通过常规技术回收,例如将这些元素沉淀到所述溶液中。
技术实现思路
本文地址:https://www.jishuxx.com/zhuanli/20240619/8879.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表