靶向治疗损伤心肌的工程化细胞外囊泡组合物及应用
- 国知局
- 2024-08-08 16:52:12
本发明属于生物活性囊泡治疗与再生医学,尤其涉及一种靶向治疗损伤心肌的工程化细胞外囊泡组合物、制备方法和应用。
背景技术:
1、细胞衰老是随着年龄增长而发生的自然过程,但也可能因各种应激因素而过早触发。异常细胞衰老是一个复杂的过程,涉及各种分子、细胞和系统上的生物学变化,包括表观遗传改变、dna损伤、基因组不稳定和反转录转座子激活,这些都可能导致包括心血管疾病(cardiovascular diseases,cvds)在内的年龄相关疾病的发生和发展。在这些因素中,逆转录转座子是一种可以在基因组中移动的重复dna序列,通常在基因组中被特异性沉默,但在衰老细胞中可以重新激活。此外,激活的逆转录转座子可导致新的拷贝插入到基因组中,导致基因组稳定性失调和基因表达模式改变,并进一步加剧细胞衰老造成的损伤。
2、长穿插元件1(line1)被认为是数量最多且唯一能够自主逆转录的活性转座子,约占人类基因组的17%,并在基因组进化和遗传多样性中起着重要作用。虽然line1通常被抑制,但它可以在某些异常的条件下被激活,这种激活可能通过表观遗传改变或内源性免疫途径对基因组产生有害影响。因此,旨在调节line1活性的治疗策略的发展有可能为多种病理的治疗提供显著的益处,包括自身免疫性疾病、神经退行性疾病和癌症。
3、此外,细胞衰老对包括心脏纤维化、心力衰竭、心肌梗死和缺血再灌注损伤在内的多种心血管疾病的影响可以通过多种细胞类型的改变来实现。作为占心脏总容积最大的细胞类型,心肌细胞衰老导致缩短功能受损,起搏频率增加,收缩和代谢功能障碍,以及包括促炎细胞因子、趋化因子和生长因子等衰老相关分泌表型(senescence-associatedsecretory phenotype,sasp)因子的产生。目前尚无研究在心肌梗死的疾病背景下,解析心肌细胞衰老与line1激活之间的联系,并通过设计合适的方案对此过程加以干预,以达到缓解心肌损伤的效果。
4、血管内皮细胞排列在血管的内表面,在维持血管稳态中起着至关重要的作用,包括调节血管张力,控制血栓形成和纤维蛋白溶解,促进血管生成。在心肌梗死过程中,应激内皮细胞可通过促进炎症、血栓形成和血管收缩介导心肌梗死的病理生理活动,最终促进心功能障碍和心肌纤维化。因此,针对损伤血管内皮细胞的治疗策略的发展代表了防止心肌梗死的一条有希望的途径。为了实现这一目标,可靠的分子靶点的验证对于开发有效的损伤内皮细胞靶向治疗来预防心肌梗死是必要的。
5、选择素家族是一组粘附分子,包括三种主要类型的选择素:cd62e,cd62p和cd62l。在这些选择素中,cd62e和cd62p在活化的内皮细胞表面表达,在募集的初始阶段介导炎症或损伤血管上白细胞的捆绑和滚动。但目前并无针对心肌梗死进行治疗并缓解心肌异常衰老的有效药物。
技术实现思路
1、针对现有技术的不足,本发明拟解决的技术问题是,提供一种具有双功能的靶向以及治疗损伤心肌的工程化细胞外囊泡组合物、制备方法以及在急性心肌梗死小鼠模型中的应用。工程化细胞外囊泡特异性结合损伤内皮细胞表面的cd62e/p从而通过循环系统注射的给药方式就可以实现损伤心肌靶向的目的。此外,工程化细胞外囊泡通过将人工装载的外源性靶向转座子line1的反义寡核苷酸(line1-aso)释放入心肌细胞,缓解损伤心肌细胞过早进入异常程序性衰老,从而实现损伤心肌治疗以及缓解心肌衰老的目的。
2、为达上述目的,本发明采用如下的技术方案:
3、第一方面,本发明提供一种靶向损伤心肌的工程化细胞外囊泡组合物,所述工程化细胞外囊泡组合物包括人胎盘间充质干细胞来源的细胞外囊泡,在细胞外囊泡的膜外挂载特异性靶向内皮细胞黏附分子cd62e/p的配体分子,同时在细胞外囊泡的膜内装载外源性靶向转座子line1的反义寡核苷酸。
4、进一步地,所述工程化细胞外囊泡组合物具有损伤心肌富集靶向和损伤心肌基因治疗的双重作用;其中,损伤心肌富集靶向的功能依靠靶向cd62e/p的配体分子的修饰实现;损伤心肌基因治疗的功能依靠外源性靶向转座子line1的反义寡核苷酸装载到细胞外囊泡的膜内实现;同时所述工程化细胞外囊泡组合物具有通过抑制反转录转座子再激活,能够缓解心肌细胞和心肌组织异常衰老,抵抗由于心肌梗死造成的心肌损伤。
5、进一步地,所述特异性靶向内皮细胞黏附分子cd62e/p的配体分子为特异性靶向内皮细胞黏附分子cd62e/p的结合肽,结合肽序列为iellqar,分子量为841.3,纯度大于95%。
6、进一步地,所述外源性靶向转座子line1的反义寡核苷酸序列为
7、ttggcattctgttcttgtggctgtctt。
8、第二方面,本发明提供一种所述工程化细胞外囊泡组合物的制备方法,所述制备方法的具体过程是:
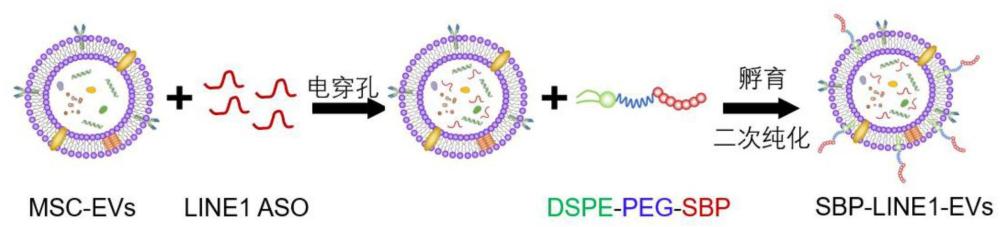
9、步骤一:分离提取人胎盘间充质干细胞来源的细胞外囊泡;
10、步骤二:通过电穿孔法在细胞外囊泡的膜内装载外源性靶向转座子line1的反义寡核苷酸line1-aso,使细胞外囊泡具有缓解心肌细胞异常衰老的能力;所述电穿孔法的条件为:电转杯的规格为0.4cm,line1-aso浓度为200pmol;
11、步骤三:通过两亲性化合物插入法在细胞外囊泡的膜外表面修饰特异性靶向cd62e/p的配体分子,使细胞外囊泡具有靶向损伤内皮细胞的能力。
12、进一步地,所述制备方法具体包括以下步骤:
13、步骤一:分离提取人胎盘间充质干细胞来源的细胞外囊泡msc-evs;
14、步骤二:
15、2.1合成靶向小鼠line1转座子的反义寡核苷酸line1-aso;
16、2.2.将500μg msc-evs和200pmol line1-aso在gene pulser电孔缓冲液中稀释,总体积为350μl;
17、2.3.然后将混合体系转移到0.4cm的预冷的gene pulser电穿孔比色皿中,放置于冰上预冷30min;
18、2.4.在300v的方波电压下,脉冲长度为10msec条件下,进行5个循环重复的电穿孔操作,获得在细胞外囊泡的膜内装载外源性靶向转座子line1的反义寡核苷酸line1-aso的电穿孔后的细胞外囊泡;
19、步骤三:
20、3.1称取dspe-peg2k-nhs100mg溶于3ml dmf中,加入iellqar肽(1.1eq.)和三乙胺(3.0eq.)溶解完全,室温下反应12h;
21、3.2.将反应液转移至透析袋(截留分子量1kda),于纯水中透析24h,收集透析液冷冻干燥即得产物dspe-peg-sbp备用;
22、3.3.将电穿孔后的msc-evs与终浓度为5μm dspe-peg-sbp在37℃下共孵育30min;
23、3.4.将共孵育的物质加入到超滤管上室中,于4℃,13,000g离心20min以将未结合的dspe-peg-sbp洗脱,重复此步骤两次;
24、3.5.将离心后上室中的沉淀使用0.1ml dpbs重悬并定容获得sbp-line1-evs。
25、第三方面,本发明提供一种所述的工程化细胞外囊泡组合物的应用,通过循环系统静脉注射的给药方式,无创地治疗血管内皮细胞损伤为致病机理的相关疾病中的应用,包括肿瘤靶向、心血管疾病、糖尿病、肾缺血再灌注、肾缺血再灌注、神经系统疾病等;所述血管内皮细胞损伤包括缺氧、缺血或缺血再灌注。
26、所述的工程化细胞外囊泡组合物的应用在制备治疗心肌梗死药物中的应用,优选为在急性心肌梗死小鼠模型中的应用。
27、与现有技术相比,本发明具有如下有益效果:
28、本发明创造性地找到了治疗心肌梗死的新靶点,即line1过表达造成的心肌衰老;以及找到了外泌体靶向受损心肌组织的新靶点,即cd62e/p,实现了靶向心肌组织(包含内皮细胞和心肌细胞)的目的。
29、本发明以人胎盘间充质干细胞来源的细胞外囊泡为递送载体,以cd62e/p靶向肽(sbp)、line1-aso为修饰性分子,通过对细胞外囊泡内容物以及膜结构进行人工修饰获得双功能工程化细胞外囊泡组合物。该工程化细胞外囊泡组合物具有可直接循环系统注射和缓解心肌损伤的作用,从而能够有效促进心肌组织结构和功能的修复。
30、本发明中的工程化细胞外囊泡组合物具有细胞外囊泡类似的物理和化学性质,同时又可以在损伤心肌归巢,还可以携带治疗性核酸分子,进而高效地在组织损伤的位置发挥后者的生物活性;与目前报道的未经修饰的细胞外囊泡以及人工修饰的工程化细胞外囊泡相比,该工程化细胞外囊泡组合物具有可注射性和损伤心肌滞留性,可直接于静脉系统注射,并且具有优越的缓解细胞衰老的功能,缓解因梗死造成的损伤心肌的异常衰老,从而能够有效促进梗死心肌结构和功能上的修复。
31、本发明中工程化细胞外囊泡组合物通过膜内外共同改造,通过孵育以及电穿孔实现对细胞外囊泡的双重修饰,赋予其双重功能,同时能起到抵抗心肌衰老的作用。
本文地址:https://www.jishuxx.com/zhuanli/20240808/270885.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表