一种引物组、大肠杆菌外源性DNA残留检测方法及应用与流程
- 国知局
- 2024-09-05 14:36:19
本发明属于外源性dna残留检测,尤其涉及一种引物组、大肠杆菌外源性dna残留检测方法及应用。
背景技术:
1、生物制品是指以生物体如细胞、组织等作为起始原料,应用生物技术获得的活性物质或药品,其在疾病治疗和诊断中具有极其广泛的应用。由于生物制品经由生物体生产,因此在生物制品的中间品、半成品及成品中极易残留生物体dna。生物制品中残留的dna在疾病诊断或治疗中存在潜在的致癌性,免疫原性以及其他毒性,可能会引起机体严重的感染或免疫反应,因此对生物制品的质量控制也日益严格。为保证生物制品的安全性,监管机构制定了严格的质量和检测标准。
2、现有的外源性dna残留检测技术主要包括dna探针杂交法、荧光染色法和定量pcr法。其中,定量pcr法因其高灵敏度、精确性和重复性而备受青睐。该方法利用特异性引物和探针对dna进行检测。在pcr扩增过程中,荧光信号与pcr产物呈正比例关系,因此具有较高的检测精度和灵敏度。尽管如此,该方法仍存在一些缺陷,特别是要针对不同的宿主设计特定的探针或引物组。例如《中国药典2020》中推荐的基于tamra的淬灭探针在大肠杆菌残留检测中就存在背景信号干扰、灵敏度低和准确度不高等问题。这些缺陷和不足降低了检测的可靠性,也限制了该方法的高质量和大范围应用。而解决这些问题不仅能够提高外源性dna残留检测技术的可靠性和适用性,也将显著提高生物制品的安全性。
技术实现思路
1、为解决上述问题,本发明提供一种引物组,包括:引物和双淬灭探针;
2、所述双淬灭探针中包括两个淬灭基团;其中,一个淬灭基团设于寡核苷酸序列3'端;另一个淬灭基团设于寡核苷酸序列中,并且标记位置为所述寡核苷酸序列5'端到3'端的第2-第19个碱基上,或者第2-第19个碱基之间的任意一个位置;
3、优选地,在寡核苷酸序列中的所述淬灭基团的标记位置为寡核苷酸序列5'端到3'端的第4-第12个碱基上,或者第4-第12个碱基之间的任意一个位置。
4、优选地,所述双淬灭探针的寡核苷酸序列为:
5、5'-cggtgctgcgacggcggagt-3';
6、其中,所述双淬灭探针的寡核苷酸序列5'端设有荧光基团;所述双淬灭探针的两个淬灭基团分别为第一淬灭基团和第二淬灭基团;
7、优选地,所述荧光基团选自fam、hex、vic、joe和tet中的任意一种;
8、优选地,所述第一淬灭基团为bhq-1和bhq-2中的任意一种;
9、优选地,所述第二淬灭基团为ieclipse。
10、优选地,所述引物包括正向引物和反向引物;
11、所述正向引物的核苷酸序列为:5'-gaaagtaacaccagcgtgcg-3';
12、所述反向引物的核苷酸序列为:5'-ccaatgcattaacgctggca-3'。
13、此外,为解决上述问题,本发明实还提供一种大肠杆菌外源性dna残留检测方法,包括:
14、取目标生物样本作为扩增模板,并提取所述扩增模板对应的模板dna;
15、取所述扩增模板,采用如上述所述引物组中引物对所述扩增模板进行扩增,通过琼脂糖凝胶电泳对扩增产物进行纯化,并将纯化产物作为阳性标准品;
16、对所述阳性标准品进行绝对定量;
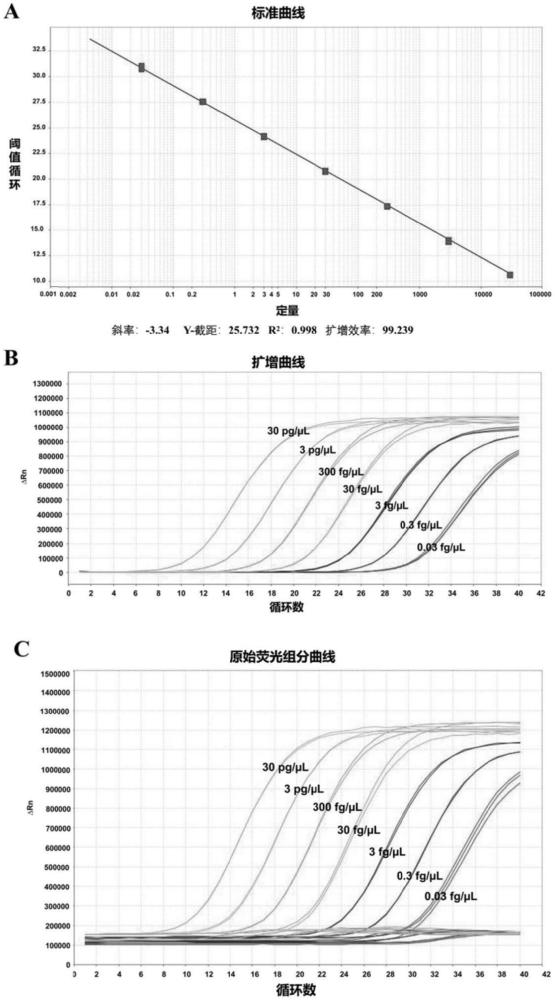
17、利用包含如上述所述引物组中引物和双淬灭探针的qpcr反应体系,对绝对定量后的所述阳性标准品和所述模板dna分别进行qpcr扩增反应,得到所述目标生物样本对应的荧光信号,以及得到所述阳性标准品的不同浓度下的荧光信号,并根据不同浓度下的荧光信号建立的标准曲线;
18、根据所述目标生物样本对应的荧光信号与所述标准曲线,确定所述目标生物样本的残留检测结果;
19、优选地,所述引物对f1/r1中的引物f1的核苷酸序列为:
20、5'-atgaacgcatcgtcatgg-3';
21、所述引物对f1/r1中的引物r1的核苷酸序列为:
22、5'-tgagccatgatcaaactcttcaatttttaagaggccagcgtacc ttgcggtggtgctt-3'。
23、优选地,所述对所述阳性标准品进行绝对定量,包括:
24、将所述阳性标准品进行稀释到预设浓度,得到稀释样本;
25、根据所述预设浓度,取所述稀释样本分别稀释到101至1010倍;
26、取其中稀释106至1010倍的样本进行检测,利用ddpcr得到所述阳性标准品的绝对定量结果。
27、优选地,所述对绝对定量后的所述阳性标准品进行qpcr扩增反应,包括:
28、对绝对定量后的所述阳性标准品进行梯度稀释处理,得到目标浓度下的阳性标准品稀释液;
29、将所述目标浓度下的所述阳性标准品稀释液根据qpcr反应体系分别加入微量反应板中,以便于进行qpcr扩增反应。
30、优选地,所述梯度稀释处理,包括:
31、配制管1,其稀释比例为2μl绝对定量后的所述阳性标准品加入25.4μl dna稀释液,终浓度为30ng/μl;
32、根据管1依次配制管2-管10,包括:
33、根据管1配制管2,其稀释比例为10μl管1加入90μl dna稀释液,终浓度为3ng/μl;
34、根据管2配制管3,其稀释比例为10μl管2加入90μl dna稀释液,终浓度为300pg/μl3ng/μl;
35、根据管3配制管4,其稀释比例为10μl管3加入90μl dna稀释液,终浓度为30pg/μl;
36、根据管4配制管5,其稀释比例为10μl管4加入90μl dna稀释液,终浓度为3pg/μl;
37、根据管5配制管6,其稀释比例为10μl管5加入90μl dna稀释液,终浓度为300fg/μl;
38、根据管6配制管7,其稀释比例为10μl管6加入90μl dna稀释液,终浓度为30fg/μl;
39、根据管7配制管8,其稀释比例为10μl管7加入90μl dna稀释液,终浓度为3fg/μl;
40、根据管8配制管9,其稀释比例为10μl管8加入90μl dna稀释液,终浓度为0.3fg/μl;
41、根据管9配制管10,其稀释比例为10μl管9加入90μl dna稀释液,终浓度为0.03fg/μl;
42、所述梯度稀释处理中,将其中终浓度为30pg/μl-0.03fg/μl之间的浓度作为所述目标浓度。
43、优选地,所述对绝对定量后的所述阳性标准品和所述模板dna分别进行qpcr扩增反应,得到所述目标生物样本对应的荧光信号中,qpcr扩增反应的反应体系为:
44、2×qpcr mix udg,10μl;
45、正向引物10μm浓度,0.4μl;
46、反向引物10μm浓度,0.4μl;
47、双淬灭探针10μm浓度,0.2μl;
48、ddh2o,1μl;
49、dna样本,8μl;
50、qpcr扩增反应的反应体系,dna样本包括绝对定量后的所述阳性标准品和所述模板dna。
51、优选地,所述对绝对定量后的所述阳性标准品和所述模板dna分别进行qpcr扩增反应,得到所述目标生物样本对应的荧光信号,还包括:
52、配制无模板的qpcr反应混合液,其反应体系为:
53、2×qpcr mix udg,10μl;
54、正向引物10μm浓度,0.4μl;
55、反向引物10μm浓度,0.4μl;
56、双淬灭探针10μm浓度,0.2μl;
57、ddh2o,1μl;
58、dna稀释液,8μl。
59、此外,为解决上述问题,本发明还提供一种如上述所述引物组在大肠杆菌外源性dna残留检测中的应用。
60、本发明提供一种引物组、大肠杆菌外源性dna残留检测方法及应用,其中,包括引物和双淬灭探针;所述双淬灭探针中包括两个淬灭基团;其中,任意一个淬灭基团设于寡核苷酸序列3'端;另一个淬灭基团设于寡核苷酸序列中,并且标记位置为所述寡核苷酸序列5'端到3'端的第2-第19个碱基上,或者第2-第19个碱基之间的任意一个位置。本发明在引物组中提供了一种能够简便、准确、高效地检测大肠杆菌宿主dna残留的双淬灭探针,该双淬灭探针具有本底荧光值更低,检测荧光增量高,检测特异性高、重复性好以及灵敏度高等优势。该双淬灭探针能够满足方法验证过程中重复性、日间差、人员操作误差等方面的要求,对微生物检验检测技术领域方法开发,质量控制和临床应用具有重要的意义。
本文地址:https://www.jishuxx.com/zhuanli/20240905/287247.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。