IscBn-ωRNA编辑系统及其应用
- 国知局
- 2024-09-14 14:43:48
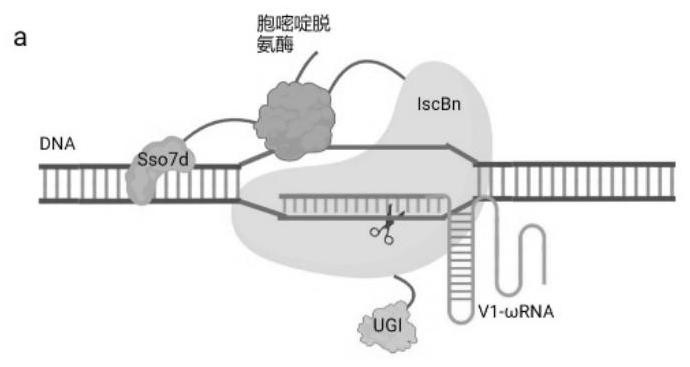
本发明属于基因治疗的平台,可以用于实现c·g转化为t·a或将a·t转化为g·c以进行疾病的基因治疗。
背景技术:
1、人类的疾病大多与基因密切相关,所以根据基因进行针对性的改变一直是生命科学的长期愿望。尽管基因编辑技术取得了快速进展,但与疾病相关的75000多个人类已知的遗传变异中,大多数疾病还是存在难以纠正的问题(1)。而基于crispr-cas9的精确基因编辑技术为许多疾病的治疗提供了可能,比如β地中海贫血、杜氏肌营养不良症等。目前基于cas9的精确基因编辑技术主要分为三种:(1)同源定向修复(homology directed repair,hdr),目前已广泛用于精确的dna突变。然而,hdr依赖于双链断裂和外源的供体dna修复模板,通常会从双链断裂的末端连接修复中产生过多的突变和脱靶,并且在大多数治疗相关的细胞类型中效率低下(t细胞和某些类型的干细胞是重要的例外)(2,3);(2)碱基编辑技术(base editor,be),可以在不引入双链断裂的情况下,通过融合不同的脱氨酶实现c到t(cbe)或a到g(abe)的转换,目前已在许多类型细胞和哺乳动物中实现了编辑(4,5,6,7);(3)先导编辑(prime editor,pe),通过融合逆转录酶(m-mlv)和pegrna,可以在不引入双链断裂和供体dna模板的前提下,在人类细胞中精确成功完成包括目标插入,缺失和所有12种类型点突变(8)。
2、在实际应用中,crispr工具的递送方式极大地影响其安全性和治疗效果。虽然利用病毒的传统基因治疗已经被仔细研究了免疫毒性和插入性肿瘤发生的风险,但aav载体因为其递送的高效性,目前仍然是crispr基因治疗的关键传递载体(9)。但是aav有一个明显的限制在于当其包装大小超过4.7kb时,包装效率会大大降低。而基于cas9开发的碱基编辑和先导编辑技术构成all-in-one的质粒大小远远大于4.7kb,难以通过aav递送。
3、为了解决这一问题,研究者们开始寻求用小蛋白代替cas9进行精确的基因编辑。目前有研究利用核酸酶失活的小蛋白开发了abe系统。比如斯坦福大学齐磊(stanley qi)及其研究团队基于小蛋白dun1cas12f1(529aa),通过蛋白进化与sgrna的改造,开发出了迷你的小型abe系统dcasmini-abe(10)。来自韩国生命工学研究院的yong-sam kim实验室在2021年cas12f grna改造的基础上,利用与un1cas12f高度相似的cwcas12f,成功开发出超迷你单碱基编辑器target-abe,并实现了细胞和动物体内的a到g精准编辑(11)。cas12f1是由ruvc-like区域,缺少hnh区域。在开发成abe系统时只能进行核酸酶失活,不能变成切口酶,这会导致相关的abe系统效率较低,dcasmini-abe效率不足10%,target-abe效率低于30%。
4、2021年,张峰团队发现is200/is605转座子的一个独特家族中的核酸酶iscb蛋白,被认为可能是cas9内切酶的祖先(12)。iscb与cas9结构相似,包含两个内切酶区域:ruvc和hnh,但大小只有cas9的2/5左右(spcas9 1368aa,ogeuiscb 429aa)(13)。因此iscb可能是一个较好的cas9替代蛋白。目前已发现ogeuiscb在hek293ft细胞中能够产生极低的插入缺失的效率,但自然状态的iscb-ωrna不能直接进行编辑工具的开发,仍需进一步的优化。
5、因此,现有技术中亟需能直接进行基因编辑的iscb-ωrna或其变异体。
技术实现思路
1、由于自然状态下的iscb-ωrna系统在哺乳细胞中效率低,发明人通过蛋白的定向进化,ωrna的改造以及融合dna双链结合蛋白sso7d的方法,提高其cbe和abe的编辑能力,从而在人细胞中实现高效的胞嘧啶碱基编辑器(cbe)、腺嘌呤碱基编辑器(abe)的编辑能力。
2、为上述目的,本发明提供了一种iscbn-ωrna编辑系统,所述iscbn-ωrna编辑系统包括iscbn(d61a)突变子或编码其的核酸;所述iscbn(d61a)突变子存在d96k/q99r/s456r/d89r/n462h/s430k/s386r/n384r/f137n这些点突变中的一种或多种,所述iscbn(d61a)其氨基酸序列如seq id no.1所示。
3、本发明通过iscbn上多个位点的单个突变的筛选,均实现了不同程度的碱基编辑效率的增加。
4、作为本发明的某些实施方式,所述iscbn(d61a)突变子存在d96k/s456r、或d96k/s430k、或d96k/n462h、或d96k/f137n双突变。
5、本发明上述筛选的iscbn上多个位点的单个突变的两两组合,进一步增加了碱基的编辑效率。
6、作为本发明的某些实施方式,所述iscbn(d61a)突变子存在d96k/s456r/s430k/f137n四个氨基酸突变。
7、通过在进一步的iscbn上多个位点的突变的两两组合的进一步组合,最终得到最高效的碱基的编辑系统。
8、作为本发明的某些实施方式,所述iscbn-ωrna编辑系统还包括ωrna突变子或编码其的基因;所述ωrna突变子存在如下突变中的一种或多种:ωrna-d1,其核苷酸序列中第31位至第45位的核苷酸替换为gaaa,其核苷酸序列如seq id no.8所示;ωrna-d2,其核苷酸序列中第31位至第45位的核苷酸删除,其核苷酸序列如seq id no.9所示;ωrna-d4,其核苷酸序列中第202位至第222位的核苷酸删除,其核苷酸序列如seq id no.10所示;所述ωrna其核苷酸序列如seq id no.2所示。
9、本发明通过ωrna不同突变方式的筛选,进一步增加了编辑系统的编辑效率。
10、作为本发明的某些实施方式,所述ωrna突变子为存在ωrna-d1和ωrna-d4双突变的组合ωrna-v1。
11、通过ωrna不同突变方式的两两组合,筛选出了进一步增加了碱基编辑效率的ωrna突变子。
12、作为本发明的某些实施方式,在所述编辑系统的iscbn(d61a)突变子的编码其的核酸上,所述(d61a)突变子基因序列的5’端还包括脱氨基酶的基因序列;所述脱氨基酶包括腺嘌呤脱氨酶、胞嘧啶脱氨酶。
13、作为本发明的某些实施方式,所述胞嘧啶脱氨酶包括可用于cbe编辑系统的胞嘧啶脱氨酶,所述可用于cbe编辑系统的胞嘧啶脱氨酶包括apobec1家族、apobec3家族、aid家族脱氨酶、cda家族以及进化后的ectada突变体。
14、所述脱氨基酶可以是本领域已知的脱氨基酶,例如已知的腺嘌呤脱氨酶、胞嘧啶脱氨酶,具体可以是:可用于cbe编辑系统的胞嘧啶脱氨酶,包括apobec1家族(如ra1)、apobec3家族(如hapobec3a、hapobec3b)、aid家族脱氨酶(如haid)、cda家族(如ecda1)(14)以及进化后的ectada突变体(15,16,17);以及可用于abe编辑系统的腺嘌呤脱氨酶:ectada及其进化体(如tada7.10、tada8e等)。
15、作为本发明的某些实施方式,所述胞嘧啶脱氨酶包括ra1、hapobec3a、hapobec3b、haid、或ecda1。
16、作为本发明的某些实施方式,所述胞嘧啶脱氨酶为hapobec3a胞嘧啶脱氨酶(w104a/y132d)。
17、作为本发明的某些实施方式,所述(d61a)突变子基因和所述hapobec3a胞嘧啶脱氨酶(w104a/y132d)基因融合表达。
18、作为本发明的某些实施方式,所述hapobec3a胞嘧啶脱氨酶(w104a/y132d)其氨基酸序列如seq id no.3所示。
19、作为本发明的某些实施方式,在所述编辑系统的iscbn(d61a)突变子的编码其的核酸上,所述hapobec3a胞嘧啶脱氨酶(w104a/y132d)基因序列的5’端还包括sso7d的基因序列。
20、sso7d蛋白是硫化叶菌中的一种染色质蛋白,已知其能在维护dna的稳定中有重要作用,有助于稳定dna双螺旋结构并促使dna构型转变,通过在hapobec3a胞嘧胞嘧啶脱氨酶(w104a/y132d)的n端融合的sso7d蛋白,提高了编辑系统的编辑效率。作为本发明的某些实施方式,所述hapobec3a胞嘧啶脱氨酶(w104a/y132d)基因和所述sso7d的基因融合表达。
21、作为本发明的某些实施方式,所述sso7d其氨基酸序列如seq id no.4所示。
22、作为本发明的某些实施方式,在所述编辑系统的iscbn(d61a)突变子的编码其的核酸上,在所述(d61a)突变子基因序列的3’段还包括ugi基因。
23、ugi蛋白为尿嘧啶糖基化酶抑制剂(ugi),来源于枯草芽孢杆菌噬菌体(bacillussubtilis bacteriophage pbs1),通过在iscbn(d61a)突变子的c端融合的ugi蛋白增加了apobec胞嘧啶脱氨酶的稳定性,进一步提高了编辑系统的编辑效率。
24、作为本发明的某些实施方式,所述(d61a)突变子基因和所述ugi基因融合表达。
25、作为本发明的某些实施方式,所述ugi其氨基酸序列如seq id no.5所示。
26、作为本发明的某些实施方式,所述编辑系统的iscbn(d61a)突变子的编码其的核酸上,所述(d61a)突变子基因序列的5’端还包括腺嘌呤脱氨酶的基因序列。
27、作为本发明的某些实施方式,所述腺嘌呤脱氨酶包括可用于abe编辑系统的腺嘌呤脱氨酶。
28、作为本发明的某些实施方式,所述腺嘌呤脱氨酶包括ectada及其进化体。
29、作为本发明的某些实施方式,所述腺嘌呤脱氨酶包括tada7.10、或tada8e。作为本发明的某些实施方式,所述腺嘌呤脱氨酶为腺嘌呤脱氨酶tada和tada8e二聚体。
30、作为本发明的某些实施方式,所述腺嘌呤脱氨酶tada其氨基酸序列如seq idno.6所示,所述腺嘌呤脱氨酶tada8e其氨基酸序列如seq id no.7所示。
31、作为本发明的某些实施方式,所述腺嘌呤脱氨酶的基因序列5’段还包括sso7d的基因序列。
32、作为本发明的某些实施方式,所述腺嘌呤脱氨酶和所述sso7d融合表达。
33、作为本发明的某些实施方式,所述sso7d其氨基酸序列如seq id no.4所示。
34、作为本发明的某些实施方式,所述iscbn(d61a)突变子的编码其的核酸为质粒、腺病毒、或慢病毒;所述ωrna突变子的编码其的核酸为质粒、腺病毒、或慢病毒。
35、作为本发明的某些实施方式,所述质粒为pcmv。
36、作为本发明的某些实施方式,所述iscbn(d61a)突变子的编码其的核酸和ωrna突变子的编码其的核酸上还含有核定位信号。
37、为实现上述目的和其他目的,本发明还提供一种重组载体,所述重组载体为任一项所述的iscbn(d61a)突变子重组载体、和/或所述ωrna突变子重组载体。
38、本发明还提供一种宿主细胞,所述宿主细胞包含所述的iscbn-ωrna编辑系统,所述宿主细胞为哺乳动物细胞、昆虫细胞、大肠杆菌、酵母细胞。
39、作为本发明的某些实施方式,所述宿主细胞为是hek293ft细胞。
40、作为本发明的某些实施方式,所述宿主细胞包括人原代细胞。
41、作为本发明的某些实施方式,所述人原代细胞包括人诱导多能干细胞、人原代t细胞或人造血干细胞中的任意一种。
42、作为本发明的某些实施方式,所述宿主细胞包括人免疫细胞。
43、作为本发明的某些实施方式,所述人免疫细胞包括人t淋巴细胞、b淋巴细胞、自然杀伤细胞(nk)、细胞因子诱导的杀伤细胞(cik)、树突状细胞(dc)、巨噬细胞中的任意一种。
44、作为本发明的某些实施方式,所述宿主细胞包括人血液病细胞。
45、作为本发明的某些实施方式,所述人血液病细胞包括人白血病细胞、人白血病肿瘤细胞、人单核细胞白血病细胞、人急性t细胞白血病细胞、人急性髓系细胞白血病、人急性粒细胞白血病、人急性淋巴母细胞白血病细胞中的任意一种。
46、作为本发明的某些实施方式,所述宿主细胞包括肿瘤细胞。
47、作为本发明的某些实施方式,所述肿瘤细胞包括人肺癌细胞、人卵巢癌细胞、人黑色素肉瘤细胞、人肝癌细胞、人结肠癌细胞、人结直肠癌细胞、人宫颈癌细胞、人胃癌细胞、人乳腺癌细胞、人淋巴瘤细胞、人前列腺癌、人食道癌细胞、人甲状腺癌细胞、人胰腺癌细胞、人神经胶质瘤细胞中的任意一种。
48、本发明还提供所述的iscbn-ωrna编辑系统、所述的重组载体、所述的宿主细胞在胞嘧啶碱基编辑和/或腺嘌呤碱基编辑中的应用。
49、本发明还提供所述的iscbn-ωrna编辑系统、所述的重组载体、所述的宿主细胞在制备基因本发明还提供编辑的细胞和/或药物中的应用。
50、本发明还提供所述的iscbn-ωrna编辑系统、所述的重组载体、所述的宿主细胞在定向进化中的应用。
51、本发明还提供iscbn(d61a)突变子,所述iscbn(d61a)突变子为上述任一项的所述的iscbn(d61a)突变子。
52、本发明还提供iscbn-ωrna编辑系统的ωrna突变子,其存在如上述任一项所述的ωrna突变子的突变。
53、本发明的iscbn-ωrna编辑系统及其应用,实现了有利的技术效果:本发明基于cbe的系统,首先是通过蛋白定向突变的策略,通过三轮筛选提高了基于iscbn(d61a)的cbe编辑中c到t的编辑效率。同时对ωrna进行改造,通过两轮筛选,在dyrk1a、vegfa位点提高c到t的编辑效率。之后通过在apobec脱氨酶(w104a/y132d)的n端融合双链dna结合蛋白sso7d提高一些低效率位点中cbe的c到t的编辑效率。最后,在不同位点实现了高效的abe编辑系统中a到g的编辑效率。
本文地址:https://www.jishuxx.com/zhuanli/20240914/295705.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表