多核苷酸片段及其在增强基因表达中的应用的制作方法
- 国知局
- 2024-09-14 14:44:09
本发明涉及一种多核苷酸片段及其在增强基因表达中的应用。
背景技术:
1、基因表达调控是生物体内细胞分化、形态发生、个体发育和生物学功能的分子基础,具有时空特异性。除了管家基因,大部分功能基因都是可诱导或阻遏基因,主要可以从转录水平、转录后mrna加工成熟、以及蛋白翻译水平对其表达进行调控,其中转录水平调控是更为关键和主要的调控位点。
2、真核基因的转录激活与调控主要基于顺式作用元件和反式作用因子及其相互作用。顺式作用元件位于基因旁侧序列中,包括启动子、增强子等,不编码蛋白,仅提供反式作用因子作用位点,但决定了基因转录起始的基础水平。反式作用因子是一类蛋白调节因子,主要包括rna聚合酶、转录因子和协调因子。转录激活的基因染色质结构发生改变,双链dna解螺旋成单链,rna聚合酶则以dna一条单链为模板进行rna合成。单链的dna处于开放染色质状态,若存在dnase i超敏位点(dnase i hypersensitive sites,dhss),则更易于dna聚合酶识别、结合、切割,从而更利于基因转录表达。dhss是活性染色质的标志,目前常用来提高基因表达的dhss相关元件是位于编码珠蛋白类a链的ζ2基因上游40kb的hs-40,该元件具有组织特异性,仅在源自使用珠蛋白相关启动子的红细胞相关谱系的细胞中起作用,这限制了其在哺乳动物细胞系中的广泛使用。
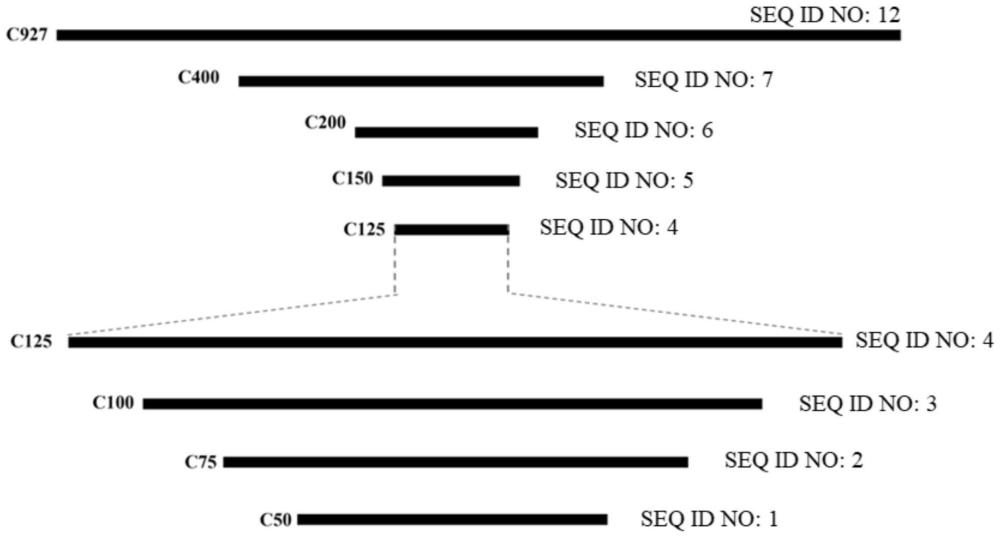
3、现有技术中已公开的影响转基因表达的因素很多,位置效应是主要的影响因素之一。例如,外源基因整合位点周围的宿主基因组dna改变了作用模式,或者外源基因整合到高度甲基化的染色体区域等都可能影响转基因的表达,更有甚者,外源基因整合至异染色质区,可能使转基因表达沉默或失活。
4、目前已经报道有一些方式和策略可以克服位置效应,提高外源基因表达。例如,利用大容量的载体如bac或yac载体可以克服位置效应,这种大容量载体能容纳近1mb的dna片段并保持其稳定性,可以保证所有顺式调控因子的完整性,从而减弱位置效应,提高外源基因的表达。但其缺陷是,当使用大容量载体整合较大的外源基因片段至细胞基因组中,整合效率会大大降低。
5、另外,现有技术“肝脏特异性转录调控序列及其应用,专利号:cn108239645b”提供了一种可以驱动增强下游基因在肝脏细胞中的特异性表达的调控序列,该调控序列包含白蛋白和转甲状腺素蛋白的调控序列,可以用于在肝脏细胞中特异性的表达治疗性基因。又如现有技术“在哺乳动物肌肉中特异性启动基因的启动子序列及其应用,专利号:cn114231532a”提供了能够在肌肉组织中特异性表达的嵌合启动子,其包括:肌肉特异性转录因子识别结合位点;肌肉特异性顺式调节模块;以及肌肉特异性启动子。现有技术“包含珠蛋白基因簇的调控元件的真核表达载体,专利号:cn108012545a”还公开了利用人珠蛋白基因簇的表达元件可以使靶标产物在人血细胞或衍生自人血细胞的细胞中稳定高效表达。但这些启动子具有组织特异性,限制它们在哺乳动物细胞系中的广泛使用。
6、综上,需要发现更为广谱、高效的增强子元件结合启动子以提高外源基因表达,为通用型的基因高效表达提供一种新的优化方式。
技术实现思路
1、本发明的发明人经过大量实验,意外发现一种增强基因表达的多核苷酸片段,所述多核苷酸片段能与不同的启动子联合使用,在不同细胞中增强其下游基因的表达。
2、在第一个方面,本发明提供一种增强基因表达的多核苷酸片段,其中所述多核苷酸片段包含:
3、i)如seq id no:12所示序列的截短片段;或
4、ii)与i)所述截短片段具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性且具有增强基因表达功能的片段;和
5、所述多核苷酸片段的长度为l,50bp≤l<927bp。
6、本文所指“截短片段”,可以是从5’端截短,也可以是从3’端截短,还可以是两端均截短。
7、在一些实施方案中,所述多核苷酸片段包含seq id no:12所示序列的截短片段。seq id no:12的长度为927bp,本文中,其截短片段是指长度大于等于50bp但小于927bp的片段,可以是50-926之间的任意整数,例如50bp、75bp、100bp、150bp、200bp、300bp、400bp、500bp、600bp、700bp、800bp等。
8、在另一些实施方案中,所述多核苷酸片段包含如seq id no:7所示序列或其截短片段,或与seq id no:7所示序列或其截短片段具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性且具有增强基因表达功能的序列。在又一些实施方案中,所述多核苷酸片段包含如seq id no:1所示的序列或与seq id no:1具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性且具有增强基因表达功能的序列。
9、在另一些实施方案中,所述多核苷酸片段由seq id no:7所示序列或其截短片段组成,且50bp≤l≤400bp。在又一些实施方案中,所述截短片段包含如seq id no:1所示的序列。在又一些实施方案中,所述截短片段包含如seq id no:2所示的序列;优选地,所述截短片段包含如seq id no:3所示的序列;更优选地,所述截短片段包含如seq id no:4所示的序列;更优选地,所述截短片段包含如seq id no:5所示的序列;更优选地,所述截短片段包含如seq id no:6所示的序列。在又一些实施方案中,所述截短片段包含如seq id no:3所示的序列,且100bp≤l≤400bp。
10、在一些优选实施方案中,所述多核苷酸片段的序列如seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6或seq id no:7所示。更优选地,所述多核苷酸片段的序列如seq id no:3、seq id no:4、seq id no:5、seq id no:6或seq idno:7所示。
11、在另一些实施方案中,所述多核苷酸片段进一步包含其它片段。本文所指其它片段可以是具有调节基因表达功能的不同片段,不同片段组合后,仍然具有不同程度地增强基因表达的功能。优选地,所述多核苷酸片段如seq id no:9、seq id no:10或seq id no:11所示。
12、在本文中,多核苷酸序列还包括所述多核苷酸序列的互补序列,且本文中的“互补序列”具有本领域技术人员通常理解的含义。
13、在第二个方面,本发明提供一种载体,其包含第一个方面所述的多核苷酸片段。本文中的术语“载体”,是指能携带外源dna进入细胞的dna片段,例如质粒、病毒等。
14、在一些实施方案中,所述载体是真核细胞表达载体,在细胞中表达其携带的外源基因。在另一些实施方案中,所述载体包含启动子,例如,所述启动子位于所述多核苷酸片段下游。本文中的术语“下游”具有本领域技术人员熟知的含义,即所述多核苷酸片段位于启动子的5’端或之前。本文所指“启动子”,是指一段能使基因进行转录的dna序列,可以被rna聚合酶辨认并开始转录合成rna。现有技术已知的启动子均可用于本发明。在一些实施方案中,所述启动子与多核苷酸片段之间无间隔;在另一些实施方案中,所述启动子与多核苷酸片段之间存在间隔,例如6-40bp、2-50bp、1-100bp或更长的间隔。间隔序列可以是多克隆位点、重组位点,也可以包含转录因子的结合位点,或其它具有增强基因表达功能的元件。
15、在另一些实施方案中,所述启动子为哺乳动物细胞启动子,例如组成型启动子、组织特异性启动子和诱导型启动子。本文中的术语“组成型启动子”,文中也称通用启动子,是指可连续不断地启动基因表达的启动子,通常来自管家基因或病毒基因。常用的组成型启动子例如cmv(cytomegalovirus)启动子、ef1α(elongation factor-1alpha)启动子、sv40(simian virus40)启动子、cag(cmv immediate enhancer/β-actin)启动子、pgk(phosphoglycerate kinase)启动子、ubc(ubiquitin c)启动子等。本文中的术语“组织特异性启动子”,是指只在特定的器官(或组织)中才能启动基因表达的启动子。本文中的术语“诱导型启动子”,是指只在一定的外界诱导(或刺激)条件下才能启动基因表达的启动子,例如四环素启动子tre。
16、在另一些实施方案中,所述载体进一步包含外源基因。本文中的术语“外源基因”,是指由外部进入所关注或研究的细胞或生物体的基因。本文中,外源基因是编码目的蛋白的多核苷酸片段。目的蛋白也称为靶蛋白、感兴趣的蛋白(protein of interest,poi)。
17、在第三个方面,本发明提供一种细胞,其包含第一个方面所述的多核苷酸片段或第二个方面所述的载体。
18、在一些实施方案中,所述细胞是真核细胞,例如免疫细胞、诱导性多能干细胞(ipscs)或其衍生细胞、间充质干细胞、内皮细胞、肝细胞、心肌细胞、神经元细胞、nk细胞、t细胞、胰岛细胞等。
19、在另一些实施方案中,所述细胞是工程化的免疫细胞。术语“工程化的免疫细胞”是指通过基因工程改造后的免疫细胞,使其在机体内更有效地发挥功能,包括但不限于工程化的间充质干细胞、t细胞、nk细胞等。在另一些实施方案中,所述细胞是ipsc(inducedpluripotent stem cells)的衍生细胞,由ipsc分化而来,包括但不限于间充质干细胞、内皮细胞、肝细胞、心肌细胞、神经元细胞、nk细胞、t细胞、胰岛细胞等。
20、本发明还提供一种组合物,其包含第一方面所述的多核苷酸片段、第二方面所述的载体或第三方面所述的细胞。
21、在第四个方面,本发明提供一种增强基因表达的方法,包括将第一个方面所述的多核苷酸片段置于所述基因的上游。
22、在一些实施方案中,所述多核苷酸片段位于所述基因的启动子之前,优选地,所述多核苷酸片段与所述启动子相邻。
23、在另一些实施方案中,所述基因是内源基因,所述多核苷酸片段整合入所述内源基因的上游基因组区域,优选地,所述整合通过基因编辑进行,例如cre-lox系统、zincfinger nucleases(zfns)、crispr-cas9或transcription activator-like effectornucleases(talens),优选为crispr-cas9或talens。
24、本文中的术语“内源基因”,是指细胞或生物体本身就有的基因。本发明的多核苷酸片段可用于增强内源基因的表达,通过将所述多核苷酸片段整合入所述内源基因的上游基因组区域来实现。在一些实施方案中,所述多核苷酸片段整合入所述内源基因的启动子上游。
25、本文中的术语“基因编辑”,是指对目标基因及其转录产物进行编辑(定向改造),实现特定dna片段的加入、删除,特定dna碱基的缺失、替换等,以改变目的基因或调控元件的序列、表达量或功能。现有技术中已知的基因编辑技术均可被本发明采用,只要能够实现多核苷酸片段的定点整合,例如cre-lox系统、zinc finger nucleases(zfn)、crispr或talens,优选为crispr或talens,更优选为talen/talenickase介导的基因编辑。cre-lox系统是一种在p1噬菌体中发现的重组酶系统,通过利用重组酶cre特异性识别loxp重组位点的机制,可以在靶细胞和靶组织实现基因敲除、倒置和易位等基因编辑功能。zfns(zinc-finger nucleases)由决定其特异性的锌指蛋白结构域和切割dna的fok i核酸酶结构域共同组成,是一种人工核酸酶。crispr系统主要由cas9蛋白和单链向导rna(sgrna)所组成,其中cas9蛋白起切割dna双链的作用,sgrna起向导的作用,在sgrna的向导下通过碱基互补配对原则,cas9蛋白可对不同的靶部位进行切割,实现dna的双链断裂。talens(transcription activator-like effector nucleases)技术的核心是tale蛋白,tale蛋白的主要结构分为三个部分,包括:中心结构域的串联重复序列(repeat domain)、核定位信号和酸性转录激活结构域,中心结构域的串联重复序列是talens技术特异性识别dna序列的区域。
26、在一些实施方案中,所述整合可以发生在基因组内任意安全位点,合适的整合位点可以使外源基因安全有效地表达。包括但不限于如rdna区、aavs1位点、ccr5位点、clybl位点等,优选为rdna区,即基因组中的核糖体rna转录区。术语“核糖体rna转录区”,是指基因组中可被转录为核糖体rna(rrna)的区域。核糖体rna转录区在基因组中为多拷贝,在人基因组的四种rrna基因中,5s、18s、5.8s和28s rrna基因。
27、在一些实施方案中,所述基因是外源基因。在另一些实施方案中,所述多核苷酸片段和所述外源基因一起被整合入细胞基因组中,例如,所述多核苷酸片段和所述外源基因位于同一载体。优选地,所述整合通过基因编辑进行,例如cre-lox系统、zinc fingernucleases(zfns)、crispr-cas9或transcription activator-like effector nucleases(talens),优选为crispr-cas9或talens。
28、在第五个方面,本发明提供第一个方面所述的多核苷酸片段或第二个方面所述的载体在增强基因表达中的用途。
本文地址:https://www.jishuxx.com/zhuanli/20240914/295736.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。