一种二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物及其用途
- 国知局
- 2024-09-14 15:09:14
本发明涉及一种二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物及其用途。
背景技术:
1、癌症,是恶性肿瘤的俗称,是一类严重危害人类生命健康的疾病。近年来癌症的发生率和致死率呈不断上升趋势,根据世界卫生组织国际癌症研究机构发布最新数据显示,2020年全球新增癌症病例约1930万、死亡人数约1000万。肺癌仍然是导致癌症死亡的主要原因,其次是结直肠癌、肝癌、胃癌和乳腺癌。预计到2040年,全球癌症负担将达到2840万例,比2020年增加47%,且发展程度较低或中等的国家病例增幅最大。因此,寻找高效的新型抗肿瘤药物已成为当前癌症治疗研究非常重要且急迫的课题。
2、通常,肿瘤治疗的方法包括:手术切除、化疗、激素治疗、放疗、细胞免疫、靶向治疗、基因治疗、疫苗防治等,化疗是最常用的抗肿瘤治疗方法。目前已上市的抗肿瘤药物中大多数含有杂环片段,包括苯并咪唑(盐酸苯达莫司汀)、吡啶(索尼得吉)、嘧啶(库潘尼西)、喹唑啉(达克替尼)、噻唑(阿培利司和达沙替尼)、吡唑(阿维普替尼)等杂环结构。药学家和肿瘤学家在使用抗肿瘤药物过程中,发现其存在副作用大、靶向性不强、耐药性等问题,他们逐渐意识到,为了提高疗效,必须从肿瘤发病的分子机制入手,再针对这些特异性的分子设计研发出低毒、高效的新型抗肿瘤靶向药物是肿瘤治疗的关键技术问题。这些问题取得突破性进展也必将带来巨大的社会效益和经济效益。
3、杂环化合物是一类具有良好生物活性的化合物,在药物化学中占据着非常重要的地位。由于氮元素和生命有着极为深刻的联系,绝大部分含氮的杂环化合物具有高效、低毒、环境相容性好的特点,是一类不可替代的生源性医药,已成为药物研发的主流。因此,许多药物分子以含氮杂环作为母体来进行设计与筛选,其中,吡唑并嘧啶类化合物是由吡唑环和嘧啶环组成的稠合杂环,近年来在生物学以及药物化学领域崭露头角。吡唑并嘧啶衍生物具有多种药理学活性,包括抗肿瘤,抗感染,磷酸二酯酶抑制剂,腺苷拮抗剂以及细胞分裂素拮抗剂等。
4、很多天然植物提取物被用于治疗恶性肿瘤,如紫杉醇、长春新碱、喜树碱等。这些药物具有良好的临床疗效,推动了基于天然先导物的新型抗癌化合物的不断研究。吴茱萸次碱是从中药吴茱萸中提取的一种吲哚喹唑啉类生物碱,近年来,研究者们发现吴茱萸次碱在疾病治疗上表现出很强的生物活性,临床上被用于抗癌、胃溃疡和口腔溃疡的治疗。因其具有广谱的抗肿瘤活性,对多种肿瘤细胞均有抑制作用,并且毒性较小,引起了国内外研究者的广泛关注。
5、基于以上的文献调研,以天然产物吴茱萸次碱为基本骨架,通过多样性导向的合成策略,运用骨架跃迁原理,将吡唑环替代吴茱萸次碱中的苯环进行结构修饰,设计、合成系列新型吡唑吴茱萸次碱类似物,尽可能地拓展化学空间;同时,为拓展生物学空间,结合多靶点生物活性测试系统,从中发现具有新型抗肿瘤作用机制的先导化合物。该工作对拓宽吴茱萸次碱类化合物的研究领域及进一步研究新型抗肿瘤先导化合物,开发自主知识产权候选药物具有重要意义。
6、参考文献:
7、[1]s.hyuna,f.jacques,l.s.rebecca.ca cancer j clin.2021,71:209–249.
8、[2]n.l.ranke,i.m.fierro,a.m.s.antunes.recent pat anticancer drugdiscov,2016,11(1):112-120.
9、[3]p.bhutani,g.joshi,n.raja.j.med.chem,2021,64(5):2339-2381.
10、[4]r.d.taylor,m.m.coss,a.d.g.lawson.j.med.chem,2014,57:5845-5859.
11、[5]m.chauhan,r.kumar.bioorg med chem,2013,21:5657-5668.
12、[6]c.n.khobragade,r.g.bodade,s.g.konda,b.s.dawane,a.v.manwar,europeanj.med.chem,2010,45:1635-1638.
13、[7]s.b.yewale,s.b.ganorkar,k.g.baheti,r.u.shelke.bioorganic&medicinalchemistry,2012,22:6616-6620.
14、[8]v.a.makarov,h.braun,m.richter,o.b.riabova,j.kirchmair,e.s.kazakova,n.seidel,p.wutzler,m.schmidtke.chem.med.chem.,2015,10:1629-1634.
15、[9]a)g.b.li,s.ma,l.l.yang,s.ji,z.fang,g.zhang,l.j.wang,j.m.zhong,y.xiong,j.h.wang,s.z.huang,l.l.li,r.xiang,d.niu,y.c.chen,s.y.yang.j.med.chem,2016,59:8293-8305;b)s.schenone,m.radi,f.musumeci,c.brullo,m.botta.chemrev,2014,114:7189-7238.
16、[10]a)f.meng,j.hou,y.x.shao,p.y.wu,m.huang,x.zhu,y.cai,z.li,j.xu,p.liu,h.b.luo,y.wan,h.ke.j.med.chem,2012,55:8549-8558;b)p.r.verhoest,k.r.fonseca,x.hou,m.corman,c.j.helal,m.m.claffey,j.b.tuttle,k.j.coffman,s.liu,f.nelson,r.j.kleiman,f.s.menniti,c.j.schmidt,s.liras.j.med.chem,2012,55:9045-9054.
17、[11]a)h.k.park,h.jeong,e.ko,g.lee,j.e.lee,s.k.lee,a.j.lee,j.y.im,s.hu,s.h.kim,j.h.lee,c.lee,s.kang,b.h.kang.j.med.chem,2017,60:7569-7578;b)b.c.huddle,e.grimley,c.d.buchman,m.chtcherbinine,b.debnath,p.mehta,k.yang,c.a.morgan,s.li,j.felton,d.sun,g.mehta,n.neamati,r.j.buckanovich,t.d.hurley,s.d.larsen.j.med.chem,2018,61:8754-8773.
18、[12]a)e.ceccherini,p.indovina,c.zamperini,e.dreassi,n.casini,o.cutaia,i.m.forte,f.pentimalli,l.esposito,m.s.polito,s.schenone,m.botta,a.giordano,j cell biochem,2015,116:856-863.
19、[13]a)m.radi,c.tintori,f.musumeci,c.brullo,c.zamperini,e.dreassi,a.l.fallacara,g.vignaroli,e.crespan,s.zanoli,i.laurenzana,i.filippi,g.maga,s.schenone,a.angelucci,m.botta.j.med.chem,2013,56:5382-5394.
20、[14]a)y.zeng,l.f.nie,k.bozorov,z.ruzi,b.song,j.y zhao,h.a.aisa.jheterocyclic chem,2022,59(3):555-568;b)y.zeng,l.f.nie,l.liu,c.niu,y.li,k.bozorov,j.y.zhao,j.s.shen,h.a.aisa.j heterocyclic chem,2022,59(6):1086-1101;c)y.zeng,l.f.nie,c.niu,m.aytilla,k.bozorov,j.y.zhao,j.s.shen,h.a.aisa.chinese j org chem,2022.42(2):543-556。
21、[15]s.b.mhaske,n.p.argade.tetrahedron,2006,62(42):9787-9826.
22、[16]c.p.sharma,g.kaur,r.pahwa.curr.med.chem,2011,18(31):4786-4812.
23、[17]i.khan,a.ibrar,w.ahmed.eur j med chem,2015,90:124-69.
24、[18]i.khan,a.ibrar,n.abbas.eur j med chem,2014,76:193-244.
25、[19]n.p mclaughlin,p.evans,m.pines.bioorg med chem,2014,22(7):1993-2004.
26、[20]a.k.mukherjee,s.basu,n.sarkar,a.c.ghosh.curr.med.chem,2001,8:1467-1486;(b)g.m.cragg,p.g.grothaus,d.j.newman.chem.rev,2009,109:3012-3043.
27、本发明在国内外有关专利、文献的综合分析的基础上,对一种二氢吡唑并嘧啶并吡啶并吲哚-4-酮类化合物进行全合成,并进行改造和修饰,将含不同取代基的苯基和杂环引入到二氢吡唑并嘧啶并吡啶并吲哚-4-酮类化合物分子中,以期提高其成药性,并对这些化合物进行了抗肿瘤活性筛选,结果表明:有25个化合物对hgc27人胃癌细胞有抑制活性;有28个化合物对hela宫颈癌细胞有抑制活性;有25个化合物对ht29人结肠癌细胞有抑制活性。疗效显著、靶点明确的抗肿瘤活性的候选药物。
技术实现思路
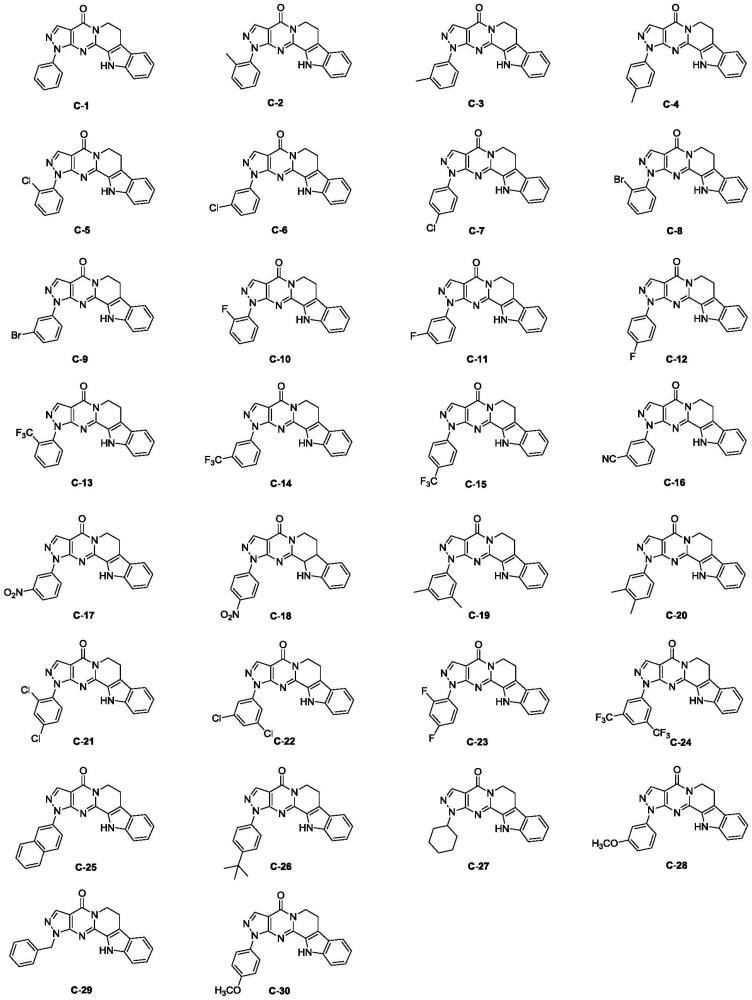
1、本发明的目的在于,提供一种二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物及其用途。该类化合物以2-氰基-3-乙氧基丙烯酸乙酯为初始原料,在三乙胺作用下和不同取代的苯肼反应生成吡唑类化合物a1-a30,接着,2-氧代-3-哌啶甲酸乙酯水解后和重氮苯反应生成化合物b,最后,在三氯氧磷作用下,化合物a1-a30和化合物b反应成环得到6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮类衍生物(c1-c30)。并考察了这30种化合物对hgc27人胃癌细胞、hela人宫颈癌细胞、ht29人结肠癌细胞的抑制活性,结果显示:化合物c1-c10、c13、c16-c24、c26-c30在治疗hgc27人胃癌细胞有抑制活性;化合物c1-c9、c11-c24、c26-c30在治疗hela人宫颈癌细胞有抑制活性;化合物c1-c2、c4-c11、c13、c16-c24、c26-c30在治疗ht29人结肠癌细胞有抑制活性。
2、本发明所述的一种二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物,该类衍生物的结构式为:
3、
4、其中:
5、化合物c1为1-苯基-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
6、化合物c2为1-(2-甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
7、化合物c3为1-(3-甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
8、化合物c4为1-(4-甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
9、化合物c5为1-(2-氯苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
10、化合物c6为1-(3-氯苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
11、化合物c7为1-(4-氯苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
12、化合物c8为1-(2-溴苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
13、化合物c9为1-(3-溴苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
14、化合物c10为1-(2-氟苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
15、化合物c11为1-(3-氟苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
16、化合物c12为1-(4-氟苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
17、化合物c13为1-(2-三氟甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
18、化合物c14为1-(3-三氟甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
19、化合物c15为1-(4-三氟甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
20、化合物c16为3-(4-氧代-4,6,7,12-四氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-1-基)苯甲腈;
21、化合物c17为1-(3-硝基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
22、化合物c18为1-(4-硝基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
23、化合物c19为1-(3,5-二甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
24、化合物c20为1-(3,4-二甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
25、化合物c21为1-(2,4-二氯苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
26、化合物c22为1-(3,5-二氯苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
27、化合物c23为1-(2,4-二氟苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
28、化合物c24为1-(3,5-二三氟甲基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
29、化合物c25为1-(2-萘基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
30、化合物c26为1-(2-叔丁基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
31、化合物c27为1-环己基-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
32、化合物c28为1-(3-甲氧基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
33、化合物c29为1-苄基-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮;
34、化合物c30为1-(4-甲氧基苯基)-6,7-二氢-1h-吡唑并[3”,4”:4',5']嘧啶并[1',2':1,2]吡啶并[3,4-b]吲哚-4(12h)-酮。
35、所述二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物中化合物c1-c10、c13、c16-c24、c26-c30在制备治疗hgc27人胃癌药物中的用途。
36、所述二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物中化合物c1-c9、c11-c24、c26-c30在制备治疗hela人宫颈癌药物中的用途。
37、所述二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物中化合物c1-c2、c4-c11、c13、c16-c24、c26-c30在制备治疗ht29人结肠癌药物中的用途。
38、本发明所述的二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物,其结构如通式(ⅰ)所示:
39、
40、本发明所述的二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物及其用途,其中二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物的制备方法,按下列步骤进行:
41、化合物a1-a30的制备:
42、将不同取代的苯肼0.01mol和2-氰基-3-乙氧基-丙烯酸乙酯1.69g,0.01mol溶于乙醇50ml,在室温下滴加三乙胺0.13g,0.011mol后,反应搅拌6小时;采用二氯甲烷50ml萃取3次,合并有机相,干燥、浓缩,采用正向硅胶柱层析梯度洗脱,洗脱剂为体积比2:1的石油醚:乙酸乙酯,即得化合物a1-a30;
43、化合物b的制备:
44、在烧瓶中加入水200ml和koh6.1g,0.11mol搅拌溶解,然后加入3-甲酸乙酯-2-哌啶酮17g,0.1mol,在室温下过夜搅拌,用稀盐酸中和至ph=4-5,生成3-甲酸-2-哌啶酮,无需纯化直接进行下一步反应;
45、在烧瓶中加入浓盐酸30ml、水30ml和苯胺9.3g,0.l mol,冰浴搅拌下使苯胺溶解;将溶于水20ml的亚硝酸钠7.6g,0.11mol溶液加入到滴液漏斗中,控制滴加速度,使反应温度控制在温度5℃,将制备好的重氮盐保持在温度5℃,直接进行下一步反应;
46、将合成的3-甲酸-2-哌啶酮溶液冷却到温度0℃,在搅拌下加入制备好的重氮盐溶液,加完后,搅拌10min,用浓度50%的乙酸钠溶液调节ph值为5-6,溶液立即变为黄色的浊液;在温度5℃搅拌5h后,过滤,用乙醇重结晶,得到白色针状固体;
47、在烧瓶中加入的70%甲酸50ml和哌啶-2,3-二酮-3-苯踪8.8g,0.05mol加热回流1h;加水稀释,过滤,乙醇重结晶,即得无色针状化合物b为四氢吡啶[3,4-b]吲哚-1-酮;
48、化合物c1-c30的制备:
49、将化合物a1-a30 10mmol溶解在无水二氯乙烷20ml中,并加入化合物b 0.22g,12mmol,然后缓慢滴加三氯氧磷0.24ml,2.5mmol,回流反应至原料全部消失,采用二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,采用正向硅胶柱层析梯度洗脱,洗脱剂为体积比1:2的石油醚:乙酸乙酯,得到化合物c1-c30。
50、本发明所述的二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物,是以不同取代的苯肼为起始原料,先后经四步反应合成二氢吡唑并嘧啶并吡啶并吲哚-4-酮类衍生物,其合成路线如下:
51、
本文地址:https://www.jishuxx.com/zhuanli/20240914/297157.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表