一种评价血必净注射液不良反应的方法
- 国知局
- 2024-10-09 14:34:58
本发明属于临床药学合理用药检测领域,具体涉及一种评价血必净注射液引发呼吸急促不良反应的方法。
背景技术:
1、血必净注射液是以古方血府逐瘀汤为基础研制的中药注射液,由红花、赤芍、川芎、丹参、当归(辅料为葡萄糖)组成,经提取制备而得的棕黄色澄明液体,具有化瘀解毒功效。临床上主要用于温热类疾病,症见发热、喘促、心悸、烦躁等瘀毒互结证:适用于因感染诱发的全身炎症反应综合征;也可配合治疗多器官功能失常综合征的脏器功能受损期。作为一种成分复杂的中药注射剂,其质量控制本身就是该领域的行业难题,加之临床上主要用急性呼吸窘迫等相关疾病的治疗,其本身可能引发的呼吸急促不良反应就容易被忽视。2019年发表于《中国循证医学杂志》的《基于296200例的中药注射剂临床安全性集中监测研究的系统评价》,以及2018年发表于《中国药师》的《血必净注射液致呼吸困难1例》中报道了血必净注射液存在引发呼吸急促、憋气等不良反应的风险。
2、这些文献报道只是对血必净注射液引发临床的不良反应进行了现象分析,并未对其临床应用的安全性预警建立相应的评价方法,从而导致临床上该问题尚没有解决以及形成不良反应预警机制。
3、不同批次的血必净注射液由于原料药的产地、收获时期不同、提取工艺的细微差别,导致用药安全隐患的存在,因此,迫切需要在血必净注射液进入市场之前对血必净注射液是否具有呼吸急促不良反应的隐患进行有效评价,剔除掉有用药安全隐患的批次,增强用药安全性。
4、经检索未发现涉及血必净注射液引导呼吸急促不良反应的评价方法方面的相关现有技术。
技术实现思路
1、本发明的目的是提供一种评价血必净注射液引发呼吸急促不良反应的方法,为其在临床上的安全用药提供预警关键技术。
2、本发明所提供的评价血必净注射液引发呼吸急促不良反应的方法,包括如下步骤:
3、(1)配制血红蛋白hb溶液和血必净注射液待分析溶液;
4、(2)取相同体积量的血红蛋白hb溶液,分别向其中添加同体积量的血必净注射液待分析溶液和生理盐水,混匀,静置备用;
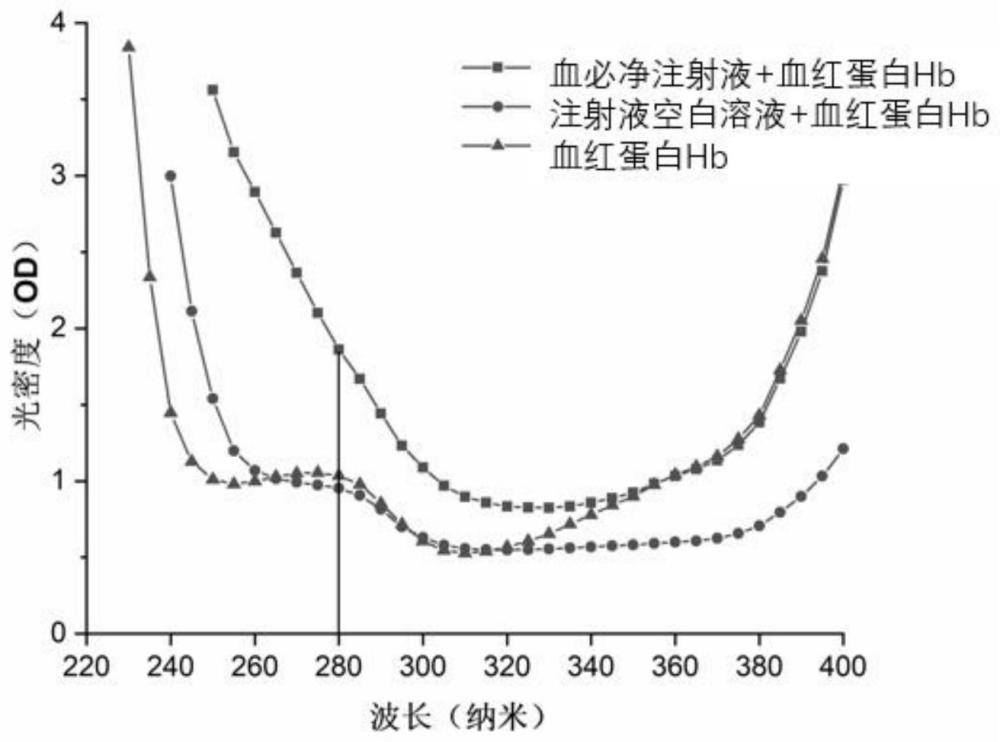
5、(3)分别检测所得含血必净注射液的血红蛋白hb溶液和含生理盐水的血红蛋白hb溶液的吸光度,计算两者的比值n,若n>1.8则判定血必净注射液待分析溶液有引发呼吸急促不良反应潜在可能,其中,n=od/odhb,式中od为血必净注射液待分析溶液与血红蛋白hb作用后在260-290nm波长(具体可为278nm)处的吸光度数值;odhb为生理盐水与血红蛋白hb作用后在此波长处的吸光度数值。
6、上述方法步骤(1)中,配制的血红蛋白hb溶液浓度可为2mg/ml;
7、步骤(2)中,所述血必净注射液待分析溶液、生理盐水的体积相同,可为100μl。
8、所述血红蛋白hb溶液与血必净注射液待分析溶液或生理盐水的体积比可为1:1;
9、在振荡器上震荡混匀;采用在振荡器上震荡10s混匀;
10、步骤(2)中的静置为25℃条件下静置12min;
11、步骤(3)中,采用酶标仪进行吸光度检测;
12、吸光度测定的条件为37℃下,230-400nm光谱扫描,且步长为5nm。
13、上述方法在血必净注射液质量控制中的应用也属于本发明的保护范围。
14、本发明还提供一种评价待测血必净注射液样品安全性的方法,包括如下步骤:(1)配制血红蛋白hb溶液和血必净注射液待分析溶液;
15、(2)取相同体积量的血红蛋白hb溶液,分别向其中添加同体积量的血必净注射液待分析溶液和生理盐水,混匀,静置备用;
16、(3)分别检测所得含血必净注射液的血红蛋白hb溶液和含生理盐水的血红蛋白hb溶液的吸光度,计算两者的比值n,若n>1.8则判定该待测血必净注射液样品为安全性不合格产品,
17、其中,n=od/odhb,式中od为血必净注射液待分析溶液与血红蛋白hb作用后在260-290nm波长处的吸光度数值;odhb为生理盐水与血红蛋白hb作用后在此波长处的吸光度数值。
18、上述方法步骤(1)中,配制的血红蛋白hb溶液浓度可为2mg/ml;
19、步骤(2)中,所述血必净注射液待分析溶液、生理盐水的体积相同,可为100μl。
20、所述血红蛋白hb溶液与血必净注射液待分析溶液或生理盐水的体积比可为1:1;
21、在振荡器上震荡混匀;采用在振荡器上震荡10s混匀;
22、步骤(2)中的静置为25℃条件下静置12min;
23、步骤(3)中,采用酶标仪进行吸光度检测;
24、吸光度测定的条件为37℃下,230-400nm光谱扫描,且步长为5nm。
25、相比于现有技术,本发明的优点在于:
26、本发明首次公开了血必净注射液可以与血红蛋白hb结合,导致血红蛋白hb载氧能力下降,导致呼吸急促不良反应的发生,进一步公开了一种评价血必净注射液引发呼吸急促不良反应的方法,为血必净注射液在临床上的安全用药提供预警关键技术。
技术特征:1.一种评价血必净注射液引发呼吸急促不良反应的方法,包括如下步骤:
2.根据权利要求1所述评价血必净注射液引发呼吸急促不良反应的方法,其特征在于,步骤(1)中,配制的血红蛋白hb溶液的浓度为2mg/ml。
3.根据权利要求1所述评价血必净注射液引发呼吸急促不良反应的方法,其特征在于,步骤(2)中,取用的血红蛋白hb溶液、血必净注射液待分析溶液和生理盐水的体积均为100μl。
4.根据权利要求1所述评价血必净注射液引发呼吸急促不良反应的方法,其特征在于,步骤(2)中采用在振荡器上震荡10s混匀。
5.根据权利要求1所述评价血必净注射液引发呼吸急促不良反应的方法,其特征在于,步骤(2)中的静置为25℃条件下静置12min。
6.根据权利要求1所述评价血必净注射液引发呼吸急促不良反应的方法,其特征在于,步骤(3)中吸光度测定的条件为37℃下,230-400nm光谱扫描,且步长为5nm。
7.权利要求1-6中任一项所述的方法在血必净注射液质量控制中的应用。
8.一种评价待测血必净注射液样品安全性的方法,包括如下步骤:(1)配制血红蛋白hb溶液和血必净注射液待分析溶液;
技术总结本发明公开了一种评价血必净注射液不良反应的方法。包括:(1)配制血红蛋白Hb溶液和血必净注射液待分析溶液;(2)取血红蛋白Hb溶液,分别向其中添加同体积量的血必净注射液待分析溶液和生理盐水,混匀;(3)分别检测所得溶液的吸光度,计算两者的比值n,若n>1.8则判定血必净注射液待分析溶液有引发呼吸急促不良反应潜在可能,n=OD/OD<subgt;Hb</subgt;,OD为血必净注射液待分析溶液与血红蛋白Hb作用后在260‑290nm波长处的吸光度数值;OD<subgt;Hb</subgt;为生理盐水与血红蛋白Hb作用后在此波长处的吸光度数值。本发明首次公开了血必净注射液引发呼吸急促的不良反应可能机制,为其临床用药安全提供风险预警关键技术。技术研发人员:王岩受保护的技术使用者:首都医科大学附属北京世纪坛医院技术研发日:技术公布日:2024/9/29本文地址:https://www.jishuxx.com/zhuanli/20241009/305741.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表