一种含小干扰RNA的核酸纳米颗粒、制备方法及其应用
- 国知局
- 2024-11-21 11:56:52
本发明涉及一种含小干扰rna的核酸纳米颗粒的设计及其通过rnai机制调控靶基因表达的基因抑制剂或rnai生物农药的制备。
背景技术:
1、赤拟谷盗(triboliumcastaneum)隶属于鞘翅目,拟步甲科,是我国重要的仓储害虫,主要危害面粉,还可为害玉米、稻谷、高粱、豆类、干果、中药材等。此外该害虫的分泌物含有致癌物苯醌,致使面粉发霉变质,危害人类健康。目前,国内粮库通常使用磷化氢熏蒸处理的手段进行防治。有研究报道赤拟谷盗等主要储粮害虫已对磷化氢产生抗药性,迫切需要研发新型的防治方法和策略以防治虫害。
2、rna干扰(rnai)已被广泛应用作为特异性基因沉默的强大工具。这一沉默过程由小干扰rna(sirna)介导,通常由外源的双链rna(dsrna)生成,该dsrna通过内核酸酶rnaseiii酶dicer的活性进行剪切。剪切后的sirna可以在细胞质中通过螺旋酶融化成一个正义链和一个反义链,其中正义链被切割成片段,反义链随后被装载到含多种核酸酶的rna诱导沉默复合物(risc)。risc可特异性结合到其靶向的mrna上,诱导mrna的剪切和降解,从而下调基因表达。目前,常用的sirna序列是由21-23碱基的双链rna组成的功能性核酸分子。因此,与化学农药相较,该方法具有专一性强、绿色安全等优势。其作用机理是外源双链rna(double-stranded rna,dsrna)可被昆虫dicer酶所识别,并剪切为小干扰rna(smallinterference rna,sirna),在rna沉默复合体(rna-inducedsilencing complex,risc)的作用下,引起自身同源序列基因的转录后沉默。基于rnai的作用机制,对害虫重要生理功能基因进行靶向沉默、致死害虫,从而达到防治目的。
3、目前研究表明,赤拟谷盗对rnai较敏感,基于rnai的害虫防治具有极大的应用价值。尽管rnai在基因治疗和病虫害防治等领域引起了关注,但sirna在生物体内的直接递送和靶基因沉默仍然存在诸多挑战。首先,裸露的sirna携带负电荷(约为-35mv)、结构刚性较强且具有亲水性,不容易穿透细胞膜。此外,裸露的sirna在生物学上不稳定,具有相对较低的空间电荷密度,难以形成紧凑的sirna颗粒。因此,不稳定、松散的sirna分子容易受到生物体中核酸酶的攻击,在到达目标位点之前即被迅速降解,从而导致sirna活性不足,无法有效降解目标mrna。
4、解决这些难点的方法包括将sirna与递送系统结合(如阳离子载体)以及对寡核苷酸进行直接化学修饰。然而,传统的纳米递送系统,如脂质体和聚合物系统,在大小、组成和表面化学方面不均匀,这可能导致干扰效率低、缺乏组织特异性和潜在毒性等问题。使用阳离子物质,通过静电电荷相互作用将sirna包载制成致密纳米粒子,虽然在体外可有效被细胞摄取并发挥rna干扰活性,但可能导致潜在免疫反应、毒性和制剂的不一致性。另一方面,尽管化学修饰可以提高sirna的效力和稳定性,但依然存在潜在的毒性效应,以及损害sirna的活性。
5、因此,开发一种安全、简单、生物相容的载体系统至关重要,该系统最好是采用天然未修改的寡核苷酸,能够有效地将sirna以活性形式传递到目标位点。核酸分子具有空间可编程性,可被设计成具有特定纳米结构的载体分子,这使得基于dna或rna的纳米结构在sirna递送方面具有重要的应用潜能。由于核酸的柔韧性和可变形性,核酸纳米颗粒可以轻松地编程成精确的形状和大小,用于搭载sirna分子。比起单链或双链rna,核酸纳米颗粒具备更优的内吞作用,以实现更高的细胞摄取效率。同时,rna纳米粒子被认为具有橡胶般的特性,有助于它们穿透血管并增强增强渗透和滞留(epr)效应。与基于聚合物或脂质的纳米递送载体不同,基于核酸的纳米载体可以被生物体内的核酸酶降解,从而避免传递载体的毒性。因此,采用dna和rna纳米技术制备的核酸纳米组装体有望成为sirna的新型递送载体。
技术实现思路
1、鉴于以上所述现有技术的缺点,本发明的目的在于提供一种可有助于提高害虫防治效率的含小干扰rna的核酸纳米颗粒、制备方法及其应用,用于解决现有sirna存在干扰效率低、缺乏组织特异性和潜在毒性的问题。
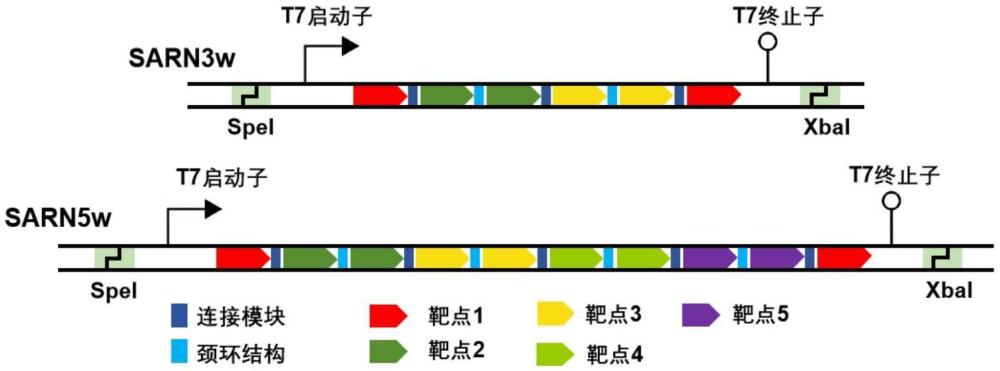
2、为实现上述目的及其他相关目的,本发明提供一种含小干扰rna的核酸纳米颗粒,其特征在于:所述核酸纳米颗粒是将靶向目标基因的多个sirna整合到具有3~5个折叠单位的rna支架上形成一条单链rna分子,该单链rna分子经自我折叠后形成结构稳定的rna纳米颗粒(简称为sarn),所述rna纳米颗粒为sarn3w、sarn5w、sarn3w-2x和sarn5wt中的任意一种。
3、优选的,所述sirna为含21个核苷酸的双链rna,为sirna-1、sirna-2、sirna3、sirna-4、sirna-5中的任意一种,其中:
4、sirna-1的正义链的核苷酸序列如seq id no.5所示,sirna-1的反义链的核苷酸序列如seq id no.6所示:
5、正义链(5’-3’):5’-gcaaccaccatctagccaagt-3’
6、反义链(5’-3’):5’-acttggctagatggtggttgc-3’;
7、sirna-2的正义链的核苷酸序列如seq id no.7所示,sirna-1的反义链的核苷酸序列如seq id no.8所示:
8、正义链(5’-3’):5’-gcggtgtatcaatgcaaatac-3’
9、反义链(5’-3’):5’-gtatttgcattgatacaccgc-3’;
10、sirna-3的正义链的核苷酸序列如seq id no.9所示,sirna-1的反义链的核苷酸序列如seq id no.10所示:
11、正义链(5’-3’):5’-gcgagatagacatgtatatga-3’
12、反义链(5’-3’):5’-tcatatacatgtctatctcgc-3’;
13、sirna-4的正义链的核苷酸序列如seq id no.11所示,sirna-1的反义链的核苷酸序列如seq id no.12所示:
14、正义链(5’-3’):5’-ggacgtcatcaaggttgaacc-3’
15、反义链(5’-3’):5’-ggttcaaccttgatgacgtcc-3’;
16、sirna-5的正义链的核苷酸序列如seq id no.13所示,sirna-1的反义链的核苷酸序列如seq id no.14所示:
17、正义链(5’-3’):5’-gcttcgcagttgtcagattcg-3’
18、反义链(5’-3’):5’-cgaatctgacaactgcgaagc-3’。
19、在本技术的rna纳米颗粒中,sarn3w的核苷酸序列如seq id no.1所示;sarn5w的核苷酸序列如seq id no.2所示;sarn3w-2x的核苷酸序列如seq id no.3所示;sarn5wt的核苷酸序列如seq id no.4所示。
20、sarn3w的核苷酸序列(5’-3’)如seq id no.1所示:
21、caccgcaaccaccatctagccaagtttttgcggtgtatcaatgcaaataccgaagtatttgcattg atacaccgcttttgcgagatagacatgtatatgacgaatcatatacatgtctatctcgcttttacttggctagatggtggttgccgaa。
22、sarn5w的核苷酸序列(5’-3’)如seq id no.2所示:
23、caccgcaaccaccatctagccaagtttttgcggtgtatcaatgcaaataccgaagtatttgcattgatacaccgcttttgcgagatagacatgtatatgacgaatcatatacatgtctatctcgcttttggacgtcatcaaggttgaacccgaaggttcaaccttgatgacgtccttttgcttcgcagttgtcagattcgcgaacgaatctgacaactgcgaagcttttacttggctagatggtggttgccgaa。
24、sarn3w-2x的核苷酸序列(5’-3’)如seq id no.3所示:
25、atctagccaagtaagcctccaacttggctagatggtggttgcacttggctagatggtggttgcttttgcggtgtatcaatgcaaatacgtccacagcggtgtatcaatgcaaataccgaagtatttgcattgatacaccgcgtatttgcattgatacaccgcttttgcgagatagacatgtatatgagtccacagcgagatagacatgtatatgaaagctcgcatcatatacatgtctatctcgctcatatacatgtctatctcgcttttgcaaccaccatctagccaagtggaggcagcaaccacc。
26、sarn5wt的核苷酸序列(5’-3’)如seq id no.4所示:
27、gcccggatagctcagtcggtagagcagcggcaccgcaaccaccatctagccaagtttttgcggtgtatcaatgcaaataccgaagtatttgcattgatacaccgcttttgcgagatagacatgtatatgacgaatcatatacatgtctatctcgcttttggacgtcatcaaggttgaacccgaaggttcaaccttgatgacgtccttttgcttcgcagttgtcagattcgcgaacgaatctgacaactgcgaagcttttacttggctagatggtggttgcccgcgggtccagggttcaagtccctgttcgggcgcca。
28、在sarn3w、sarn5w、sarn3w-2x和sarn5wt的核苷酸序列中,tttt为支架序列。
29、优选的,所述sirna的个数为≥3。
30、更优选的,所述sirna的个数为3或5。当sirna的个数为3时,sarn颗粒的rna支架中含有3个tttt;当sirna的个数为5时,sarn颗粒的rna支架中含有5个tttt。
31、优选的,所述rna支架为sarn3w或sarn5w。
32、由于ecr基因(ecdysone receptor gene,蜕皮激素受体基因)在赤拟谷盗的生长发育中起着关键的调控作用。具体而言,ecr基因编码的蜕皮激素受体是昆虫蜕皮和变态过程中不可或缺的调控因子,影响蜕皮、变态、组织发育和细胞凋亡等多个方面,因此该申请选择的靶向目标基因为赤拟谷盗ecr基因,该基因的基因库登记号为xm_008199412.2。
33、本发明的目的之二在于提供一种如本技术所述的一种含小干扰rna的核酸纳米颗粒的制备方法,其特征在于,包括以下步骤:
34、步骤1、以赤拟谷盗ecr基因为靶向目标基因设计含21个核苷酸的sirna,选择得分最高的3~5个sirna序列作为靶向位点;
35、步骤2、基于互补配对设计负载有多个sirna的单链rna分子;
36、步骤3、根据单链rna分子序列,采用体外转录技术转录合成所需的sirna,并将sirna整合进具有3~5个折叠单位的rna支架上,形成一条单链rna分子;
37、步骤4、将所获单链rna分子在90℃下变性5分钟,然后在冰上迅速冷却15分钟,将含有12.5mm mg2+的na-hepes缓冲液(ph 8.0)加入变性的rna样品中,然后在50℃下退火30分钟,50℃至26℃退火10分钟,最后在4℃下冷却2小时,获得同样具有3~5个折叠单位的rna纳米颗粒。
38、优选的,步骤3还包括将sirna整合进具有3~5个折叠单位的rna支架上后,在每个sirna臂的末端基于互补配对加入90°-kink结构,其中所述90°-kink结构如图6所示。
39、优选的,步骤3还包括将sirna整合进具有3~5个折叠单位的rna支架上后,在每个sirna臂的末端基于互补配对加入trna-scaffold结构,其中所述trna-scaffold结构如图8所示。
40、本发明的目的之三在于提供一种如本技术所述的一种含小干扰rna的核酸纳米颗粒(简称为sarn)或如本技术所述的制备方法制备的核酸纳米颗粒在制备sarn核酸递送系统中的应用。
41、本发明的目的之四在于提供一种含小干扰rna的核酸纳米颗粒或如本技术所述的制备方法制备的核酸纳米颗粒在制备用于防治赤拟谷盗药物中的应用。
42、本发明的目的之五在于提供了一种重组质粒,所述重组质粒是通过将含小干扰rna的核酸纳米颗粒的编码dna序列置于t7启动子3’端,而后插入到pet23a质粒中获得的。
43、优选的,所述重组质粒包含任意一种含小干扰rna的核酸纳米颗粒的编码dna序列。
44、优选的,所述重组质粒的原始表达载体为pet23a。
45、优选的,所述重组质粒的核苷酸序列是seq id no.15、seq id no.16、含小干扰rna的核酸纳米颗粒的编码dna序列、seq id no.17依次连接。根据在所述重组质粒中插入的rna支架不同,重组质粒分别命名为:pet23a-sarn3w、pet23a-sarn5w、pet23a-sarn3w-2x、pet23a-sarn5wt。
46、本发明的目的之六还在于提供一种利用大肠杆菌大规模生产sarn的方法,其特征在于,包括以下步骤:
47、将上述的重组质粒导入大肠杆菌e.coli ht115(de3)菌株中,获得重组e.coli;
48、在30ml补充有50μg/ml氨苄青霉素的lb培养基接种重组e.coli,并在37℃、200rpm下过夜培养,得过夜培养物;
49、将500ml含有相同抗生素浓度的lb培养基接种过夜培养物,并在37℃下培养3小时,重组大肠杆菌细胞通过10倍自动诱导培养基(ai)在37℃下诱导6小时,其中ai是通过混合lb培养基(25g/l)和乳糖(6.25g/l)配制而成。
50、本发明制备的含小干扰rna的核酸纳米颗粒的防治赤拟谷盗药物可以以冻干成粉末形式(最终产品)以及口服递送方式给药。
51、本发明的有益效果是:本发明保护的含小干扰rna的核酸纳米颗粒是由一条单链rna自组装而成,具有相对较高的空间电荷密度、良好的疏水性和灵活性,可增加细胞摄取和基因靶向沉默效率;后续可利用细菌表达系统进行规模化生产。同时核酸纳米颗粒具备良好的柔性,利于穿透血管并增强增强渗透和滞留(epr)效应,因此可高效将sirna递送至目标位点。此外,sarn核酸递送系统普适性高,且具有良好的生物相容性,可同时搭载多个sirna,因此可作为探针用于临床诊断,且在高通量基因靶向干扰领域也具备独特优势;本技术保护的可编程单链rna折叠策略基于一条具有拓扑简洁性的长单链rna,因此可通过细菌表达系统实现大规模生产。sarn技术的推广有望为病虫害管理和生物治疗领域带来新进展;而且与通过体外转录或化学合成生产的单链rna相比,本技术通过将含sarn的编码dna序列的重组质粒导入大肠杆菌中进行大规模发酵生产制得sarn液体浓缩物和冻干粉末的生产成本大幅降低,甚至与大规模生产的双链rna的成本保持竞争力,这个全方位技术包的开发可以为rna基因沉默策略的实际应用提供一个高效且经济可行的解决方案。
本文地址:https://www.jishuxx.com/zhuanli/20241120/333518.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。