一种抗花生青枯病的m6A去甲基化酶AhALKBH15基因及其鉴定和应用
- 国知局
- 2024-06-20 10:45:56
本发明属于基因工程,尤其涉及一种抗花生青枯病的m6a去甲基化酶ahalkbh15基因及其鉴定和应用。
背景技术:
1、花生(arachishypogeal.)是全球最重要的油料和经济作物之一。细菌性青枯病(bw)是一种典型的维管束病害,严重影响花生的产量和质量,可导致50%以上的产量损失(jiang等人,2017年)。花生青枯病的病原菌是土传细菌ralstoniasolanacearum(r.solanacearum)。一旦r.solanacearum存在于特定地点的土壤中,就很难完全根除。因此,防止bw危害的最经济、最有效的方法是培育抗bw的新品种,这就需要挖掘抗病基因。在过去几年中,人们已经做出了一些努力来鉴定控制bw抗性的数量性状位点(qtl)(zhao等人,2016;wang等人,2018)。一些候选抗性基因(r-基因)已在主要qtls中被确定并表征出来(luo等,2020年;qi等,2022年)。例如,zhang等人(2017年)和zhuang等人(2019年)克隆了ahrlk1和ahrrs5(拟南芥抗性基因rrs1-r和erecta的同源物),并证明在烟草中异源过表达这两个基因可提高bw抗性。虽然在不同的花生品种中检测到了几个抗bw的qtl,但目前还不清楚表观遗传修饰是否与花生-茄属植物相互作用中的抗病性有关。
2、表观遗传修饰很常见,已被证明可调控植物生长、果实发育以及对真菌和病毒胁迫的反应(hu等人,2022年;chinnusamy等人,2009年)。dna、rna和蛋白质中存在多种类型的化学修饰,但rna修饰最为丰富(sonavane等,2009年;he等,2021年)。迄今为止,已检测到170多种rna修饰,分布在编码和非编码rna中(lorenz等人,2017年)。最常见的mrna修饰是n1-甲基腺嘌呤(m1a)、5-甲基胞嘧啶(m5c)和n-甲基腺嘌呤(m6a)(frye等人,2016;shi等人,2020)。m6a修饰最为常见,占所有rna修饰的80%以上(shen等人、m6a修饰无论是在影响的mrna比例方面,还是在每个修饰的mrna上出现的修饰数量方面,都非常丰富。例如,约33%的人类和小鼠mrna含有m6a(klungland等人,2014年;cai等人,2021年)。在病毒中,带有m6a的mrna每条含有1到15个修饰(yue等人,2019年;zheng等人,2020年),但在拟南芥中这一数字较低(0.7到1)(luo等人,2014年)。
3、m6a修饰是可逆的、动态的。m6a甲基化酶,去甲基化酶,甲基化阅读蛋白识别它们,触发特定的生物功能(kan等,2017;shi等,2019;yang等,2019)。与人类(homosapiens)、小鼠(musmusculus)、酵母等不同,m6a已被证明在5′非翻译区(utr)、外显子和3'utr中分布不均(lietal、5′utr中的m6a修饰主要与mrna的编辑、降解和剪接有关,而3′utr中的m6a修饰主要与mrna的结构稳定性、翻译起始和poly-a结合有关(fustin等,2013)、在草莓中,m6a修饰增强了nced5和areb1的mrna稳定性,促进了abar的翻译效率,m6a甲基转移酶mta和mtb对草莓果实成熟有积极调控作用(zhou等,2021)。fto介导的m6a去甲基化促进了染色质开放和转录激活,导致叶片中约11000个基因和根中约7000个基因上调,激活了多种途径(yu等,2021年)。在a.thaliana中,在abi1和bes1中观察到较高的m6a,它们对aba信号转导有负向调节作用。这导致abi1和bes1mrna通过m6a依赖性机制降解,导致它们的表达水平下降(tangetal、2022年)。m6a修饰已被证明在植物界广泛存在,并在许多途径的调控中发挥着不可或缺的作用,尤其是在生物和非生物胁迫响应中(刘等人,2020年;毛等人,2021年;王等人,2022年;任等人,2022年)。例如,苜蓿花叶病毒(amv)的外壳蛋白(cp)与拟南芥m6a去甲基化酶蛋白atalkbh9b相互作用,会影响拟南芥对amv的抗性(martínez等,2017)。zhang等(2021)发现,水稻中的m6a修饰水平在病毒感染后增加,并在水稻-病毒相互作用过程中呈现动态变化。guo等(2022)研究发现,malushupehensis基因mhytp2影响m6a的修饰,m6a在白粉病感染过程中调控malusdomestica易感基因mdmlo19的稳定性。然而,m6a修饰在花生抗白粉病中的特性和功能尚未阐明。
技术实现思路
1、本发明所要解决的技术问题是确定能够抗花生青枯病的基因。
2、为解决该技术问题,本发明提供一种抗花生青枯病的m6a去甲基化酶ahalkbh15基因及其鉴定和应用。
3、本发明的目的是通过以下技术方案实现的。
4、一种抗花生青枯病的m6a去甲基化酶ahalkbh15基因,所述ahalkbh15基因的rna序列如seq id no:1所示。
5、所述ahalkbh15基因编码的氨基酸序列如seq id no:2所示。
6、一种抗花生青枯病的抗性基因ahcq2g6y,所述ahcq2g6y基因的rna序列如seq idno:5所示。
7、所述ahcq2g6y基因的氨基酸序列如seq id no:6所示。
8、一种提高抗花生青枯病抗性的方法,所述m6a去甲基化酶ahalkbh15可以去除ahcq2g6y的m6a修饰,导致m6a水平降低,抗性基因ahcq2g6y上调,ahcq2g6y表达的上调促进了花生对bw的抗性。
9、提高抗花生青枯病抗性的方法,通过鉴定m6a去甲基化酶ahalkbh15基因和ahcq2g6y基因,验证了m6a去甲基化酶ahalkbh15可以去除ahcq2g6y的m6a修饰,导致m6a水平降低,抗性基因ahcq2g6y上调,ahcq2g6y表达的上调促进了花生对bw的抗性,步骤如下:
10、(1)bw接种和青枯菌计数方法
11、花生品种农大花生108(h108)和农大花生107(h107)接种青枯菌,
12、处理方法为水培法,当花生根长到4厘米时,将秧苗移到培养箱中(光/暗周期为14小时/10小时),
13、在3叶期,切下0.5厘米的主根尖,将其浸泡在浓度为108cfuml-1的细菌溶液中,接种r.solanacearum,以水作为对照,在培养箱中培养,进行细菌检测;
14、(2)m6a甲基化测序和分析
15、cutadapt(martinm.,2011)和perl脚本用于去除含有适配体污染、低质量碱基和未确定碱基的读数;使用fastp验证序列质量,
16、使用hisat2以默认参数将读数映射到arachis hypogaea的基因组;
17、在基因组上扩展候选峰值区域,以获得一定长度的建模区域;
18、根据该区域内所有读数的唯一比对,使用泊松分布模型进行检验,并计算候选峰区域的p值;
19、ip和输入文库的映射读数被提供给r软件包;
20、通过在线网站(http://www.cuilab.cn/sramp/)预测了m6a出现区域的位置;
21、(3)rna-seq和数据分析
22、接种h108和h107植物并在0、1和7dpi感染青枯菌;
23、提取总rna;
24、对裂解的rna片段进行反转录,以创建最终的cdna文库;
25、差异表达基因(degs)被log2(折合变化)>1,并通过r软件包进行统计学意义(p<0.05)鉴定;
26、进行了基因本体(go,http://geneontology.org/)和京都基因组百科全书(kegg,https://www.kegg.jp/)通路富集分析;
27、(4)qrt-pcr和merip-qpcr分析
28、实时定量pcr(qrt-pcr)测定了青枯菌感染和植物激素诱导的花生基因的表达,分别于0、0.5、1.0和7.0dpi采集受青枯菌感染的h108和h107植株的根、茎和叶,用sa、meja和aba处理三叶期的h108和h107,用无菌水处理对照;
29、按照植物rna提取试剂盒的说明提取总rna,然后使用反转录试剂盒进行反转录;
30、对获得的第一链cdna进行qrt-pcr;
31、通过ncbi的在线网站primerblast设计了花生基因的qrt-pcr特异引物;
32、候选基因表达的相对定量(2-δδct)方法;
33、(5)花生中m6a甲基化酶和rx_n(抗病蛋白)基因的全基因组鉴定
34、花生的氨基酸序列是从peanutbase中检索的,花生的结构域是通过hmmer3网站预测的;通过提交pfam来预测氨基酸序列,以确定保守的结构域;
35、使用mg2c软件绘制染色体位置图,使用meme对蛋白质结构域进行分析。然后根据序列比对结果,用mega7.0构建系统发育树;
36、使用plantcare预测并绘制了所选基因启动子的顺式作用元件;
37、植物载体的构建和瞬时转化将候选基因的全长编码序列插入pcambi1300-yfp载体的35s启动子和黄色荧光蛋白(yfp)之间,就得到了花生表达载体;
38、利用primer5.0软件设计了待克隆全长基因的末端引物;
39、使用primer star max dna聚合酶、cdna和特定引物扩增候选基因片段;
40、将纯化的pcr产物连接到pcambi1300-yfp线性化载体中;
41、提取质粒dna;
42、通过农杆菌介导法在烟草和花生嫩叶中瞬时过表达花生候选基因,将重组载体和空载体转化到农杆菌eha105中,注入的烟草在28℃的黑暗环境中培养12小时,然后在28℃的光照下培养2天;
43、拟南芥原生质体的分离和转化,在23℃黑暗条件下培养24小时后,通过lsm710激光扫描共聚焦显微镜观察并拍摄蛋白质融合的荧光;
44、液相色谱-串联质谱法(lc-ms/ms)定量分析mrnam6a从花生植株中分离出总计200ng的rna样品,按照说明用核酸酶p1和磷酸二酯酶i处理试剂盒;
45、在缓冲液(10mmtris-hclph7,20mm醋酸钠,2mmzncl2)中分别用2单位和0.01单位的酶在37℃下消化rna 12小时,然后再用碱性磷酸酶在37℃下消化1小时;
46、用10kda过滤管去除消化后的酶;将rna溶液稀释10倍,其中10μl用于lc-ms/ms。实验设置了三个独立的生物重复;
47、(6)mrna稳定性检测
48、将ahalkbh15-yfp和pcambia1300-yfp转染到h107叶原生质体中;
49、向转染的花生原生质体中加入溶于ddh2o的30μgml-1放线菌素d培养0.5小时后,取花生原生质体,0小时作为对照,然后每隔3小时收获一式三份样品;
50、通过qrt-pcr检测基因的mrna水平,
51、蛋白质表达和纯化将ahalkbh15 cdna序列克隆到pcold-gst载体骨架中,并在n端添加6xhis-tag和gst-tag;
52、在大肠杆菌rosetta2(de3)细胞中过表达ahalkbh15和his-gst-tag;
53、用超声波裂解细胞;
54、上清液中的溶解蛋白纯化,洗脱;
55、洗脱的蛋白质馏分通过脱盐柱,然后将缓冲液换成储存缓冲液;
56、纯化的蛋白质在液氮中急速冷冻并储存;
57、(7)m6a去甲基化测定
58、体外m6arna去甲基化试验在40μl反应中进行,反应物中含有0.02-200pmolrna片段(包括m6a位点(ccaugaaggm6acucacagaa))、5μl ahalkbh15蛋白和2μl superaseinrnase inhibitor,反应缓冲液为1×(10mmkcl、283μm(nh4)2fe(so4)2、50mmmes、300μm 2-ketoglutarate和2mm l-抗坏血酸);alkb用作阳性对照,his-gst用作阴性对照;去甲基化处理反应在25℃下进行3小时,然后加入4μl 50mm edta进行淬灭;
59、(8)m6adotblot
60、去甲基化处理后,将rna点在尼龙膜上并进行紫外交联;
61、在25℃下用1×pbst中的5%脱脂干奶阻断膜30分钟,然后在4℃下用1×pbst中的兔抗-m6a抗体孵育过夜;
62、用1×pbst大面积洗涤后,用1×pbst中的hrp结合山羊抗兔igg抗体在25℃孵育1.5小时;
63、用1×pbst洗膜,用ecl底物显影,用touch成像仪成像,用touch viewer量化数据,并用image j对结果进行归一化;
64、(9)叶片中r.solanacearum菌落数量的统计分析
65、将pcambia1300-yfp、ahcq2g6y-yfp、ahcq2g6y-muta、ah5dh5nx-yfp在叶片中瞬时过表达3天,然后在叶片中接种r.solanacearum(浓度为108cfuml-1)和氨苄青霉素;
66、对叶片中r.solanacearum菌落数量进行统计分析;
67、每个样品准备三个重复;
68、(10)两种花生品种对r.solanacearum感染的病理特征
69、对接种青枯菌的h108和h107进行病理学分析;
70、检测青枯菌是否有效感染了h108和h107;
71、(11)花生品种h108和h107接种青枯菌后的全基因组m6a甲基化图谱
72、探索了受青枯菌的h108和h107植株中m6a的修饰谱;
73、确定可能与花生bw抗性相关的差异;
74、(12)两个花生品种之间的m6a修饰差异
75、研究m6a的修饰如何影响花生对茄科r.solanacearum感染的反应,
76、对茄科r.solanacearum感染的h108和h107之间的m6a修饰进行了差异分析;
77、(13)m6a在mrna转录本中的甲基化可能会影响目标基因的表达和翻译
78、在0、1和7dpi时,h108中分别有16395、8283和4504个基因被不同的m6a修饰;
79、共有5346个不同m6a修饰的基因被鉴定为只存在于r.solanacearum感染的h108样本中;对基因进行了kegg生化通路富集分析;
80、(14)花生中与m6a修饰相关基因及其表达的全基因组鉴定
81、构建了系统发育树;
82、研究了花生m6a相关基因在r.solanacearum感染过程中的表达谱;
83、在假定的花生m6a相关基因的启动子区域发现了几种类型的顺式调节元件;
84、研究植物激素是否会影响花生m6a修饰基因的表达,用sa、meja或aba处理了h108和h107幼苗;
85、对花生中与m6a修饰相关基因及其表达的全基因组鉴定;
86、(15)m6a修饰与r.solanacearum感染过程中基因表达之间的关系
87、lc-ms/ms检测了h108和h107的mrnam6a总水平;
88、研究m6a的修饰如何影响花生的生长和对生物胁迫的响应;
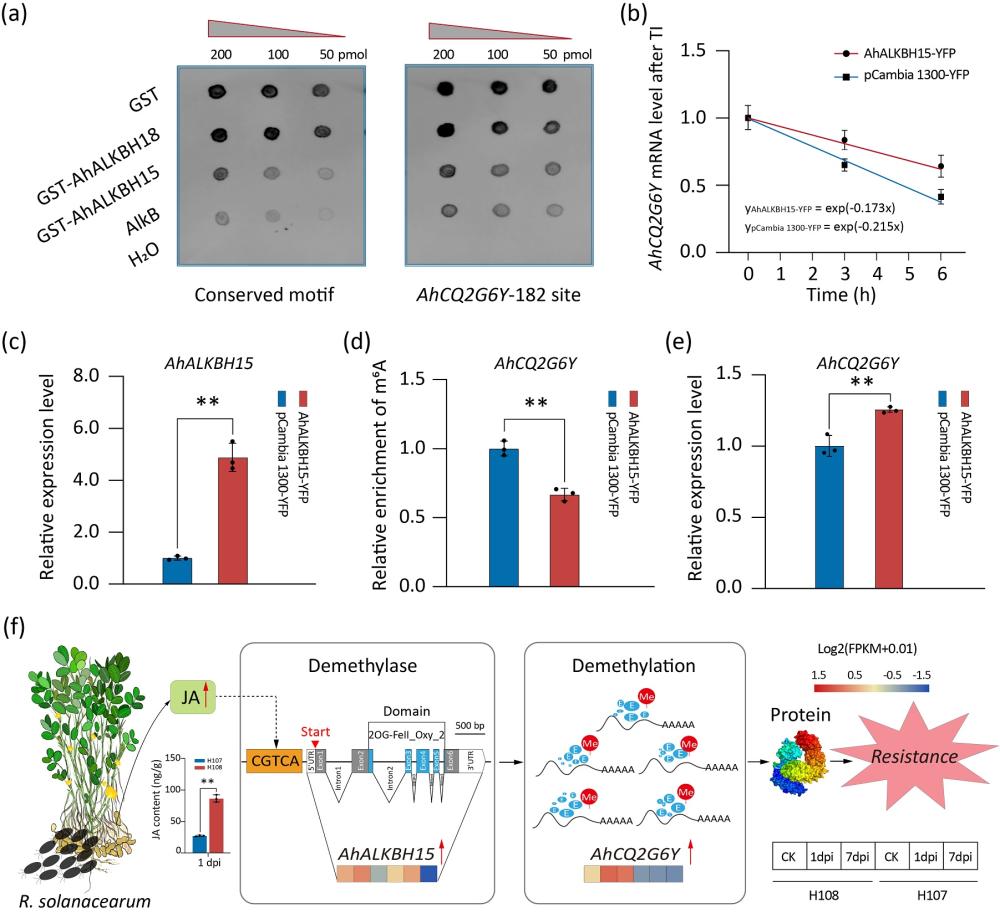
89、研究m6a修饰如何影响基因表达水平;
90、确定m6a修饰改变的degs是否与花生对青枯菌感染的反应有关,确定m6a修饰改变的degs是否与花生对青枯菌感染的反应有关;
91、(16)ahalkbh15介导的ahcq2g6y m6a甲基化可能会提高花生对茄科细菌感染的抗性研究了h108和h107植株接种青枯菌后ahcq2g6y中m6a的动态;
92、pfam分析表明ahcq2g6y具有典型的抗病蛋白结构;
93、检测了h108和h107中rx_n基因的表达;
94、ahcq2g6y-yfp和ah5dh5nx-yfp融合蛋白在烟草叶片中的表达;
95、进一步研究ahcq2g6y、ahcq2g6y-muta和ah5dh5nx在花生bw抗性中的功能,将烟草叶片转化以瞬时过表达这三个基因,然后接种r.solanacearum;
96、验证ahcq2g6y对r.solanacearum感染的抑制作用,在花生叶片中瞬时过表达融合蛋白ahcq2g6y-yfp;
97、验证ahalkbh15和ahalkbh18在花生中作为m6a去甲基化酶的功能,从大肠杆菌系统中表达并纯化了重组谷胱甘肽s-转移酶(gst)-ahalkbh15和gst-ahalkbh18蛋白;对候选基因ahcq2g6y的m6a修饰进行了merip-qpcr验证,发现与空对照相比,ahcq2g6y中的m6a修饰水平显著降低。一种抗花生青枯病的m6a去甲基化酶ahalkbh15基因在花生抗青枯病基因工程中的应用。
98、相对于现有技术,本发明的技术效果是:本发明提供一种抗花生青枯病的m6a去甲基化酶ahalkbh15基因,对ahalkbh15基因的鉴定和表征为深入了解花生对bw的抗性机制,m6a去甲基化酶ahalkbh15可以去除ahcq2g6y的m6a修饰,导致m6a水平降低,抗性基因ahcq2g6y上调,ahcq2g6y表达的上调促进了花生对bw的抗性,发现了ahalkbh15用于花生抗性育种的巨大潜力。
本文地址:https://www.jishuxx.com/zhuanli/20240619/292.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表