一种水溶性酞菁/聚多巴胺纳米球及其制备方法和应用与流程
- 国知局
- 2024-08-22 14:22:04
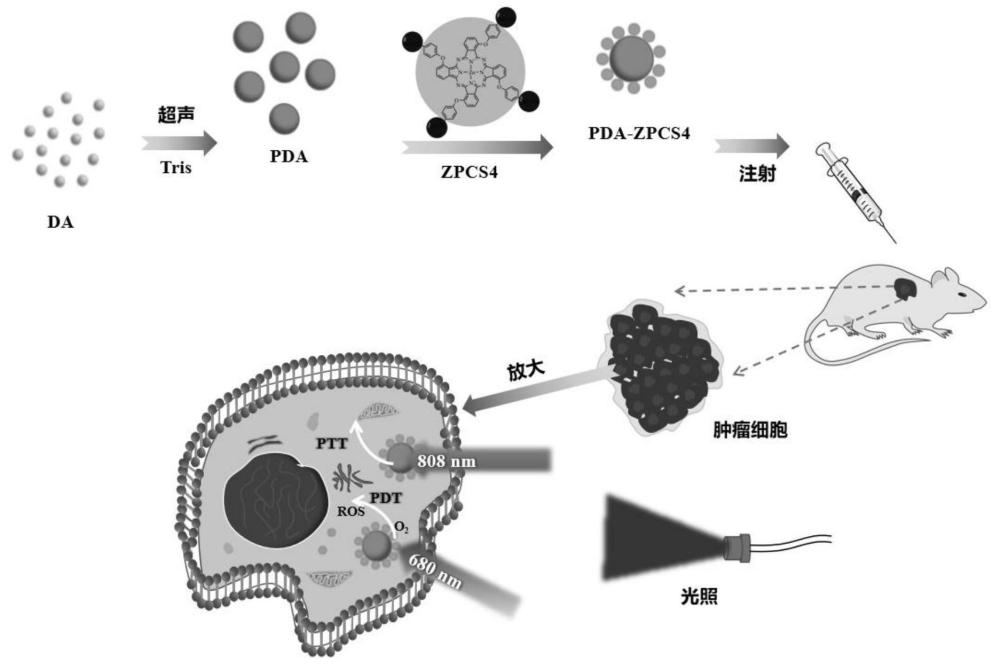
本发明涉及纳米材料以及生物,尤其涉及一种水溶性酞菁/聚多巴胺纳米球及其制备方法和应用,特别涉及一种光动力和光热联合治疗的水溶性酞菁/聚多巴胺纳米球及其制备方法和在抗肿瘤上的应用。
背景技术:
1、癌症因具有细胞增值机制失常、侵略性增长以及高死亡率的特点,成为威胁人类健康的主要疾病之一。目前,癌症主流治疗方法包括手术切除、化学治疗和放射治疗,但均存在自身的局限性。如手术切除主要针对早期癌症,对转移瘤无效;化疗、放疗则存在耐药性、复发性、同损伤性等副作用,导致治疗效果不佳。因此,针对目前传统治疗方法的不足,人们将目光转向新型治疗方法,如基因治疗、免疫治疗、光学治疗等。其中,光学治疗具有无侵入、低毒、可重复使用的有优点备受人们的关注。
2、光学治疗主要分为光动力治疗(pdt)和光热治疗(ptt)。pdt利用光敏剂在特定光照下,产生具有细胞毒性的单线态氧,基于细胞毒性损伤、凋亡。ptt在特定光照下,光热剂无辐射跃迁时产生热量,使局部组织升温,从而达到对肿瘤组织的热损伤、热消融。目前,批准上市的pdt光敏剂有11种,主要为卟啉类光敏剂如卟吩姆钠、替莫卟吩等。此外,一部分光敏剂处于i期、ii期临床试验阶段。pdt已有商品化和临床试验的光敏剂,但仍存在很多技术难点和不足。如卟啉类光敏剂的化学结构不明确、水溶性差、生物组织窗口较短(<650nm),缺乏靶向性以及光毒性等。因此,人们的目光转移到寻求新型光敏剂。其中,酞菁是一种完全人工合成,具有明确的化学结构的物质,与卟啉类似的四吡咯形成的18π环结构。目前,获批临床试验的酞菁类光敏剂包括脂质体包覆的锌酞菁、pc4、photosens、photocyaine。酞菁有良好的生物治疗窗口,明确的化学结构以及低光毒性。酞菁化合物已开发有成百上千种类型,但获临床试验的光敏剂没有得到新的进展,这表明酞菁类光敏剂本身存在水溶性差、缺乏靶向性等不足。酞菁作为第二代光敏剂,具有修饰性强、良好的生物治疗窗口,因此,研究酞菁类光敏剂仍具有非常重要的意义。
3、此外,在光学治疗中,纳米输送载体作为一门新兴技术,可设计携带多种治疗药物。纳米技术与pdt结合可增加光敏剂的负载量、赋予双亲性、epr效应、可修饰等优势,成为纳米医学领域的研究热点。目前,很多纳米制剂已被批准或在临床试验中使用,如抗癌药物阿霉素、紫杉醇等。纳米载体一般是可生物降解(如天然物或聚合物基纳米颗粒)或具有治疗价值的不可降解的纳米粒子(如陶瓷、金纳米颗粒)。
4、多巴胺(da)作为神经系统传递信号的神经递质,其自聚物(pda)具有生物相容性良好、粘附性强、螯合性强、可降解等特性,深受人们研究关注。pda含有大量的羟基和胺基基团,可负载或改性成功能纳米载体。此外,pda在近红外具有吸收能力,可产生热量,进而实现ptt。目前,批准上市的ptt光热剂仅有吲哚箐绿,表明光热剂的研究仍有非常重要的意义。
5、为此,本发明提供了一种水溶性酞菁/聚多巴胺纳米球及其制备方法和应用。
技术实现思路
1、基于此,本发明的目的是提供一种水溶性酞菁/聚多巴胺纳米球及其制备方法和应用,该水溶性酞菁/聚多巴胺纳米球为一种pda负载水溶性优良的四磺化锌酞菁(zpcs4)纳米递送系统,即zpcs4共价连接到多巴胺纳米粒子上;以pda作为载体,旨在提高zpcs4的分散性和联合治疗(ptt和pdt)。制备的zpcs4/pda纳米材料保持了zpcs4在光照(680nm)下生成活性氧以及避免团聚引起猝灭的特性;pda既可以作为纳米输送载体,又可以作为光热剂。当pdt与ptt联合治疗时,光热效应使局部组织升温,加速血液循环,为光敏剂输送更多的氧气,从而提高光动力效果。
2、为了实现上述目的,本发明的技术方案如下:
3、根据本发明的第一方面,提供了一种水溶性酞菁/聚多巴胺纳米球的制备方法,包括:
4、(1)将多巴胺盐酸盐、三羟基氨基甲烷tris置于混合溶液中进行超声自聚,反应得到pda纳米粒子;
5、(2)参照doi:10.1002/chem.201404514的路线合成酞菁化合物zpcs4;
6、(3)将pda纳米粒子和zpcs4分散于水溶液中,经超声处理后,得到zpcs4/pda复合物溶液,转至常温条件进行搅拌,待反应结束后,离心,洗涤,得到zpcs4/pda纳米材料。
7、在一些实施例的一些可选的实现方式中,步骤(1),包括:
8、混合溶液为水-醇体系;其中,所述醇的质量分数为10%~30%;
9、tris质量分数为0.1%~10%;
10、首先将tris溶解于水中,随后加入混合溶液,超声分散0.5h后,加入多巴胺盐酸盐;其中,反应条件为500w~1500w,01:00模式,超声的温度包括反应物温度和储液槽温度,分别为5~10℃和30~70℃;
11、超声自聚反应的时间为1h~5h,得到pda纳米粒子。
12、在一些实施例的一些可选的实现方式中,步骤(2),包括:
13、首先制备前驱体,随后以前驱体作为1/4模板,在高沸点醇溶剂中,强碱作为催化剂,经高温回流,得到zpcs4。
14、在一些实施例的一些可选的实现方式中,步骤(2),包括:
15、以3-硝基邻苯二腈和4-羟基苯磺酸钠为原料,在k2co3下发生亲核取代反应,合成4-磺酸钠苯氧基邻苯二腈pcs前驱体;其中,亲核取代反应的溶剂为二甲基亚砜dmso;在高沸点醇溶剂中,以pcs为原料、强碱为催化剂、可溶性锌盐为金属盐;
16、待反应结束,收集沉淀物,通过柱层析、透析对产物分离纯化,最终得到zpcs4。
17、其中,前驱体pcs的合成温度为25~60℃,在n2下,dmso为反应溶液,以3-硝基邻苯二腈和4-羟基苯磺酸钠为原料,在k2co3下反应,反应时间为10h~48h;反应结束后,收集滤液,加入溶剂,不局限于乙酸乙酯、二氯甲烷、三氯甲烷;通过改变溶液的极性,使pcs从强极性溶液中沉淀,最后对其进行洗涤,干燥,得到pcs。
18、其中,在高沸点醇溶液中,以pcs为原料,1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)为催化剂,合成温度为90~150℃,锌盐为金属配位离子,反应时间为2h~48h;待反应结束后,收集沉淀物,通过柱层析对产物分离纯化,得到zpcs4。
19、其中,zpcs4的分子式为:
20、
21、m:zn、al、si。
22、在一些实施例的一些可选的实现方式中,步骤(3),包括:
23、将pda纳米粒子和zpcs4分散于水中,两者的质量比为1:1~1:100,经超声处理后,得到zpcs4/pda复合物溶液,转至常温条件进行搅拌;其中,超声条件为100w~300w,超声时间为10min~120min;搅拌速度为200~2000rpm/min;室温搅拌时间为2h~48h;待反应结束后,离心,洗涤,得到zpcs4/pda纳米材料。
24、根据本发明的第二方面,提供了一种水溶性酞菁/聚多巴胺纳米球,所述水溶性酞菁/聚多巴胺纳米球为zpcs4/pda纳米材料,由以上的制备方法制备得到。
25、根据本发明的第三方面,提供了一种水溶性酞菁/聚多巴胺纳米球的应用,该水溶性酞菁/聚多巴胺纳米球用于光学治疗中的应用。
26、本发明采用超声自聚反应,在tris碱性缓冲盐体系下,制备pda纳米粒子;随后使用四分之一法制备具有亲水性的zpcs4。在超声强分散的条件下,利用pda的强黏附性和多胺基、羟基基团,与zpcs4发生共价结合或静电吸附作用,制备zpcs4/pda纳米材料。
27、本发明的优点及有益效果在于:
28、(1)本发明利用zpcs4在近红外区域有良好的吸收,在近红外光(680nm)的激发下,能够产生单线态氧(ros),用于肿瘤细胞的杀灭与凋亡,用作光敏剂;
29、(2)本发明利用纳米pda具有良好的生物相容性、强黏附性、可降解的特点,作为分散载体。pda在近红外区域有良好的吸收,能够产热,利用该热量热损伤或热消融肿瘤细胞,用作光热剂;
30、(3)本发明利用超声自聚法制备的pda纳米粒子,能够获得高分散性、表面缺陷的纳米粒子,作为后续的静电吸附或共价结合zpcs4的输送载体;
31、(4)本发明制备zpcs4/pda纳米粒子具备光动力/光热联合光学模式,联合治疗优势高于单一光学治疗。
本文地址:https://www.jishuxx.com/zhuanli/20240822/278365.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。