一种高效2′-氟-2′-脱氧尿苷的合成方法与流程
- 国知局
- 2024-08-22 14:52:50
本发明涉及有机合成领域,具体涉及一种高效合成2′-氟-2′-脱氧尿苷的方法。
背景技术:
1、2′-氟-2′-脱氧尿苷是一种关键的药物中间体,广泛应用于寡核苷酸领域,其中,氟原子的引入,显著提升了寡核苷酸对核酸酶水解的稳定性。
2、在现有的技术中,2′-氟-2′-脱氧尿苷的合成主要有两种方法:
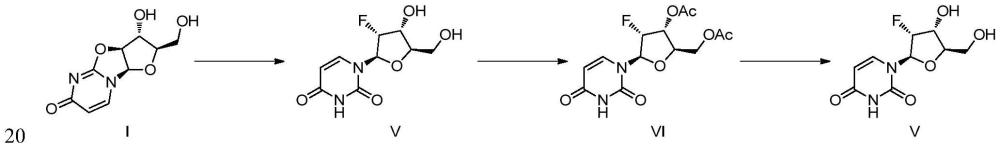
3、第一种方法以2,2′-脱水尿苷i为起始原料,通过使用亲核性氟化试剂(如氟化氢吡啶、无水氟化钾等)进行直接开环氟化。这一过程需要在高温和高压的条件下进行,反应条件苛刻(参考文献:cn112500446a、wo2021030763等)。尽管合成路线较短,但该方法产生的副产物较多,尤其是开环水解的副产物,导致产品纯度较低。此外,反应的粗产品为粘稠油状,纯度不高,难以纯化。因此,需要通过乙酰化反应生成化合物vi以进行纯化,然后再脱乙酰基保护,最终得到2′-氟-2′-脱氧尿苷,即化合物v。这一合成路线的收率较低,生产成本较高。
4、1)直接开环氟化路线
5、
6、第二种方法同样以2,2′-脱水尿苷i为起始物料,但首先使用缩醛保护基保护羟基,接着在碱性条件下开环,并利用羟基活化剂和亲核氟化试剂进行sn2氟化反应。然后在酸性条件下去除缩醛保护基,得到2′-氟-2′-脱氧尿苷(化合物v)的粗品。尽管粗品可以直接进行纯化,但是通过结晶得到的产品的液相纯度只有98.0~98.9%,且特定单杂较大,无法满足高质量产品的需求。通常,需要通过乙酰化-脱乙酰基保护的纯化步骤来获得高纯度的2′-氟-2′-脱氧尿苷(参考文献:cn113683648a、cn116239641a等)。
7、2)羟基保护-脱保护路线
8、
9、综上所述,这两种现有技术的合成方法均存在一定的局限性,本领域亟需一种高效经济且产物质量高的2′-氟-2′-脱氧尿苷合成工艺。
技术实现思路
1、为了克服现有技术的不足,本发明提供了一种2’-氟-2’-脱氧尿苷的高效合成方法,具有反应路线短、操作简单、生产成本低、产品收率高、纯度高、单杂低等优点。
2、在本发明的第一方面,提供了一种2′-氟-2′-脱氧尿苷的合成方法,包括如下步骤:
3、
4、s1.在有机碱a的存在下,化合物i与rcocl发生酯化反应,得到化合物ii;其中,r为c1-6烷基或c6-10芳基;优选为c3-6烷基或c6-10芳基;更优选为异丙基、异丁基或叔丁基;
5、s2.在酸性试剂的存在下,化合物ii发生开环反应,得到化合物iii;
6、s3.在有机碱b的存在下,化合物iii先与羟基活化剂发生取代反应,得到中间体化合物xvi,然后中间体化合物xvi与亲核氟化剂发生氟化反应,得到化合物iv;
7、s4.在有机溶剂d的存在下,化合物iv和脱羟基保护剂发生脱保护反应,得到化合物v,即2′-氟-2′-脱氧尿苷。
8、在一优选例中,所述有机碱a选自下组:n,n-二异丙基乙胺、三乙胺、吡啶、n-甲基吗啉、n-甲基咪唑、三乙烯二胺、1,8-二氮杂双环[5.4.0]十一碳-7-烯、1,5-二氮杂双环[4.3.0]壬-5-烯、4-二甲氨基吡啶、四甲基乙二胺、四甲基胍,或其组合;优选为n,n-二异丙基乙胺、吡啶和n-甲基咪唑。
9、在一优选例中,所述rcocl和化合物i的摩尔比为(2~5):1;优选为(2~3):1;和/或
10、所述有机碱a和化合物i的摩尔比为(2~10):1;优选为(2~4):1。
11、在另一优选例中,所述酯化反应在有机溶剂a中进行。
12、在另一优选例中,所述有机溶剂a选自下组:四氢呋喃、二氯甲烷、乙腈、二氧六环、2-甲基四氢呋喃、甲苯、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、甲基叔丁基醚、异丙醚、二甲亚砜,或其组合;
13、优选地,所述有机溶剂选自下组:乙腈、二氧六环、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺,或其组合;
14、更优选为n,n-二甲基甲酰胺。
15、在另一优选例中,所述有机溶剂a与化合物i的体积质量比为(1~9):1(ml/g);优选为(3~5):1(ml/g)。
16、在另一优选例中,所述酯化反应的温度为-10~100℃;优选为-10~60℃;更优选为20~30℃。
17、在另一优选例中,所述rcocl在0~20℃温度下添加。
18、在另一优选例中,所述酯化反应的时间为7~15h;优选为8~12h;更优选为9~11h。
19、在一优选例中,所述的步骤s2中,所述的酸性试剂选自下组:盐酸、硫酸、磷酸、乙酸、三氟乙酸、甲磺酸,或其组合;
20、优选地,所述的步骤s2中,所述酸性溶剂选自下组:盐酸、硫酸,或其组合;
21、更优选地,所述的步骤s2中,所述酸性试剂为5~25w/w%的盐酸水溶液或5~25w/w%的硫酸水溶液。
22、在一优选例中,所述的步骤s2中,所述的酸性试剂与化合物i的摩尔比为(2~20):1;优选为(3~10):1。
23、在另一优选例中,所述的步骤s2中,所述开环反应在有机溶剂b中进行。
24、在另一优选例中,所述的步骤s2中,所述有机溶剂b选自下组:四氢呋喃、二氯甲烷、乙腈、二氧六环、2-甲基四氢呋喃、甲苯、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、甲基叔丁基醚、异丙醚、二甲亚砜,或其组合;
25、优选地,所述的步骤s2中,所述有机溶剂b选自下组:乙腈、二氧六环、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺,或其组合;
26、更优选为n,n-二甲基甲酰胺。
27、在另一优选例中,所述的步骤s2中,所述有机溶剂b与化合物i的体积质量比为(1~9):1(ml/g);优选为(2~5):1(ml/g)。
28、在另一优选例中,所述的步骤s2中,所述开环反应的温度为-10~100℃;优选为30~90℃;更优选为70~80℃。
29、在另一优选例中,所述开环的反应时间为1~7h;优选为2~5h;更优选为3~4h。
30、在另一优选例中,所述步骤s2还包括以下步骤:开环反应结束后,加入碱性试剂,调节ph至6~8,搅拌0.5~1h,加入有机溶剂e萃取产物,得到化合物iii。
31、在另一优选例中,所述碱性试剂选自下组:碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、磷酸钾、醋酸钾、氢氧化钾、磷酸钠、醋酸钠、氢氧化钠、氢氧化锂、、水合氢氧化锂。
32、在另一优选例中,所述有机溶剂e选自下组:甲苯、甲基叔丁基醚、环戊基甲醚、异丙醚、乙二醇二甲醚。
33、在另一优选例中,所述步骤s1中酯化反应得到化合物ii后,不经处理,“一锅法”进行步骤s2所述的开环反应;且两步反应的溶剂为同一种溶剂。
34、在一优选例中,所述的步骤s3中,所述有机碱b选自下组:n,n-二异丙基乙胺、三乙胺、吡啶、n-甲基吗啉、n-甲基咪唑、三乙烯二胺、1,8-二氮杂双环[5.4.0]十一碳-7-烯、1,5-二氮杂双环[4.3.0]壬-5-烯、4-二甲氨基吡啶、四甲基乙二胺、四甲基胍,或其组合;
35、优选地,所述的步骤s3中,所述有机碱b选自下组:n,n-二异丙基乙胺、三乙胺、n-甲基咪唑,或其组合;
36、更优选地,所述的步骤s3中,所述有机碱b为三乙胺。
37、在一优选例中,所述的步骤s3中,所述羟基活化剂选自下组:全氟烷烃磺酰氟、芳基磺酰氟,或其组合;优选地,所述羟基活化剂为全氟丁基磺酰氟。
38、在一优选例中,所述的步骤s3中,所述亲核氟化剂为氢氟酸或其盐;优选为氢氟酸盐;更优选为氟氢酸吡啶或氟氢酸三乙胺。
39、在另一优选例中,所述的步骤s3中,所述有机碱b与化合物iii的摩尔比为(1~8):1;优选为(4~6):1。
40、在另一优选例中,所述的步骤s3中,所述羟基活化剂与化合物iii的摩尔比为(1~3):1;优选为(1~2):1。
41、在另一优选例中,所述的步骤s3中,所述亲核氟化剂与化合物iii的摩尔比为(1~5):1;优选为(2~3):1。
42、在另一优选例中,所述的步骤s3中,所述取代反应在有机溶剂c中进行,所述有机溶剂c选自四氢呋喃、二氯甲烷、乙腈、二氧六环、2-甲基四氢呋喃、甲苯、n,n-二甲基甲酰胺、甲基叔丁基醚、异丙醚、二甲亚砜,或其组合;
43、优选地,所述的步骤s3中,所述有机溶剂c选自下组:四氢呋喃、二氯甲烷、乙腈、二氧六环、n,n-二甲基甲酰胺、甲苯,或其组合;
44、更优选地,所述的步骤s3中,所述有机溶剂c为乙腈。
45、在另一优选例中,所述的步骤s3中,所述有机溶剂c与化合物iii的体积质量比为(1~15):1(ml/g);优选为(3~9):1(ml/g)。
46、在另一优选例中,所述取代反应的温度为10~100℃;优选为10~60℃;更优选为10~30℃。
47、在另一优选例中,所述s3中还包括以下步骤:对化合物iv进行打浆。
48、在另一优选例中,所述打浆的溶剂选自下组:甲醇、乙醇、异丙醇、正丁醇、乙腈、丙酮。
49、在另一优选例中,所述打浆的温度为20~80℃;优选为30~70℃;更优选为50~60℃。
50、在另一优选例中,所述打浆的时间为1~7h;优选为2~5h;更优选为3~4h。
51、在一优选例中,所述的步骤s4中,所述脱羟基保护剂选自下组:甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠、叔丁醇钾、氢氧化钠、氢氧化钾、n,n-二异丙基乙胺、三乙胺、氨甲醇溶液、1,8-二氮杂双环[5.4.0]十一碳-7-烯,或其组合;
52、优选地,所述的步骤s4中,所述脱羟基保护剂选自下组:甲醇钾、甲醇钠、乙醇钠、氢氧化钠、氢氧化钾、氨甲醇溶液、1,8-二氮杂双环[5.4.0]十一碳-7-烯,或其组合;
53、更优选地,所述的步骤s4中,所述脱羟基保护剂选自下组:氨甲醇溶液、甲醇钠、甲醇钾,或其组合。
54、在另一优选例中,所述的步骤s4中,所述脱羟基保护剂与化合物iv的摩尔比为(0.01~3):1;优选为(0.01~1):1;更优选为(0.03~0.1):1。
55、在另一优选例中,所述的步骤s4中,所述有机溶剂d选自下组:四氢呋喃、乙腈、二氧六环、2-甲基四氢呋喃、n,n-二甲基甲酰胺、甲基叔丁基醚、甲醇、乙醇、异丙醇、正丁醇、叔丁醇,或其组合;
56、优选地,所述的步骤s4中,所述有机溶剂d选自下组:四氢呋喃、n,n-二甲基甲酰胺、甲醇、乙醇;或其组合;
57、更优选地,所述的步骤s4中,所述有机溶剂d为甲醇。
58、在另一优选例中,所述的步骤s4中,所述有机溶剂d与化合物iv的体积质量比为(1~20):1(ml/g);优选为(3~8):1(ml/g)。
59、在另一优选例中,所述的步骤s4中,所述脱保护反应的温度为-10~80℃;优选为10~50℃;更优选为20~30℃。
60、在另一优选例中,所述的步骤s4中,所述脱保护反应的时间为11~30h;优选为12~25h;更优选为16~20h。
61、本发明的第二方面,提供了一种中间体化合物,所述中间体化合物选自下组:
62、
63、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
本文地址:https://www.jishuxx.com/zhuanli/20240822/280227.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。