一种取代1,2,4-噻二唑5-羧酸衍生物的制备方法与流程
- 国知局
- 2024-09-14 14:23:19
本发明属于有机合成领域,具体地,本发明涉及一种取代1,2,4-噻二唑5-羧酸衍生物的制备方法。
背景技术:
1、取代1,2,4-噻二唑-5-羧酸衍生物是一类重要的有机合成砌块,广泛应用于医药、农药,有机材料的合成中。在医药领域,3-甲基-1,2,4-噻二唑-2(3h)-碳酰肼是合成药物分子非唑尼坦(fezolinetant)的关键中间体,具有重要价值。
2、目前文献报道的取代1,2,4-噻二唑-5-羧酸衍生物的合成方法:
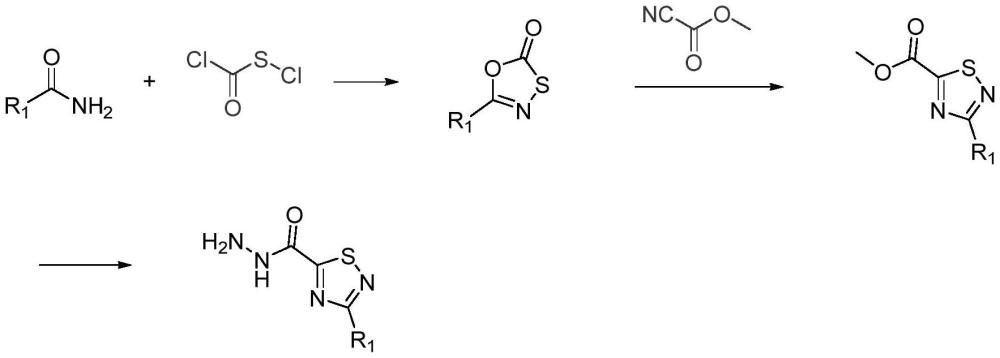
3、wo2013050424a1公开了一种3-甲基以及3-异丙基-1,2,4-噻二唑-5-羧酸衍生物的制备方法。该方法以乙酰胺或异丁酰胺、氯羰基亚磺酰氯和氰基甲酸甲酯为原料分制备到3-甲基以及3-异丙基-1,2,4-噻二唑-5-羧酸甲酯,随后与水合肼反应制备得到3-甲基以及3-异丙基-1,2,4-噻二唑-5-甲酰肼。
4、
5、该方法收率低,反应副反应多,难以纯化,产品质量差,而且氯羰基亚磺酰氯是危险试剂,存在供应问题,不适合大规模生产。
6、wo2017060488a公布了另一条基于贵金属催化插羰反应的3-甲基-1,2,4-噻二唑-5-甲酰肼合成路线。该方法以3-甲基-5-溴-1,2,4-噻二唑为起始原料,在贵金属钯和有机磷配体的催化下,与一氧化碳和甲醇反应,制备得到3-甲基-1,2,4-噻二唑-5-羧酸甲酯。
7、该方法用到昂贵的贵金属钯和有机磷配体,另外一氧化碳需要特殊的设备,导致其原料成本和生产成本都很高。
8、
9、wo2020128003a1公布了在强碱丁基锂的作用下3-甲基-5-溴-1,2,4-噻二唑与氯甲酸甲酯反应一步制备得到3-甲基-1,2,4-噻二唑-5-羧酸甲酯。
10、
11、该方法需要在超低温条件下进行,而且收率较低。
12、因此,本领域迫切需要一种原料廉价易得、反应条件温和、具有成本优势和易于工业化生产的取代1,2,4-噻二唑5-羧酸衍生物制备方法。
技术实现思路
1、本发明的一个目的是提供一种反应条件温和、成本低廉、易于工业化生产的取代1,2,4-噻二唑5-羧酸衍生物制备方法。
2、本发明的第一方面,提供了一种式ii所示化合物的制备方法,包括:
3、
4、在惰性溶剂中,在配体和铜盐的存在下,式i所示的化合物与金属氰化物发生偶联反应,得到式ii所示的化合物;
5、式中,
6、x为氯、溴或碘;
7、r为h、取代或未取代的c1-c6烷基、取代或未取代的c6-c10芳基。
8、在另一优选例中,r为h、c1-c6烷基。
9、在另一优选例中,r为甲基。
10、在另一优选例中,所述的金属氰化物选自氰化亚铜或氰化锌。
11、在另一优选例中,所述的金属氢化物为氰化亚铜。
12、在另一优选例中,所述的式i所示的化合物选自5-溴-3-甲基-1,2,4-噻二唑和5-氯-3-甲基-1,2,4-噻二唑。
13、在另一优选例中,所述的铜盐选自下组:氧化亚铜、氧化铜、硫酸铜、碳酸铜、噻吩-2-甲酸亚铜、醋酸铜、硝酸铜、乙基乙酰乙酸铜、溴化铜、氯化铜、氰化铜、乙酰丙酮铜、硫氰酸亚铜、碘化铜、碘化亚铜、溴化亚铜、氯化亚铜、氰化亚铜,或其组合;较佳地,为碘化亚铜。
14、在另一优选例中,所述的配体具有如下所示的结构:
15、
16、式中,
17、ra、rb、rc、rd和re各自独立地为h、取代或未取代的c1-c6烷基、取代或未取代的c6-c10芳基;
18、rf为h、羟基、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c6-c10芳基。
19、在另一优选例中,所述配体选自下组:n1,n2-双(4-羟基-2,6-二甲基苯基)草酰胺、n1,n2-双(4-羟基-2,6-二乙基苯基)草酰胺、n1-(4-羟基-2,6-二乙基苯基)-n2-(吡啶-2-基甲基)草酰胺、n1-(4-羟基-2,6-二甲基苯基)-n2-(2-呋喃甲基)草酰胺、n1-(2,6-二甲基苯基)-n2-(吡啶-2-基甲基)草酰胺、n1-(2,6-二甲基苯基)-n2-(苯基甲基)草酰胺、n1,n2-二(2-苯乙基)草酰二胺、n1,n2-双(2,4,6-三甲氧基苯基)草酰胺、n1-(2,4,6-三甲氧基苯基)-n2-(苯基甲基)草酰胺、n1,n2-双(2,4-二甲氧基苯基甲基)草酰胺、n1,n2-双(2,3,4-三甲氧基苯基甲基)草酰胺、n1,n2-双苯基草酰胺、n1-(9-氨基蒽)-n2-(2-甲基吡啶)草酰胺、n1,n2-二(呋喃-2-基甲基)草酰胺、n1,n2-双(2-噻吩甲基)-乙二酰胺,n1-(2-苯基苯基)-n2-苄基草酰胺、n1-(2-呋喃甲基)-n2-(2-甲基-1-萘基)草酰胺、n1-(2-吡啶甲基)-n2-(2-甲基-1-萘基)草酰胺、n1,n2-双(1-萘甲基)-乙二酰胺、n1-(2-甲基-1-萘基)-n2-(苯基甲基)-乙二酰胺,或其组合。
20、在另一优选例中,所述配体选自下组:n1-(2,6-二甲基苯基)-n2-(吡啶-2-基甲基)草酰胺、n1-(2,4,6-三甲氧基苯基)-n2-(苯基甲基)草酰胺,或其组合。
21、在另一优选例中,反应温度为80-160℃;较佳为90-120℃。
22、在另一优选例中,所述的金属氰化物与式i化合物的摩尔比为1-15;较佳为1-8;更佳为1-3。
23、在另一优选例中,所述的金属氰化物与式i化合物的摩尔比为2.22。
24、在另一优选例中,所述的反应还具备下述一个或多个特征:
25、(a)所述的铜盐与式i化合物的摩尔比为0.01-1,较佳地为0.02-0.5;
26、(b)所述的配体与式i化合物的摩尔比为0.01-1,较佳地为0.02-0.5;
27、(c)所述的惰性溶剂与式i化合物的摩尔比为1-20;较佳地为5-12;
28、(d)所述的惰性溶剂选自下组:水、c2-c8醚类溶剂、酰胺类溶剂、砜类溶剂、c1-c8醇类溶剂、c2-c8酮类溶剂、c1-c6腈类溶剂,或其组合;
29、(e)反应时间为5-24小时,较优为10-20小时。
30、在另一优选例中,所述的铜盐与式i化合物的摩尔比为0.02-0.05。
31、在另一优选例中,所述的配体的用量为式i化合物的0.02-0.05。
32、在另一优选例中,所述的惰性溶剂与式i化合物的摩尔比为6-10。
33、在另一优选例中,所述的c2-c8醚类溶剂选自下组:四氢呋喃、二氧六环、甲基叔丁基醚、2-甲基四氢呋喃,乙二醇二甲醚、乙二醇二乙醚,或其组合。
34、在另一优选例中,所述的c2-c8酮类溶剂选自下组:丙酮、2-丁酮、甲基异丙基酮、n-甲基吡咯烷酮,或其组合。
35、在另一优选例中,所述的c1-c8醇类溶剂选自下组:甲醇、乙醇、正丙醇、异丙醇、正丁醇、叔丁醇,或其组合。
36、在另一优选例中,所述的酰胺类溶剂选自下组:n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dma),或其组合。
37、在另一优选例中,所述的砜类溶剂选自下组:二甲基亚砜(dmso)、环丁砜,或其组合。
38、在另一优选例中,所述的c1-c6腈类溶剂为乙腈。
39、在另一优选例中,所述的惰性溶剂选自下组:n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dma)、二甲基亚砜(dmso)、n-甲基吡咯烷酮、环丁砜、乙腈,或其组合。
40、在另一优选例中,所述的反应还包括纯化步骤:反应结束后,过滤,用第一溶剂萃取滤液,浓缩后,即得纯化的式ii所示的化合物。
41、在另一优选例中,所述的第一溶剂选自下组:正庚烷、甲苯、乙酸乙酯、乙酸异丙酯、甲基叔丁基醚,或其组合;较佳地为乙酸乙酯。
42、在本发明的第二方面,提供了一种式iii所示的取代1,2,4-噻二唑5-羧酸衍生物制备方法,包括:
43、
44、(i)用本发明第一方面所述的式ii所示化合物的制备方法,得到式ii化合物;
45、(ii)所述式ii所示化合物与碱发生水解反应,得到式iii所示的取代1,2,4-噻二唑5-羧酸衍生物。
46、在另一优选例中,所述的碱选自下组:氢氧化钠、氢氧化钾、氢氧化锂、氢氧化钙,或其组合;较佳地为氢氧化钠。
47、在另一优选例中,所述的水解反应结束后,用酸调节ph至4-6,降温过滤得到纯化的式iii所示化合物。
48、在另一优选例中,所述酸选自h2so4和hcl;较佳地为1n盐酸。
49、在另一优选例中,所述水解反应的反应溶剂选自下组:水、c1-c6醇类溶剂、c2-c6醚类溶剂,或其组合。
50、在另一优选例中,所述水解反应的反应溶剂选自下组:水、甲醇、乙醇、异丙醇、四氢呋喃、二氧六环,或其组合;较佳地为乙醇。
51、在另一优选例中,所述的碱与式ii化合物的摩尔比为1-10;较佳地为1-2。
52、在另一优选例中,所述的水解反应的温度为10-80℃,较佳地为30-40℃。
53、在另一优选例中,所述的水解反应的时间为10-20h;较佳地为14-18h。
54、在本发明的第三方面,提供了一种式iv所示化合物的制备方法,包括:
55、
56、(a)用本发明第二方面所述的制备方法,得到式iii化合物;
57、(b)在缩合剂的存在下,所述的式iii化合物发生缩合反应,用水合肼淬灭反应,纯化后,得到式iv所示化合物。
58、在另一优选例中,所述的缩合剂选自下组:二氯亚砜、草酰氯、cdi、edci、hatu、t3p,或其组合;较佳地为二氯亚砜。
59、在另一优选例中,所述的缩合反应的溶剂选自下组:二氯甲烷、二氯乙烷、甲苯、乙腈、四氢呋喃、乙酸乙酯、乙酸异丙酯,或其组合;较佳地为二氯甲烷。
60、在另一优选例中,所述的缩合剂与式iii所示化合物的摩尔比为1.0-5.0,较佳地为1.0-2。
61、在另一优选例中,所述的水合肼与式iii化合物的摩尔比为1.0-8.0;较佳地为2.0-3.0。
62、在另一优选例中,所述的缩合反应的温度为0-10℃,较佳地为0-5℃。
63、在本发明的第四方面,提供了一种式iv所示化合物的用途,用于制备非唑尼坦(fezolinetant)。
64、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
65、本现有技术相比,本发明具有以下优点:
66、1.本发明的方法以铜盐和配体作为催化体系,催化体系价格低廉、催化效率高。
67、2.本发明的方法操作工艺简单、成本低廉、产物易于纯化、收率高,适合工业化生产。
本文地址:https://www.jishuxx.com/zhuanli/20240914/293770.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表