一种用于子痫前期多器官损伤评价的串联类器官芯片系统的制作方法
- 国知局
- 2024-09-14 14:23:07
本发明属于生物微流控和类器官,更具体地,涉及一种用于子痫前期多器官损伤评价的串联类器官芯片系统。
背景技术:
1、子痫前期是一种以妊娠20周后以新发高血压、蛋白尿为主要特征的妊娠特有疾病,表现为孕产妇多脏器和系统损害,严重影响母儿健康。子痫前期发病率约4%~8%,每年至少造成42,000名孕产妇死亡,是仅次于产后出血的孕产妇第二大死亡原因;此外,子痫前期孕妇及子代远期罹患心血管疾病及代谢性疾病的风险明显增高,已成为涉及“两代人”健康的重要公共卫生问题。子痫前期病因复杂,分子机制不明,尚缺乏有效的预防和治疗策略。
2、子痫前期发病经历“两阶段”过程:第一阶段为临床前期,环境与遗传因素导致滋养细胞侵袭不足、胎盘浅着床,导致胎盘缺血、缺氧,为晚孕期子痫前期发病提供了解剖病理基础。第二阶段为胎盘源性异常因子释放进入母体血液循环,激活系统性炎症反应,导致包括肝脏、肾脏、血管在内的多脏器组织损害,最终引起子痫前期。然而,目前胎盘功能调节机制及胎盘与多器官交互的分子关联还远未阐明,是妊娠疾病研究中最为薄弱的环节,也是制定基于“病因机制”的重大妊娠疾病精准干预策略的关键障碍。
3、造成目前子痫前期病因机制研究迟滞的原因是多方面的。瓶颈因素有:①由于受到伦理学的限制,无法在体研究人类子痫前期胎盘与外周靶器官的交互;②子痫前期是人类妊娠特有疾病,人类胎盘结构、形成机制及妊娠调节机制与模式动物存在极大差异,难以构建恰当的动物模型;③胎盘与外周器官相互所致的多器官损伤是子痫前期发病的最终病理生理结局,然而这种交互作用复杂,简单的二维细胞培养或三维细胞类型的组织团难以模拟。所以,构建人源细胞为基础,以胎盘为中心的体外多器官交互模型是研究子痫前期发病机制的迫切需求。
4、理想的子痫前期模型,应既能体现人类早孕期子痫前期胎盘功能障碍的解剖病理基础,又能体现中晚孕期母体血管、肝脏及肾脏等多脏器组织功能紊乱的病理生理过程。本专利建立以人源细胞为基础的“胎盘-肝脏-肾脏-血管”类器官串联芯片系统,可仿生化人子痫前期发生发展,进行连续、动态、整体的胎盘功能及相关多器官损伤评价。这将是子痫前期发病机制研究的重要跨越,同时对减少实验动物使用数量,提高实验动物福利水平具有重要意义。
5、胎盘类器官是类器官技术在胎盘领域的应用。目前已有在体外成功构建人胎盘类器官方案,主要参考2018年margheritay.turco等在nature发表的trophoblastorganoidsasamodelformaternal–fetalinteractionsduringhuman placentation文章。其主要方法步骤包括:获得胎盘组织样本→消化洗涤收集提取获得胎盘干细胞→培养获得胎盘类器官→类器官的培养与维持。但目前构建的类器官到胎盘疾病研究应用仍具有较大差距,主要在于其无血管网络且无法与外周器官组织形成交互。妊娠相关疾病具有复杂的病理生理机制,主要是胎盘与母体外周器官相互作用的结果,单一胎盘类器官的培养在妊娠期相关疾病机制研究及药物筛选中的应用价值非常有限。
6、微生理系统(microphysiologysystems)是通过基于微流控技术整合多个类器官所形成的多器官芯片(multiorgan-on-a-chip)。多器官芯片能够在体外模拟多个器官之间的交互作用,这种系统性的跨器官交互是研究子痫前期病理生理机制的关键。例如,2021年中国科学院大连化学物理研究所开发了一种微流控类器官系统,重现人类肝脏-胰岛互作(论文题目microengineeredmulti-organoidsystemfromhipscstorecapitulatehumanliver-isletaxisinnormaland type2diabetes)。但目前尚无血管化胎盘类器官-靶器官交互的多器官芯片的报道及在妊娠相关疾病中应用。
技术实现思路
1、针对上述技术及临床问题,本发明的目的在于提供一种用于子痫前期多器官损伤评价的串联类器官芯片系统,即基于微流控技术的血管化胎盘类器官-外周血管类器官-肾脏类器官-肝脏类器官串联交互系统。
2、①构建更加符合子痫前期病理生理机制的多器官损伤模型:实现胎盘与肾脏、肝脏、外周血管等多个外周靶器官的交互,更加仿生化子痫前期发病的多器官多系统损伤的特点,更加系统的研究胎源性疾病与外周靶器官的相互作用以及对机体的整体影响。
3、②提高实验动物福利水平。本发明取材于作为医疗废弃物的人工流产绒毛组织,不牵涉复杂的伦理问题,且对减少实验动物使用数量,提高动物福利有重要意义。
4、本发明提供的技术方案:
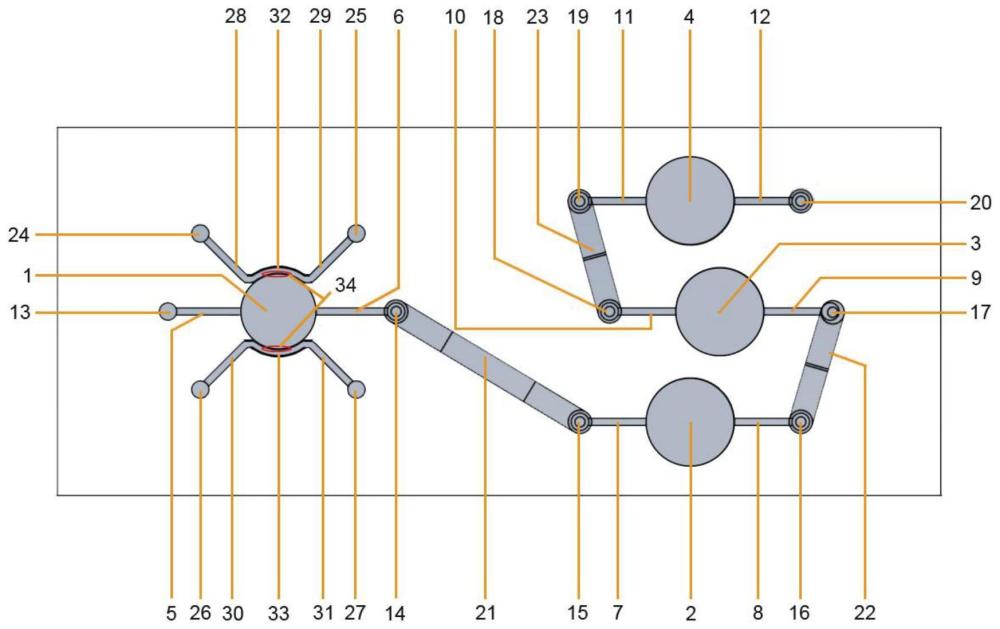
5、一种用于子痫前期多器官损伤评价的串联类器官芯片系统,其依次包括第一培养区室1、第二培养区室2、第三培养区室3和第四培养区室4;所述第一培养区室1与周围结构构成血管化胎盘类器官培养区,血管内皮细胞迁移经过微孔34与所述第一培养区室1中的类器官交互形成血管化胎盘类器官;所述第一培养区室1的一端经第一内置微管道5连接第一微流体入口13,另一端经第二内置微管道6连接第一微流体出口14;所述第二培养区室2的一端经第三内置微管道7连接第二微流体入口15,另一端经第四内置微管道8连接第二微流体出口16;所述第三培养区室3的一端经第五内置微管道9连接第三微流体入口17,另一端经第六内置微管道10连接第三微流体出口18;在所述第四培养区室的一端经第七内置微管道11连接第四微流体入口19,另一端经第八内置微管道12连接第四微流体出口20;通过第一外置微管道21连接第一微流体出口14和第二微流体入口15,通过第二外置微管道22连接第二微流体出口16和第三微流体入口17,通过第三外置微管道23连接第三微流体出口18和第四微流体入口19,以此实现所述第一培养区室1、第二培养区室2、第三培养区室3及第四培养区室4培养区室之间的串联。以达到所述各培养区室类器官之间的流体形成可控的交互。
6、进一步,所述第一外置微管道21、第二外置微管道22、第三外置微管道23为可拆解微管道,可据此按需调节流体顺序或阻断流体流通。
7、进一步,在评价子痫前期多器官损伤时,所述各培养区室之间的流体流动的方向按顺序首先依次为第一培养区室1、第二培养区室2、第三培养区室3、第四培养区室4;必要时,在达到特定的交互时间后,通过调节外置微管道(21、22、23)的连接端口,流体流动的方向按顺序调节为第一培养区室1、第四培养区室4、第三培养区室3、第二培养区室2。以实现各个器官之间的充分交互。
8、进一步,所述第一培养区室1及周围结构构成血管化胎盘类器官培养区,其包括:第一培养区室1,第一内置微管道5及连接的第一微流体入口13,第二内置微管道6及连接的第一微流体出口14,在所述第一培养区室1的两侧壁设置微孔34;所述微孔34连通第一血管内皮细胞迁移过渡区32、第二血管内皮细胞迁移过渡区33及第一培养区室1;所述第一血管内皮细胞迁移过渡区32经过第九内置微管道28和第十内置微管道29连接第五微流体入口24和第五微流体出口25;所述第二血管内皮细胞迁移过渡区33经过第十一内置微管道30和第十二内置微管道31连接第六微流体入口26和第六微流体出口27;所述第五微流体入口24和第六微流体入口26同时用作内皮细胞种植培养;使用时,血管内皮细胞迁移经过所述微孔34与所述第一培养区室1中的类器官交互形成血管化类器官。
9、进一步,所述微孔34为类椎体状。
10、进一步,所述微孔34为密集微孔。
11、进一步,通过在特定的培养时间,控制6对微流体出入口(13和14、15和16、17和18、19和20、24和25、26和27)微流体速度及流量,实现对胎盘类器官血管化及各类器官生长的精确控制。
12、进一步,所述第二培养区室2、第三培养区室3和第四培养区室4可用于培养肝脏类器官、血管类器官和肾脏类器官,对应顺序可按需调整。
13、进一步,所述第五微流体入口24和第六微流体入口26,可通过此口种植血管内皮细胞、注入血管内皮细胞培养基;所述第二微流体入口15、第三微流体入口17及第四微流体入口19,可通过此口注入类器官培养基、水凝胶及对应类器官培养的干细胞、诱导干细胞、中间培养细胞组织等。
14、进一步,在无需交互的时间段即类器官单独培养时,所述第一微流体入口13、第一微流体出口14、第二微流体入口15、第二微流体出口16、第三微流体入口17,第三微流体出口18、第四微流体入口19、第四微流体出口20、第五微流体入口24、第五微流体出口25、第六微流体入口26、第六微流体出口27均通过外接管道与微流泵相连;相应类器官培养基从微流体入口流动至对应编号的微流体出口(如流体从第一微流体入口13流动至第一微流体出口14);
15、根据本发明所述的一种用于子痫前期多器官损伤评价的串联类器官芯片系统,所述胎盘类器官包括人类早孕绒毛滋养干细胞。
16、根据本发明所述的一种用于子痫前期多器官损伤评价的串联类器官芯片系统,所述血管、肝脏及肾脏类器官包括人诱导多能干细胞(hipsc)。
17、根据本发明所述的一种用于子痫前期多器官损伤评价的串联类器官芯片系统,所述血管内皮细胞包括人类脐静脉内皮细胞(huvec)。
18、根据本发明所述的一种用于子痫前期多器官损伤评价的串联类器官芯片系统,所述微流控芯片的材料包括聚二甲基硅氧烷(pdms),利于活细胞成像。
19、根据本发明所述的一种用于子痫前期多器官损伤评价的串联类器官芯片系统,所述流体包括水凝胶、细胞培养基。
20、本发明所述一种用于子痫前期多器官损伤评价的串联类器官芯片系统是由聚二甲基硅氧烷(pdms)材料制成的一体型芯片。
21、本发明提供一种基于微流控技术的子痫前期多器官损伤评价模型芯片,包括:第一培养区室1、第二培养区室2、第三培养区室3和第四培养区室4;所述第一培养区室1与周围结构构成血管化胎盘类器官培养区,血管内皮细胞迁移经过微孔34与所述第一培养区室1中的类器官交互形成血管化胎盘类器官;所述第一培养区室1的一端经第一内置微管道5连接第一微流体入口13,另一端经第二内置微管道6连接第一微流体出口14;所述第二培养区室2的一端经第三内置微管道7连接第二微流体入口15,另一端经第四内置微管道8连接第二微流体出口16;所述第三培养区室3的一端经第五内置微管道9连接第三微流体入口17,另一端经第六内置微管道10连接第三微流体出口18;在所述第四培养区室的一端经第七内置微管道11连接第四微流体入口19,另一端经第八内置微管道12连接第四微流体出口20;通过第一外置微管道21连接第一微流体出口14和第二微流体入口15,通过第二外置微管道22连接第二微流体出口16和第三微流体入口17,通过第三外置微管道23连接第三微流体出口18和第四微流体入口19,以此实现所述第一培养区室1、第二培养区室2、第三培养区室3及第四培养区室4培养区室之间的串联。以达到所述各培养区室类器官之间的流体形成可控的交互。
22、本发明有益技术效果:
23、本发明以串联的形式使胎盘类器官、血管类器官、肾脏类器官、肝脏类器官形成一个微生理系统,实现了子痫前期多器官多系统损伤、胎盘-肾脏-肝脏-外周血管交互的体外建模,可用于研究子痫前期多器官多系统损伤机制。
24、本发明既能用来研究人类早孕期子痫前期胎盘功能障碍的分子机制,又能体现中晚孕期母体肾脏、肝脏、血管内皮等靶器官损害的病理生理过程。
25、本发明较动物模型更能体现人子痫前期的发病过程,有助于减少动物模型的使用,提高实验动物福利。
26、本发明通过设计外置微管道,调节流体方向,实现各个类器官可控的培养及之间的交互。
本文地址:https://www.jishuxx.com/zhuanli/20240914/293745.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。