一种基于鼠李糖乳杆菌来源的纳米颗粒的药物分析系统的制作方法
- 国知局
- 2024-10-09 16:38:53
本发明涉及药物分析领域,具体涉及一种基于鼠李糖乳杆菌来源的纳米颗粒的药物分析系统。
背景技术:
1、类器官3d培养是一种新兴的用来研究组织成体干细胞生长、分化、器官形成的体外研究系统。肠道类器官的3d培养是将分离的肠道隐窝或干细胞植入含有多种生长因子的基质胶中,在基质3d支撑下生成具有肠道上皮样结构的微型空心球体,这些球体被称为肠道类器官。此外,还可以利用肿瘤干细胞或肿瘤前体细胞得到肠肿瘤类器官。这些肠道类器官被广泛应用于炎症性肠病、肠道损伤再生、肠癌等多种肠道疾病的研究。
2、目前许多用作细胞系的细胞为永生化细胞,即在理化刺激、基因突变、病毒感染等外界刺激下,可以在体外无限增殖的不衰老细胞株。因此,虽然二维培养的细胞系具有可操作性高、培养周期短和高通量等优点,但是当其应用至药物筛选时,某个具体细胞系对某种药物的敏感性,难以代表其他细胞系,更是难以代表人体组织。此外,二维培养的细胞系还无法模拟正常组织和肿瘤组织的三维生长环境,因此难以模拟药物的浸润过程,这也说明基于二维培养的细胞系产生的药物筛选结果参考价值较低。
3、与传统的二维细胞培养相比,类器官来源于机体自身组织或干细胞,是通过体外3d培养形成的具有原始组织及器官的三维(3d)结构模型,在组织结构、细胞类型和功能等方面与来源组织高度相似,即类器官可以表现出接近生理状态的细胞组成和生理功能。因此,类器官在药物筛选中展现出特有的优势,能够更加准确地评价药物在体内的作用效果以及药物的毒副作用,从而提高药物开发的效率和药物临床试验的成功率。
4、尽管类器官在药物筛选方面展现了特有优势,但其发展依然面临巨大的挑战,例如类器官的稳定性和准确性存在不可控的问题。
技术实现思路
1、第一方面,本发明提供了一种基于鼠李糖乳杆菌来源的纳米颗粒的药物分析系统,其特征在于,所述系统包括:
2、a)鼠李糖乳杆菌来源的纳米颗粒;
3、b)构建的肠道类器官,所述肠道类器官包括正常肠类器官;
4、c)铂类药物;
5、其中所述鼠李糖乳杆菌来源的纳米颗粒的浓度包括5 – 20 μg/ml,所述构建的肠道类器官为类器官细胞悬液的形式,所述类器官细胞悬液的细胞密度包括1 - 5×104个肠道类器官细胞/ml;所述鼠李糖乳杆菌来源的纳米颗粒先于或与所述铂类药物同时加入到所述构建的肠道类器官中。
6、在一些实施例中,所述肠道类器官的传代代次为p6代至p15代。
7、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒的平均粒径为50-120 nm。
8、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒与所述肠道类器官的比例为1 – 5 μg/100个肠道类器官细胞。
9、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒的浓度为10 μg/ml。
10、在一些实施例中,所述铂类药物的浓度包括0.01 – 1000 μm。
11、在一些实施例中,所述铂类药物包括顺铂或奥沙利铂。
12、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒通过以下方法制备得到:
13、s101 当鼠李糖乳杆菌培养悬液的菌种密度达到2×109 cfu/ml时,将所述培养悬液在2000 g下离心10~15分钟,得到上清液a;
14、s102 将所述上清液a在5000 g下离心20~30分钟,得到上清液b;
15、s103 将所述上清液b在10000 g下离心30~40分钟,得到上清液c;
16、s104 将所述上清液c使用0.45 μm过滤器过滤,将过滤后的所述上清液c在10000~150000 g下超速离心70分钟,得到沉淀d;
17、s105 将所述沉淀d重悬并使用0.22 μm过滤器过滤,得到滤液e,将所述滤液e在10000~150000 g下超速离心70~120分钟,得到沉淀f,即所述鼠李糖乳杆菌来源的纳米颗粒。
18、在一些实施例中,所述类器官细胞悬液通过将所述构建的肠道类器官进行消化后获得。
19、在一些实施例中,所述铂类药物的浓度包括0.01 – 1 μm。
20、在一些实施例中,所述正常肠类器官源自健康肠组织中的肠道干细胞或隐窝。
21、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒、所述铂类药物和所述构建的肠道类器官至少共培养24小时。
22、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒先于所述铂类药物6-8小时加入到所述构建的肠道类器官中。
23、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒、所述铂类药物和所述构建的肠道类器官共培养72-120小时。
24、第二方面,本发明提供了一种鼠李糖乳杆菌来源的纳米颗粒在制备药物分析系统中的用途,所述系统包括:
25、a)鼠李糖乳杆菌来源的纳米颗粒;
26、b)构建的肠道类器官,所述肠道类器官包括正常肠类器官;
27、c)铂类药物;
28、其中所述鼠李糖乳杆菌来源的纳米颗粒的浓度包括5 – 20 μg/ml,所述构建的肠道类器官为类器官细胞悬液的形式,所述类器官细胞悬液的细胞密度包括1 - 5×104个肠道类器官细胞/ml;所述鼠李糖乳杆菌来源的纳米颗粒先于或与所述铂类药物同时加入到所述构建的肠道类器官中。
29、在一些实施例中,所述肠道类器官的传代代次为p6代至p15代。
30、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒的平均粒径为50-120 nm。
31、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒与所述肠道类器官的比例为1 – 5 μg/100个肠道类器官细胞。
32、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒的浓度为10 μg/ml。
33、在一些实施例中,所述铂类药物的浓度包括0.01 – 1000 μm。
34、在一些实施例中,所述铂类药物包括顺铂或奥沙利铂。
35、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒通过以下方法制备得到:
36、s101 当鼠李糖乳杆菌培养悬液的菌种密度达到2×109 cfu/ml时,将所述培养悬液在2000 g下离心10~15分钟,得到上清液a;
37、s102 将所述上清液a在5000 g下离心20~30分钟,得到上清液b;
38、s103 将所述上清液b在10000 g下离心30~40分钟,得到上清液c;
39、s104 将所述上清液c使用0.45 μm过滤器过滤,将过滤后的所述上清液c在10000~150000 g下超速离心70分钟,得到沉淀d;
40、s105 将所述沉淀d重悬并使用0.22 μm过滤器过滤,得到滤液e,将所述滤液e在10000~150000 g下超速离心70~120分钟,得到沉淀f,即所述鼠李糖乳杆菌来源的纳米颗粒。
41、在一些实施例中,所述类器官细胞悬液通过将所述构建的肠道类器官进行消化后获得。
42、在一些实施例中,所述铂类药物的浓度包括0.01 – 1 μm。
43、在一些实施例中,所述正常肠类器官源自健康肠组织中的肠道干细胞或隐窝。
44、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒、所述铂类药物和所述构建的肠道类器官至少共培养24小时。
45、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒先于所述铂类药物6-8小时加入到所述构建的肠道类器官中。
46、在一些实施例中,所述鼠李糖乳杆菌来源的纳米颗粒、所述铂类药物和所述构建的肠道类器官共培养72-120小时。
47、与现有技术相比,本发明的有益效果至少包括以下方面:
48、虽然现有技术在利用类器官进行药物筛选方面取得了一定的进展,但其仍面临类器官的稳定性和准确性的不可控等问题。本发明实验表明,上述问题的原因可能出自类器官容易受到传代代次的局限而对药物筛选的结果造成不利影响上。虽然选择低传代代次(例如原代至p5代次)的类器官能够一定程度克服这个问题,但这不可避免地造成了类器官资源的极大浪费并增加了构建类器官的成本,并与利用类器官进行高通量药物筛选的实际严重背离。
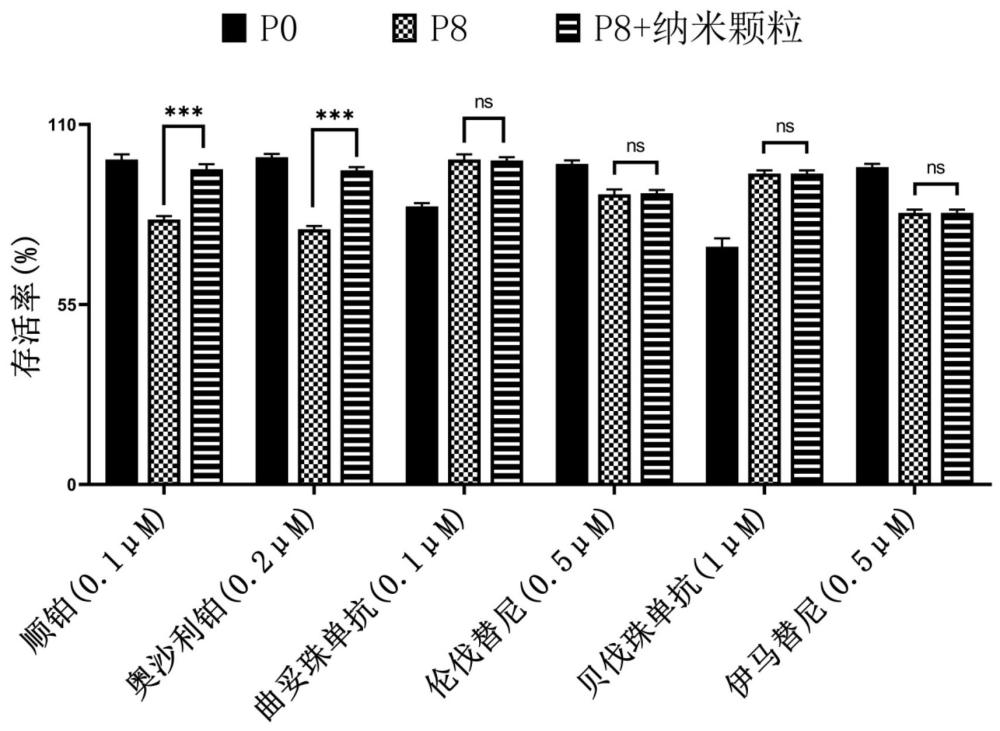
49、基于类器官的药物筛选体系的稳定性和准确性实际上非常重要,例如当利用同一个体来源的类器官进行治疗药物的高通量筛选时,需要较多数量的类器官细胞,此时不可避免地需要对类器官进行多次传代。本发明发现,随着正常肠道类器官的传代代次增加,正常肠道类器官对某类药物(例如铂类药物)反而会展现出低传代代次的正常肠道类器官并不会显示的毒性,因此该药物很可能被筛选掉。也就是说,这种高传代代次类器官所带来的假阳性结果可能使得本潜在地适合该个体的治疗药物被排除,因此对个体化给药的实现非常不利。另外,如果用不同来源的正常肠道类器官对同一种药物的毒性进行评估,结合类器官的资源有限的现实情况,可能无法使用相同代次且低代次的类器官进行药物筛选。因此,非常明显的是,高传代代次的类器官可能会展现出对低浓度(例如0.01-1 μm)的某类药物(例如铂类药物)的毒性的放大。如果所使用的高传代代次的类器官所占比例较大,基于其很可能得出该药物对大部分类器官均有毒性的结论,进而可能将有治疗前景的药物排除。
50、在本发明提供的药物分析系统中,特定浓度的鼠李糖乳杆菌来源的纳米颗粒的加入(例如5 – 20 μg/ml),恰好能够将受到传代代次影响而对铂类药物的毒性造成放大的正常肠道类器官,恢复至低传代代次(例如原代至p5代次)的正常肠道类器官的水平,进而更真实地还原肠道类器官对药物的反应,使得期望分析的药物在患者体内的实际疗效能够被更准确地反映出,并使得传代代次为p6及以上的肠道类器官能够适用于铂类药物的药物筛选。而过高浓度的鼠李糖乳杆菌来源的纳米颗粒反而会给药物分析系统中的肠道类器官带来假阴性的问题(即并非低传代代次的肠道类器官的水平),其使得期望分析的药物所呈现的药物毒性同样失真,进而无法准确地反映出期望分析的药物在患者体内的实际疗效。
51、在本发明提供的药物分析系统中,通过控制鼠李糖乳杆菌来源的纳米颗粒与肠道类器官细胞的比例,使得鼠李糖乳杆菌来源的纳米颗粒不会促进肠道类器官细胞增殖的同时,既不会给肠道类器官带来额外的细胞毒性,也不会过度影响期望分析的药物在本发明提供的药物分析系统所呈现的细胞毒性,保证了药物分析系统的可控性和准确性。因此,可以利用本发明提供的药物分析系统,根据肠道类器官细胞的细胞活力来对期望分析的药物的肠道毒性进行准确地评估。此外,经测试,上述比例适合于不同浓度的铂类药物(例如0.01 – 1000 μm)和不同传代代次的肠道类器官的测试,满足实际药物筛选的需求,且不会出现假阴性和假阳性的问题。
52、综上所述,与常规的药物筛选体系相比,本发明提供的药物分析系统的可控性和准确性明显提升,并拓展了肠道类器官在药物评估的应用前景,且能够更好地模拟患者肠道器官的动态环境,为早期预测药物在体内环境中生理反应和客观指导患者个性化用药方案提供了帮助。
53、如本文所使用,“纳米颗粒”是指直径在1到150纳米之间的物质粒子。如本文所使用,“鼠李糖乳杆菌来源的纳米颗粒”是指鼠李糖乳杆菌培养上清液来源的的纳米级细胞外脂质双囊泡。在本发明中,鼠李糖乳杆菌来源的纳米颗粒与鼠李糖乳杆菌外泌体(简称为lgg外泌体或外泌体)具有相同含义,除非另有说明。
本文地址:https://www.jishuxx.com/zhuanli/20240929/313652.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表