一种共轭烯酮不对称氢化构建手性醇的方法与流程
- 国知局
- 2024-10-15 09:28:38
本发明涉及化学合成领域,具体涉及一种共轭烯酮不对称氢化构建手性醇的方法,及该方法制备得到的手性醇。
背景技术:
1、手性醇是一种广泛存在于药品、天然产物、精细化学品、农用化学品中的官能团结构,例如,(1r)-2-环己烯-1-醇在专利wo2008100453 a1中作为中间体参与合成拟糖体的合成,还作为中间体参与了专利wo2015138500 a1磺酰胺类抗癌药物的制备,cas号为18890-22-7的(1r)-3-methyl-2-cyclohexen-1-ol则在《stereoselective synthesis of thecde ring system of antitumor saponin scillascilloside e-1》可作为抗肿瘤皂苷scillascilloside e-1合成中间体;同时抗糖尿病药(anti-diabetic agent)、大麻素受体抑制剂(cannabinoid receptor)、单胺氧化酶抑制剂(mao-b inhibitor)、g蛋白偶联受体调制器(gpr120 modulator)、肾上腺素抗体(beta-3adrenoceptor)、和大麻素受体拮抗剂(cannabinoid receptor type 2)等均含有手性醇结构。
2、由于手性醇在制药等领域具有巨大的工业价值,人们对其合成方法进行了深入的研究,开发出了很多合成路线,但是目前许多手性醇制备过程中,容易对共轭烯酮进行全还原,无法得到目标物质,例如《ir/f-ampha complex catalyzed asymmetric sequentialhydrogenation of enones:a general access to chiral alcohols with twocontiguous chiral centers》doi:10.1039/d1sc05963g中提到共轭烯体系在加氢过程中的全还原行为。
3、2012年,karl r.沃格特1报道了铜催化α,β-不饱和环酮1,2还原的工作,获得了55%的ee。
4、
5、2018年,姚英明研究了将稀土金属镱与苯氧基功能化的手性脯氨酸醇结合还原α,β-不饱和酮,得到光学活性醇,得到41%的ee。
6、
7、可以看出,以往对环内偶联烯丙基酮的研究报道较少,而1,2-还原的结果也不太令人满意。
技术实现思路
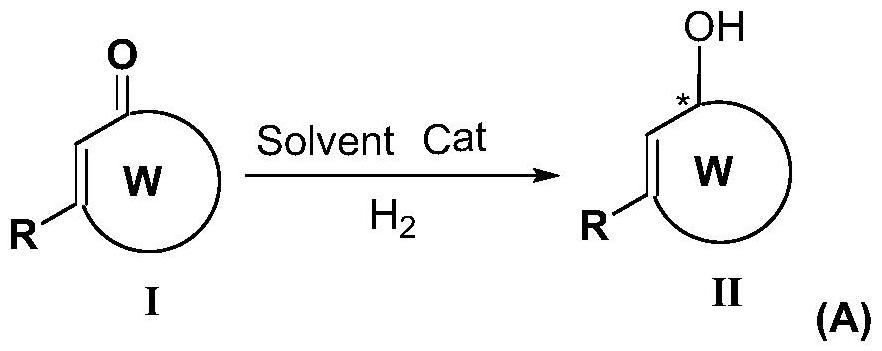
1、针对于现有技术中存在的共轭烯酮合成手性醇技术路径较少问题,共轭烯在加氢构建手性醇过程中容易发生全还原的问题,本发明第一方面提供了一种共轭烯酮不对称氢化构建手性醇的方法,如反应式(a):
2、
3、所述r选自取代或未取代的单环碳环基、取代或未取代的稠环碳环基、取代或未取代的螺环基、取代或未取代的桥环、取代或未取代的单环杂环基、取代或未取代的稠环杂环基、取代或未取代的单环芳基、取代或未取代的支链烷基、取代或未取代的直链烷基;
4、所述催化剂cat由金属铱络合物与氮磷手性配体f-amphol制备得到,所述氮磷手性配体f-amphol具有通式(ⅲ)所示的结构,
5、
6、其中所述r1=3,5-(t-bu)2c6h3;
7、所述环w选自不饱和单环碳环基、不饱和单环杂环基;
8、以上所述*表示碳手性中心,所述多个碳手性中心各自独立的为r构型或s构型。
9、在一些第一方面的具体实施例中,所述r为杂环稠环基,所述r包括两个或更多个第一环彼此稠合的稠环基团;所述第一环选自吡咯基团、呋喃基团、噻吩基团、吡咯基团、噻咯基团、茚基团、苯并呋喃基团、苯并噻吩基团、吲哚基团、苯并噻咯基团。
10、在一些第一方面的具体实施例中,所述r为杂环稠环基,所述r包括至少一个第一环与至少一个第二环稠合的稠环基团;所述第一环选自吡咯基团、呋喃基团、噻吩基团、吡咯基团、噻咯基团、茚基团、苯并呋喃基团、苯并噻吩基团、吲哚基团、苯并噻咯基团,所述第二环选自环己烷基团、环戊烷基团、单环芳基。
11、在一些第一方面的具体实施例中,所述r为稠环碳环基,所述稠环碳环基为两个或更多个第二环彼此稠合的稠环基团;所述第二环选自环己烷基团、环戊烷基团、单环芳基。
12、在一些第一方面的具体实施例中,所述环w选自含有一个或多个碳碳双键的3~10元杂环基。
13、在一些第一方面的具体实施例中,所述环w选自含有一个碳碳双键及多个碳碳三键的3~10元杂环基。
14、在一些第一方面的具体实施例中,所述环w选自含有一个或多个碳碳双键的c3~c10碳环基。
15、在一些第一方面的具体实施例中,所述环w选自含有一个碳碳双键及多个碳碳三键的c3~c10碳环基。
16、在一些第一方面的具体实施例中,所述杂环基杂有1~3个杂原子,所述杂原子选自n、o、s。
17、在一些第一方面的具体实施例中,所述r上的h任意的被一个或多个ra取代,所述多个ra各自选自硝基、烷基、卤素、卤代烷基或烷氧基。
18、在一些第一方面的具体实施例中,所述ra选自c1~c6取代或未取代的直链烷基,或,所述ra选自c1~c6取代或未取代的支链烷基,或,所述ra选自c1~c6卤代直链烷基,或,所述ra选自c1~c6卤代支链烷基,或,所述ra选自c1~c6烷氧基。
19、在另一些第一方面的具体实施例中,所述r如:
20、
21、所述环a选自苯基、萘基、环己烷基或喹啉基、呋喃基、噻吩基、吡咯基;
22、所述n选自1~9任一正整数,所述多个ra各自独立的选自f、cl、br、甲氧基、甲基、乙基、-cf3或硝基。
23、在一些第一方面的具体实施例中,所述金属铱络合物包括[ir(cod)cl]2、[ir(cod)2]barf4、[ir(nbd)2]bf4、[ir(nbd)2]x;[ir(nbd)cl]2;ir(acac)(co)2;[ir(cod)cl]2;ir(ethylene)2(acac);[ir(ethylene)2cl]2;[ir(cod)2]x,
24、所述x为负阴离子,如cl-,br-,i-,bf4-,clo4-,sbf6-,pf6-,tfo-,b(ar)4-。
25、在一些第一方面的具体实施例中,所述金属铱络合物与所述氮磷手性配体在溶剂solvent中室温反应0.5小时~12小时制备得到金属催化剂。
26、在一些第一方面的具体实施例中,所述金属铱络合物与所述氮磷手性配体的摩尔比为1.0:1.05。
27、在一些第一方面的具体实施例中,所述溶剂solvent为甲醇、乙醇、异丙醇、叔丁醇、二氯甲烷、甲苯、1,2-二氯乙烷、氯仿、四氯化碳、四氢呋喃、1,4-二氧六环、正己烷或环己烷,或其组合。
28、在一些第一方面的具体实施例中,所述碱为碳酸钾、碳酸铯、碳酸钠、碳酸氢钾、磷酸二氢钾、三乙胺、氢氧化钠、氢氧化钾、甲醇钠、甲醇钾、叔丁醇钾或叔丁醇钠,或其组合。
29、在一些第一方面的具体实施例中,所述不对称还原的反应温度为0℃~50℃,在一些第一方面的优选实施例中,所述不对称还原的反应温度为15℃以下。
30、在一些第一方面的具体实施例中,所述不对称还原的反应时间为1h~48h,在一些第一方面的优选实施例中,所述不对称还原的反应时间为24h。
31、在一些第一方面的具体实施例中,所述不对称还原在45~55大气压的氢气氛围中进行。
32、在本发明中:
33、“mol%”表示的是该物质相对于共轭烯酮的摩尔百分比。
34、“s/c”表示的是底物和催化剂用量比。
35、“室温”在一些实施例中代表40℃~10℃,在一些实施例中代表35℃~15℃,在一些实施例中代表30℃~20℃,在一些实施例中代表25℃~20℃,在另一些实施例中代表25℃。
36、本发明化合物3b与4b羟基上的h是活泼氢。
37、本发明中催化剂f-ampha的结构如式:摘自doi:10.1039/d1sc05963g。
38、本发明中催化剂f-amphol的结构如式:其中所述r1=3,5-(t-bu)2c6h3;
39、本发明中dmf为n,n-二甲基甲酰胺,thf为四氢呋喃,hexane为正己烷,toluene为甲苯。
40、本发明的优点在于:本发明采用不同分子结构的共轭烯酮,作为底物进行氢化构建手性醇,共轭环特定位置的氢被不同取代基取代的情况下,均可获得较好的还原效果,在还原过程中共轭环上双键不受影响,方法用到的催化剂制备方式简单、性能稳定,在较高底物/催化剂的情况下依旧能获得良好的手性选择效果和转化率。
本文地址:https://www.jishuxx.com/zhuanli/20241015/314257.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表