作为症状前神经变性疾患监测诊断的来自无细胞DNA的神经元甲基化标记的制作方法
- 国知局
- 2024-11-21 11:54:40
本文公开了一种设计用于诊断症状前神经变性疾患的基于血液的两部分诊断工具。第一部分由设计用于扩增和测序无细胞dna的预定区域的测定法组成。第二部分由python来源的管道组成,所述管道分析甲基化特征以鉴定神经元来源的dna并提供对症状前神经变性疾患的诊断。
背景技术:
1、目前用于诊断神经变性疾患(例如阿尔茨海默氏病和帕金森病)的标准治疗使用一系列记忆和身体测试来鉴定任何所述疾患相关症状的发作。如果鉴定出相关症状,这指示神经元细胞死亡已经进展到无法修复。目前尚无已知方法用于在症状发作之前诊断神经变性疾患。
2、研究已经取得了重大的治疗突破,其结果显示了减缓神经元细胞死亡的治疗的有希望的证据。然而,在没有症状前诊断的情况下,无法在不可修复的神经元细胞死亡之前施用治疗。
3、本公开解决了本领域的这些问题和其他问题。
技术实现思路
1、本技术大体上涉及一种可以在症状发作之前鉴定神经变性疾患的预筛查方法。所公开的方法可用于诊断症状前神经变性疾病,并与适当的治疗相结合以预防或延缓患者疾病的发作。
2、一方面,本公开提供了治疗受试者的方法,其中受试者患有神经变性疾患或处于患神经变性疾患的风险中,所述方法包括:(i)从来自受试者的血液样本获取无细胞dna;(ii)分析所述无细胞dna的甲基化模式;(iii)确定来自神经元的无细胞dna的百分比;(iv)将来自神经元的无细胞dna的百分比与对照进行比较;以及(v)当来自神经元的无细胞dna的百分比大于所述对照时,施用治疗或预防神经变性疾患的治疗剂。
3、在一些实施方案中,步骤(ii)包括分析dna的整个扩增子的甲基化模式。在一些实施方案中,整个扩增子的长度为至少约50个碱基对(bp)。在一些实施方案中,整个扩增子的长度介于约50至约500个碱基对之间。
4、在一些实施方案中,当来自神经元的无细胞dna的百分比大于约5%时,施用治疗剂。在一些实施方案中,当来自神经元的无细胞dna的百分比大于约7%时,施用治疗剂。在一些实施方案中,当来自神经元的无细胞dna的百分比大于约9%时,施用治疗剂。
5、在另一方面,本公开提供了治疗受试者的方法,其中受试者患有神经变性疾患或处于患神经变性疾患的风险中,所述方法包括:(i)从来自受试者的血液样本获取无细胞dna;(ii)分析所述无细胞dna的甲基化模式;(iii)确定来自神经元的无细胞dna的百分比;以及(iv)当来自神经元的无细胞dna的百分比大于约5%时,施用治疗或预防神经变性疾患的治疗剂。
6、在另一方面,本公开提供了分析受试者的生物样本的方法,所述方法包括:(i)从来自受试者的血液样本获取无细胞dna;(ii)分析所述无细胞dna的甲基化模式;(iii)确定来自神经元的无细胞dna的百分比;以及(iv)将来自神经元的无细胞dna的百分比与对照进行比较。
7、在另一方面,本公开提供测量受试者的神经元细胞死亡的方法,所述方法包括:(i)从来自受试者的血液样本获取无细胞dna;(ii)分析所述无细胞dna的甲基化模式;(iii)确定来自神经元的无细胞dna的百分比;(iv)将来自神经元的无细胞dna的百分比与对照进行比较。
8、在另一方面,本公开提供了选择患者用于使用治疗神经变性疾病或疾患的治疗剂进行治疗的方法,所述方法包括:(i)从来自受试者的血液样本获取无细胞dna;(ii)分析所述无细胞dna的甲基化模式;(iii)确定来自神经元的无细胞dna的百分比;以及(iv)将来自神经元的无细胞dna的百分比与对照进行比较;其中,当所述来自神经元的无细胞dna的百分比大于所述对照时,选择所述患者用于治疗。
9、在一些实施方案中,步骤(ii)包括分析dna的整个扩增子的甲基化模式。在一些实施方案中,整个扩增子的长度为至少约50个碱基对(bp)。在一些实施方案中,整个扩增子的长度介于约50至约500个碱基对之间。
10、在一些实施方案中,当来自神经元的无细胞dna的百分比大于约5%时,选择患者用于治疗。在一些实施方案中,当来自神经元的无细胞dna的百分比大于约7%时,选择患者用于治疗。在一些实施方案中,当来自神经元的无细胞dna的百分比大于约9%时,选择患者用于治疗。
11、在一些实施方案中,来自神经元的无细胞dna的百分比大于对照指示神经变性疾患或外伤性脑损伤的风险增加。
12、在另一方面,本公开提供了计算机产品,包括存储多个指令的非暂时性计算机可读介质,所述指令在被执行时控制计算机系统来分析来自受试者的生物样本以确定受试者的神经变性疾患的风险,所述生物样本包括无细胞dna,所述指令包括:(i)鉴定以高于阈值的速率在神经元中发生的第一dna甲基化模式,其中第一dna甲基化模式包括在一个或多个甲基化区域的甲基化并且任选地包括在一个或多个未甲基化区域的不甲基化;(ii)分析所述无细胞dna的第二dna甲基化模式;以及(iii)计算无细胞dna中一个或多个甲基化区域和任选地一个或多个未甲基化区域的相对丰度;以及(iv)通过将相对丰度与对照进行比较来确定受试者的神经变性疾患的风险。
13、在另一方面,本公开提供了确定神经变性疾患的潜在治疗的功效的方法,所述方法包括:(i)从多名受试者的血液样本获取无细胞dna,其中已经向受试者施用潜在治疗;(ii)分析所述无细胞dna的甲基化模式;(iii)确定来自神经元的无细胞dna的百分比;以及(iv)将所述来自神经元的无细胞dna的百分比与对照进行比较;其中当所述来自神经元的无细胞dna的百分比低于对照时,潜在治疗是有效的。
14、在一些实施方案中,重复步骤(i)-(iv)至少一次。在一些实施方案中,每周重复步骤(i)-(iv)。
15、在一些实施方案中,确定来自神经元的无细胞dna的百分比包括将无细胞dna的甲基化模式与神经元dna甲基化模式进行比较,其中神经元dna甲基化模式包括在一个或多个甲基化区域的甲基化,并且任选地包括在一个或多个未甲基化区域的不甲基化。
16、在另一方面,本公开提供了分析生物样本的计算机实施的方法,包括:(i)鉴定以高于阈值的速率在神经元中发生的第一dna甲基化模式,其中第一dna甲基化模式包括在一个或多个甲基化区域的甲基化并且任选地包括在一个或多个未甲基化区域的不甲基化;(ii)分析所述无细胞dna的第二dna甲基化模式;以及(iii)计算无细胞dna中一个或多个甲基化区域和任选地一个或多个未甲基化区域的相对丰度;以及(iv)通过将相对丰度与对照进行比较来确定受试者的神经变性疾病风险。
17、在一些实施方案中,步骤(ii)包括分析dna的整个扩增子的甲基化模式。
18、在一些实施方案中,整个扩增子的长度为至少约50个碱基对(bp)。在一些实施方案中,整个扩增子的长度介于约50至约500个碱基对之间。
19、在一些实施方案中,对照是来自未治疗受试者的血液样本中来自神经元的无细胞dna的百分比、来自治疗之前受试者的血液样本中来自神经元的无细胞dna的百分比,或者阈值。在一些实施方案中,阈值是大于约5%的来自神经元的无细胞dna的百分比。在一些实施方案中,阈值是大于约7%的来自神经元的无细胞dna的百分比。在一些实施方案中,阈值是大于约9%的来自神经元的无细胞dna的百分比。
20、在一些实施方案中,神经变性疾病选自阿尔茨海默氏病、亨廷顿氏病、帕金森病,肌萎缩侧索硬化(als)、共济失调、多发性硬化、多系统萎缩或脑震荡。
21、在一些实施方案中,神经元是运动神经元、感觉神经元、中间神经元、多巴胺能神经元、胆碱能神经元、gaba能神经元、谷氨酸能神经元或皮质神经元。在一些实施方案中,神经元来自前脑、中脑或后脑。在一些实施方案中,神经元来自额叶、颞叶、顶叶、枕叶、小脑或脑干。
22、在一些实施方案中,分析甲基化模式包括将所述无细胞dna中的5-甲基胞嘧啶转化为不同的核苷酸。在一些实施方案中,转化包括亚硫酸氢盐转化或酶转化。
23、在一些实施方案中,受试者患有轻度认知损害。在一些实施方案中,受试者的年龄超过45岁。在一些实施方案中,包括选择年龄超过45岁的受试者。在一些实施方案中,受试者没有神经变性疾患的症状。在一些实施方案中,包括选择患有轻度认知损害的受试者。
24、在另一方面,本公开提供了治疗患有轻度外伤性脑损伤的受试者的方法,包括:(i)选择处于轻度外伤性脑损伤风险中的受试者;(ii)从来自受试者的血液样本获取无细胞dna;(iii)分析所述无细胞dna的甲基化模式;(iv)确定来自神经元的无细胞dna的百分比;以及(v)将来自神经元的无细胞dna的百分比与对照进行比较;以及(vi)当来自神经元的无细胞dna的百分比大于所述对照时,对所述受试者进行轻度外伤性脑损伤治疗。
25、在一些实施方案中,治疗受试者包括施用治疗轻度外伤性脑损伤的一种或多种症状的治疗剂。在一些实施方案中,还包括在治疗后的时间点重复步骤(ii)至(v)。在一些实施方案中,当在所述时间点的来自神经元的无细胞dna的百分比小于或等于对照时,中断治疗。在一些实施方案中,当在所述时间点的来自神经元的无细胞dna的百分比大于所述对照时,继续治疗。
26、在另一方面,本公开提供了包含第一多个寡核苷酸的试剂盒,其中所述第一多个寡核苷酸中的每个寡核苷酸能够与神经元细胞中优先甲基化的区域杂交。
27、在一些实施方案中,还包括第二多个寡核苷酸,其中所述第二多个寡核苷酸中的每个寡核苷酸能够与神经元细胞中优先未甲基化的区域杂交。
28、在一些实施方案中,试剂盒用于确定神经变性疾病或疾患的潜在治疗的功效。在一些实施方案中,神经变性疾病或疾患选自阿尔茨海默氏病、亨廷顿氏病、帕金森病,肌萎缩侧索硬化(als)、共济失调、多发性硬化、多系统萎缩或脑震荡。在一些实施方案中,神经元是运动神经元、感觉神经元、中间神经元、多巴胺能神经元、胆碱能神经元、gaba能神经元、谷氨酸能神经元或皮质神经元。在一些实施方案中,神经元来自前脑、中脑或后脑。在一些实施方案中,神经元来自额叶、颞叶、顶叶、枕叶、小脑或脑干。
29、在一些实施方案中,多个寡核苷酸包括具有seq id no:3-6中任一个的核苷酸序列的一个或多个寡核苷酸。
30、在另一方面,本公开提供了检测血液样本中来自神经元的无细胞dna的方法,包括:(i)从来自人类受试者的血液样本获取无细胞dna;以及(ii)通过甲基化分析来检测血液样本中是否存在来自神经元的无细胞dna,包括对来自血液样本的无细胞dna进行dna的整个扩增子的测序。
31、在一些实施方案中,整个扩增子的长度为至少约50个碱基对(bp)。在一些实施方案中,整个扩增子的长度介于约50至约500个碱基对之间。
32、在一些实施方案中,使用包含seq id no:3-6中任一个的序列的一个或多个引物来产生所述整个扩增子。在一些实施方案中,使用靶向选自表1所列区域中的区域的一个或多个引物来产生所述整个扩增子。
33、在另一方面,本公开提供了确定扩增子的所述甲基化状态的方法,包括:(i)从来自人类受试者的血液样本获取无细胞dna;(ii)将所述无细胞dna中的5-甲基胞嘧啶转化为不同的核苷酸,从而产生转化的无细胞dna;(iii)扩增转化的无细胞dna,从而产生扩增子;以及(iv)对扩增子进行测序,其中扩增子的长度介于约50bp至约500bp之间。
34、在一些实施方案中,使用包含seq id no:3-6中任一个的序列的一个或多个引物来产生所述整个扩增子。在一些实施方案中,使用靶向选自表1所列区域中的区域的一个或多个引物来产生所述整个扩增子。
35、具体实施方式
36、在阅读本说明书之后,本领域技术人员将清楚如何在各种替代实施方案和替代应用中实施本公开。然而,本文将不描述本发明的所有各种实施方案。应理解,这里呈现的实施方案仅通过实例而非限制的方式呈现。因此,各种替代实施方案的详细描述不应被解读为限制如本文所阐述的本公开的范围或广度。
37、在公开和描述本技术之前,应理解下文描述的方面不限于特定组合物、制备此类组合物的方法或它们的用途,因为它们当然可以变化。也应理解本文中使用的术语仅为了描述特定的方面且不旨在为限制性的。
38、仅为了读者的方便而将详细描述分成不同的章节,并且在任何章节中发现的公开内容可以与在另一章节中的公开内容相组合。为了方便读者,本专利说明书中可能会使用标题或副标题,但这并不意欲影响本公开的范围。
39、定义
40、除非另外定义,否则本文所用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。在本说明书和随后的权利要求书中,将提及许多术语,这些术语应定义为具有以下含义:
41、本文施用的术语仅出于描述特定实施方案的目的,并且不意在具有限制性。如本文所使用,除非上下文明确另外指示,否则单数形式“一个(种)”和“该/所述”旨在也包括复数形式。
42、“任选的”或“任选地”意指随后描述的事件或情形会或不会发生,并且该描述包括所述事件或情形发生的例子和不发生的例子。
43、术语“约”在数字名称(例如温度、时间、数量、浓度等,包括范围)之前被使用时表示近似值,所述近似值可能变化(+)或(-)10%、5%、1%,或它们之间的任何子范围或子值。优选地,当关于量使用时,术语“约”意指该量可以变化+/-10%。
44、“包含/包括”意欲意指所述组合物和方法包括所列举的要素,但不排除其他要素。“基本上由......组成”在用于定义组合物和方法时将意味着排除对于针对所陈述用途的组合具有任何本质意义的其他要素。因此,本质上由如本文所限定的要素组成的组合物将不排除不会实质性影响要求保护的发明的一个或多个基本和新颖特征的其他材料或步骤。“由......组成”意味着排除超过微量的其他成分的要素和实质性的方法步骤。由这些过渡术语中的每一个定义的实施方案在本公开的范围内。
45、如本文所用的术语“无细胞dna”是指通过细胞死亡释放到血流中的dna的短片段。
46、如本文所用的术语“神经元”是指任何神经元或神经元细胞类型。作为非限制性实例,神经元可以是运动神经元、多巴胺能神经元、皮质神经元、感觉神经元、中间神经元或中型多棘神经元。
47、方法
48、由于从脑组织获得的活检物周围固有的并发症,当诊断脑中的疾病时必须使用其它组织。先前的研究已经尝试使用dna甲基化特征作为可能的神经变性疾病的诊断,使用脑脊液作为主要液体活检物。使用脊髓穿刺抽取csf液。这是一个痛苦且昂贵的过程,需要医学学位,并且包括对患者带来的许多潜在健康风险。所公开方法的优点在于它可对血液样本进行,血液样本是一种已成为医疗保健中标准液体活检物的组织,因为其提取相对简单、廉价且对患者带来的风险低。
49、本公开涉及一种设计用于诊断症状前神经变性疾病或疾患的基于血液的两部分诊断工具。第一部分由设计用于扩增和测序无细胞dna的预定区域的测定法组成。第二部分由计算机实施的分析(例如,python来源)组成,所述分析分析了甲基化特征以鉴定神经元dna并提供症状前神经变性疾病或疾患的诊断。
50、使用基于血液的无细胞dna提取的标准方案,然后使用pcr在基因组的预先选择的位点对dna进行亚硫酸氢盐转化和扩增。用于pcr扩增的测定法是一种独特设计的测定法,意在靶向和扩增亚硫酸氢盐转化dna的预先选择的区域。这些预先选择的区域含有神经元细胞独有的甲基化特征,这使得能够从可能在血液的无细胞dna中找到的所有其他细胞类型的dna中容易地鉴定出神经元来源的dna。扩增后,通过dna测序对区域进行测序。
51、然后分析每个单读长的甲基化特征。这是使用先前建立的神经元细胞和全血细胞的甲基化“蓝图”完成的。所公开发明的计算机实施的分析将每个读长与这些“蓝图”进行比较,并预测每个读长源自哪种细胞类型。一旦鉴定出神经元dna,分析即可预测症状前神经变性疾病或疾患。这是通过以下方式来完成的:首先分析血液中存在的神经元细胞无细胞dna的量,其次通过将甲基化特征与患有神经变性疾病或疾患的患者的甲基化“蓝图”进行比较。两者的组合最终可以诊断出患者是否患有症状前神经变性疾病或疾患。
52、细胞类型,例如神经元,具有独特的甲基化模式(“蓝图”),所述甲基化模式可用于将它们与其他细胞类型区分开来。此外,甲基化模式有助于区分单个神经元类型与其他神经元类型,例如区分运动神经元和多巴胺能神经元。无细胞dna(例如在血液中发现的无细胞dna)是全身细胞死亡的结果。发明人已发现,分析来自神经元的甲基化模式的无细胞dna可预测受试者是否存在神经变性疾病或疾患。
53、该方法可用于在症状发作之前或症状为轻度的早期阶段检测神经变性疾病或疾患。所述方法还可用于确定外伤性脑损伤(诸如脑震荡)的发病率、严重程度和/或持续时间(例如消退)。更进一步,所述方法还可用于区分不同类型的神经变性疾病或疾患。在另外的方面,所述方法可用于评价治疗剂治疗神经变性疾病或疾患的功效。
54、在一些方面,提供了治疗患有神经变性疾病或疾患或处于患神经变性疾病或疾患风险的受试者的方法。在实施方案中,方法包括:
55、(i)从来自受试者的血液样本获取无细胞dna;
56、(ii)分析所述无细胞dna的甲基化模式;
57、(iii)确定来自神经元的无细胞dna的百分比;
58、(iv)将所述来自神经元的无细胞dna的百分比与对照进行比较;以及
59、(v)当来自神经元的无细胞dna的百分比大于所述对照时,施用治疗或预防神经变性疾病或疾患的治疗剂。
60、在实施方案中,步骤(ii)包括分析dna的整个扩增子的甲基化模式。在实施方案中,整个扩增子的长度为至少约50个碱基对(bp)。
61、在实施方案中,整个扩增子的长度介于约50至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约60至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约70至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约80至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约90至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约100至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约150至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约200至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约250至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约300至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约350至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约400至约500个碱基对之间。在实施方案中,整个扩增子的长度介于约450至约500个碱基对之间。
62、在实施方案中,整个扩增子的长度介于约50至约450个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约400个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约350个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约300个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约250个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约200个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约150个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约100个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约90个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约80个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约70个碱基对之间。在实施方案中,整个扩增子的长度介于约50至约60个碱基对之间。整个扩增子长度可以是所列举范围内的任何值或子范围,包括端点。
63、在一些方面,本公开涉及治疗受试者的方法,其中所述受试者患有神经变性疾病或疾患或处于患神经变性疾病或疾患的风险中,所述方法包括:
64、(i)从来自受试者的血液样本获取无细胞dna;
65、(ii)分析所述无细胞dna的甲基化模式;
66、(iii)确定来自神经元的无细胞dna的百分比;以及
67、(iv)当来自神经元的无细胞dna的百分比大于约5%时,施用治疗或预防神经变性疾病或疾患的治疗剂。
68、在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约99%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约90%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约80%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约70%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约60%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约50%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约40%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约30%之间时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约20%之间时,施用治疗剂。
69、在实施方案中,当来自神经元的无细胞dna的百分比大于约2%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约3%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约4%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约5%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约6%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约7%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约8%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约9%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约10%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约11%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约12%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约13%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约14%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约15%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约20%时,施用治疗剂。
70、在一些方面,本公开涉及选择患者用于使用治疗神经变性疾病或疾患的治疗剂进行治疗的方法,所述方法包括:
71、(i)从来自受试者的血液样本获取无细胞dna;
72、(ii)分析所述无细胞dna的甲基化模式;
73、(iii)确定来自神经元的无细胞dna的百分比;以及
74、(iv)将来自神经元的无细胞dna的百分比与对照进行比较;
75、其中,当所述来自神经元的无细胞dna的百分比大于所述对照时,选择所述患者用于治疗。
76、在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约99%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约90%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约80%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约70%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约60%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约50%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约40%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约30%之间时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比介于约3%至约20%之间时,选择患者用于治疗。
77、在实施方案中,当来自神经元的无细胞dna的百分比大于约3%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约5%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约6%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约7%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约8%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约9%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约10%时,施用治疗剂。在实施方案中,当来自神经元的无细胞dna的百分比大于约11%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约12%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约13%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约14%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约15%时,选择患者用于治疗。在实施方案中,当来自神经元的无细胞dna的百分比大于约20%时,选择患者用于治疗。
78、在实施方案中,来自神经元的无细胞dna的百分比大于对照表明神经变性疾病或外伤性脑损伤的风险增加。
79、在一些方面,本公开涉及分析受试者的生物样本的方法。在实施方案中,受试者患有神经变性疾病或疾患,或者处于患此疾病的风险中。在实施方案中,方法包括:
80、(i)从来自受试者的血液样本获取无细胞dna;
81、(ii)分析所述无细胞dna的甲基化模式;
82、(iii)确定来自神经元的无细胞dna的百分比;以及
83、(iv)将来自神经元的无细胞dna的百分比与对照进行比较。
84、在一些方面,本公开涉及计算机产品,包括存储多个指令的非暂时性计算机可读介质,所述指令在被执行时控制计算机系统来分析来自受试者的生物样本以确定受试者中的神经变性疾病或疾患的风险,其中生物样本包括无细胞dna。在实施方案中,指令包括:
85、(i)鉴定以高于阈值的速率在神经元中发生的第一dna甲基化模式,其中第一dna甲基化模式包括在一个或多个甲基化区域的甲基化,并且任选地包括在一个或多个未甲基化区域的不甲基化;
86、(ii)分析所述无细胞dna的第二dna甲基化模式;以及
87、(iii)计算无细胞dna中一个或多个甲基化区域和任选地一个或多个未甲基化区域的相对丰度;以及
88、(iv)通过将相对丰度与对照进行比较来确定受试者的神经变性疾病或疾患的风险。
89、在一些方面,本公开涉及分析生物样本的计算机实施的方法,包括:
90、(i)鉴定以高于阈值的速率在神经元中发生的第一dna甲基化模式,其中第一dna甲基化模式包括在一个或多个甲基化区域的甲基化,并且任选地包括在一个或多个未甲基化区域的不甲基化;
91、(ii)分析所述无细胞dna的第二dna甲基化模式;
92、(iii)计算无细胞dna中一个或多个甲基化区域和任选地一个或多个未甲基化区域的相对丰度;以及
93、(iv)通过将相对丰度与对照进行比较来确定受试者的神经变性疾病或疾患的风险。
94、在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约99%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约90%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约80%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约70%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约60%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约50%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约40%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约30%之间指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比介于约3%至约20%之间指示神经变性疾病或外伤性脑损伤的风险增加。
95、在实施方案中,来自神经元的无细胞dna的百分比大于约3%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约4%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约5%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约6%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约7%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约8%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约9%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约10%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约11%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约12%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约13%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约14%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约15%指示神经变性疾病或外伤性脑损伤的风险增加。在实施方案中,来自神经元的无细胞dna的百分比大于约20%指示神经变性疾病或外伤性脑损伤的风险增加。
96、在实施方案中,确定来自神经元的无细胞dna的百分比包括将无细胞dna的甲基化模式与神经元dna甲基化模式进行比较,其中神经元dna甲基化模式包括在一个或多个甲基化区域的甲基化。在实施方案中,神经元dna甲基化模式包括一个或多个未甲基化区域的不甲基化。
97、在测序和数据处理之后,可以评估每个分子的甲基化状态。
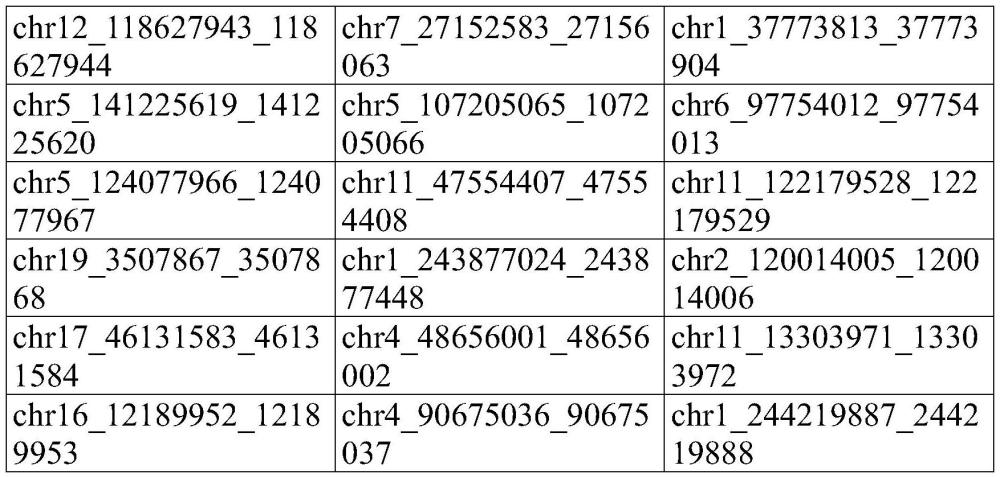
98、在一些实施方案中,将来自样本的序列与参考dna序列进行比对。在一些实施方案中,参考dna序列包含人类基因组。在一些实施方案中,参考dna序列包含人类基因组的一部分。在一些实施方案中,参考dna序列包含通过pcr扩增的区域。在一些实施方案中,参考dna序列包含pcr产物的一部分。比对之后,可以分析被鉴定为在组织之间具有不同甲基化状态的位置,以测量所述位置处碱基调用的相对频率,从而确定库中估计的甲基化分数。在一些实施方案中,然后可以结合其他位置来分析在每个位置的该甲基化分数,以找到经测序dna分子的总体甲基化状态。
99、在一些实施方案中,搜索来自样本的序列以鉴定经测序dna分子内长度为n的特定碱基序列,并且n为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个碱基长。在一些实施方案中,碱基序列与被评价的碱基相邻。在一些实施方案中,碱基序列涵盖被评价的碱基。在一些实施方案中,使用两个或更多个版本的序列来表示dna序列的甲基化和未甲基化状态。
100、在一些实施方案中,将来自样本的序列馈送到机器学习算法中。在一些实施方案中,机器学习算法包括神经网络。在一些实施方案中,机器学习算法包括多层感知器。在一些实施方案中,机器学习算法包括卷积神经网络。在一些实施方案中,机器学习算法使用碱基调用的dna序列作为输入。在一些实施方案中,dna序列被分解为k聚体:并且k=2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个碱基长。例如,在一个实施方案中,测序数据被分解为重叠六聚体(k=6)。这些六聚体被计数并馈送到多层感知器中,所述感知器包含4096个输入神经元(每个可能的六聚体序列各一个)、隐藏层中的8个神经元和1个输出神经元,将读长分类为甲基化或未甲基化。所述模型使用选自纯化组织样本的100,000个读长进行训练,所述纯化组织样本在所检查的基因座处仅含有甲基化或未甲基化的dna。使用20%的数据交叉验证显示,最终准确率为99.8%,损失为0.01。
101、所述对照可以是任何适合的对照。在实施方案中,对照是来自未治疗受试者的血液样本中来自神经元的无细胞dna的百分比。在实施方案中,对照是来自健康受试者的血液样本中来自神经元的无细胞dna的百分比。在实施方案中,对照是来自治疗之前受试者的血液样本。在实施方案中,对照是阈值。在实施方案中,阈值是大于约3%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约4%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约5%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约6%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约7%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约8%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约9%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约10%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约11%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约12%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约13%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约14%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约15%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约20%的来自神经元的无细胞dna的百分比。
102、在实施方案中,神经变性疾病是阿尔茨海默氏病。在实施方案中,神经变性疾病是亨廷顿病。在实施方案中,神经变性疾病是帕金森病。在实施方案中,神经变性疾病是肌萎缩侧索硬化(als)。在实施方案中,神经变性疾病是共济失调。在实施方案中,神经变性疾病是多发性硬化。在实施方案中,神经变性疾病或疾患是多系统萎缩。在实施方案中,神经变性疾患是轻度外伤性脑损伤。在实施方案中,神经变性疾患是脑震荡。可能明确排除一种或多种这些疾病或疾患。
103、神经元可以是任何神经元类型,或其组合。在实施方案中,神经元是运动神经元。在实施方案中,神经元是感觉神经元。在实施方案中,神经元是中间神经元。在实施方案中,神经元是多巴胺能神经元。在实施方案中,神经元是gaba能神经元。在实施方案中,神经元是谷氨酸能神经元。在实施方案中,神经元是皮质神经元。
104、在实施方案中,神经元来自前脑。在实施方案中,神经元来自中脑。在实施方案中,神经元来自后脑。在实施方案中,神经元来自额叶。在实施方案中,神经元来自颞叶。在实施方案中,神经元来自顶叶。在实施方案中,神经元来自枕叶。在实施方案中,神经元来自小脑。在实施方案中,神经元来自脑干。
105、在实施方案中,分析dna甲基化模式包括确定dna区域的甲基化状态。在实施方案中,dna是染色体dna。在实施方案中,所述区域是在一种神经元或一种神经元类型中与一种或多种其他细胞类型相比优先甲基化(更有可能甲基化)的区域。在实施方案中,所述区域是在一种神经元或一种神经元类型中与一种或多种其他细胞类型相比优先未甲基化(更有可能未甲基化)的区域。
106、在实施方案中,分析了表1中列出的一个或多个区域的甲基化状态。在实施方案中,分析了表1中列出的一个或多个区域中一个或多个亚区的甲基化状态。在实施方案中,分析了chr3:42190679,42191148的甲基化状态。在实施方案中,在表1中所示的一个或多个区域(或表1中所示的一个或多个区域中的一个或多个亚区)中具有甲基化的cfdna的百分比增加(与对照相比)指示阿尔茨海默氏病的风险增加。在实施方案中,在表1中所示的一个或多个区域(或表1中所示的一个或多个区域中的一个或多个亚区)中具有甲基化的cfdna的百分比增加(与对照相比)指示阿尔茨海默氏病的风险增加。
107、表1.染色体区域-阿尔茨海默氏病
108、
109、
110、
111、
112、
113、
114、
115、
116、
117、
118、
119、
120、
121、
122、
123、
124、可使用任何分析dna甲基化模式的方法。例如,在实施方案中,分析甲基化模式包括亚硫酸氢盐测序。
125、在实施方案中,使用长读长测序对dna进行测序。
126、在实施方案中,受试者没有神经变性疾病或疾患的症状。在实施方案中,受试者具有神经变性疾病或疾患的症状。在实施方案中,受试者具有轻度神经变性疾病或疾患的症状。在实施方案中,受试者具有早期神经变性疾病或疾患的症状。在实施方案中,受试者患有轻度认知损害。
127、在实施方案中,本文中所述的方法可用于神经变性疾病的症状前诊断。例如,可以在临床预约时对受试者进行测试,例如45-70岁的年度体检。
128、在实施方案中,所述方法包括选择具有神经变性疾病或疾患症状的受试者。在实施方案中,所述方法包括选择具有轻度神经变性疾病或疾患症状的受试者。在实施方案中,所述方法包括选择具有早期神经变性疾病或疾患症状的受试者。在实施方案中,所述方法包括选择患有轻度认知损害的受试者。
129、一方面提供了治疗患有轻度外伤性脑损伤的受试者的方法,包括:
130、(i)选择处于轻度外伤性脑损伤风险中的受试者;
131、(ii)从来自所述受试者的血液样本获取无细胞dna;
132、(iii)分析所述无细胞dna的甲基化模式;
133、(iv)确定来自神经元的无细胞dna的百分比;以及
134、(v)将所述来自神经元的无细胞dna的百分比与对照进行比较;
135、(vi)当所述来自神经元的无细胞dna的百分比大于所述对照时,对所述受试者进行轻度外伤性脑损伤治疗。
136、在实施方案中,治疗受试者包括施用治疗轻度外伤性脑损伤的一种或多种症状的治疗剂。在实施方案中,治疗受试者包括身体和/或精神休息。在实施方案中,治疗受试者包括中断一项或多项活动,例如体育运动。
137、在实施方案中,方法还包括在治疗后的时间点重复步骤(ii)至(v)。在实施方案中,当在所述时间点的来自神经元的无细胞dna的百分比小于或等于对照时,中断治疗。在实施方案中,当在所述时间点的来自神经元的无细胞dna的百分比大于所述对照时,继续治疗。
138、一方面提供了监测患有或疑似患有轻度外伤性脑损伤的受试者的方法,包括:
139、(i)选择处于轻度外伤性脑损伤风险中的受试者;
140、(ii)从来自所述受试者的血液样本获取无细胞dna;
141、(iii)分析所述无细胞dna的甲基化模式;
142、(iv)确定来自神经元的无细胞dna的百分比。
143、在实施方案中,所述方法包括将来自神经元的无细胞dna的百分比与对照进行比较。在实施方案中,当来自神经元的无细胞dna的百分比大于所述对照时,确定受试者患有轻度外伤性脑损伤。
144、在实施方案中,随时间对受试者进行监测。在实施方案中,方法包括重复步骤(ii)至(iv)至少一次。在实施方案中,所述方法包括监测受试者直到来自神经元的无细胞dna的百分比小于或等于对照。
145、在实施方案中,来自神经元的无细胞dna的百分比小于或等于对照指示mtbi已消退。在实施方案中,对照是受试者中来自神经元的无细胞dna的初始百分比(例如,来自初始测定步骤)。在实施方案中,来自神经元的无细胞dna的百分比小于或等于对照指示受试者的脑已从mtbi中恢复。在实施方案中,来自神经元的无细胞dna的百分比小于或等于对照指示脑肿胀减少。
146、在实施方案中,每天重复步骤(ii)至(iv)。在实施方案中,每2天重复步骤(ii)至(iv)。在实施方案中,每3天重复步骤(ii)至(iv)。在实施方案中,每4天重复步骤(ii)至(iv)。在实施方案中,每5天重复步骤(ii)至(iv)。在实施方案中,每6天重复步骤(ii)至(iv)。在实施方案中,每周重复步骤(ii)至(iv)。在实施方案中,每两周重复步骤(ii)至(iv)。在实施方案中,至少每周一次重复步骤(ii)至(iv)。在实施方案中,至少每周两次重复步骤(ii)至(iv)。在实施方案中,至少每周三次重复步骤(ii)至(iv)。在实施方案中,至少每周四次重复步骤(ii)至(iv)。在实施方案中,至少每周五次重复步骤(ii)至(iv)。在实施方案中,至少每周六次重复步骤(ii)至(iv)。
147、其他方法
148、本文所述的方法、组合物和试剂盒可用于监测治疗剂或潜在治疗剂的有效性。例如,可以在临床试验期间监测潜在治疗剂的有效性。在另一实例中,可以在受试者中监测治疗剂的有效性。
149、目前有超过176种药物在临床试验中用于治疗神经变性疾病。不受理论束缚,据信通过监测血液中当前的神经元dna水平来监测药物有效性可以显著加快试验速度。将可以定期(例如每周、每月)进行测试,以评估在降低血液中神经元dna水平下随时间的药物有效性。
150、在一些方面,本公开涉及确定神经变性疾病或疾患的潜在治疗的功效的方法,所述方法包括:
151、(i)从多名受试者的血液样本获取无细胞dna,其中已经向受试者施用潜在治疗;
152、(ii)分析每名受试者的无细胞dna的甲基化模式;
153、(iii)确定每名受试者来自神经元的无细胞dna的百分比;以及
154、(iv)将每名受试者来自神经元的无细胞dna的百分比与对照进行比较;
155、其中,当所述来自神经元的无细胞dna的百分比低于所述对照时,所述潜在治疗是有效的。
156、在实施方案中,通过对每名受试者的来自神经元的无细胞dna的百分比求平均值来确定来自神经元的无细胞dna的平均百分比。在实施方案中,将来自神经元的无细胞dna的平均百分比与对照进行比较。在实施方案中,当来自神经元的无细胞dna的平均百分比低于对照时,潜在治疗是有效的。
157、在一些方面,本公开涉及确定神经变性疾病或疾患的治疗的功效的方法,所述方法包括:
158、(i)从来自受试者的血液样本获取无细胞dna,其中已经向所述受试者施用所述治疗;
159、(ii)分析所述无细胞dna的甲基化模式;
160、(iii)确定来自神经元的无细胞dna的百分比;以及
161、(iv)将来自神经元的无细胞dna的百分比与对照进行比较;
162、其中,当来自神经元的无细胞dna的百分比低于对照时,所述治疗是有效的。
163、在实施方案中,每天重复步骤(ii)至(iv)。在实施方案中,每2天重复步骤(ii)至(iv)。在实施方案中,每3天重复步骤(ii)至(iv)。在实施方案中,每4天重复步骤(ii)至(iv)。在实施方案中,每5天重复步骤(ii)至(iv)。在实施方案中,每6天重复步骤(ii)至(iv)。在实施方案中,每周重复步骤(ii)至(iv)。在实施方案中,每两周重复步骤(ii)至(iv)。在实施方案中,至少每周一次重复步骤(ii)至(iv)。在实施方案中,至少每周两次重复步骤(ii)至(iv)。在实施方案中,至少每周三次重复步骤(ii)至(iv)。在实施方案中,至少每周四次重复步骤(ii)至(iv)。在实施方案中,至少每周五次重复步骤(ii)至(iv)。在实施方案中,至少每周六次重复步骤(ii)至(iv)。在实施方案中,至少每月一次重复步骤(ii)至(iv)。在实施方案中,至少每月两次重复步骤(ii)至(iv)。在实施方案中,至少每月三次重复步骤(ii)至(iv)。在实施方案中,至少每月四次重复步骤(ii)至(iv)。在实施方案中,至少每月五次重复步骤(ii)至(iv)。在实施方案中,至少每月六次重复步骤(ii)至(iv)。在实施方案中,至少每月七次重复步骤(ii)至(iv)。在实施方案中,至少每月八次重复步骤(ii)至(iv)。
164、本文描述的方法、组合物和试剂盒可用于验证健康对照样本。许多机构和公司从组织库购买对照样本用于它们的研究或临床试验。据统计,这些对照中的九分之一患有未检测到的症状前神经变性疾病。可以对对照样本进行症状前疾病的测试,以确认其实际上是健康对照。
165、在一些方面,本公开涉及用于验证对照样本的方法,所述方法包括:
166、(i)从对照样本或从获取对照样本的受试者获取无细胞dna;
167、(ii)分析所述无细胞dna的甲基化模式;
168、(iii)确定来自神经元的无细胞dna的百分比;
169、在实施方案中,所述方法还包括将来自神经元的无细胞dna的百分比与对照进行比较。在实施方案中,当来自神经元的无细胞dna的百分比小于对照时,对照样本得以验证。
170、所述对照可以是任何适合的对照。在实施方案中,对照是来自未治疗(或安慰剂治疗)受试者或多名受试者的血液样本中来自神经元的无细胞dna的百分比。在实施方案中,对照是来自健康受试者或多名健康受试者的血液样本中来自神经元的无细胞dna的百分比。在实施方案中,对照是来自治疗之前受试者的血液样本。在实施方案中,对照是阈值。在实施方案中,阈值是大于约3%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约4%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约5%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约6%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约7%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约8%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约9%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约10%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约11%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约12%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约13%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约14%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约15%的来自神经元的无细胞dna的百分比。在实施方案中,阈值是大于约20%的来自神经元的无细胞dna的百分比。
171、帕金森病
172、在实施方案中,本文中所述的方法可用于确定受试者是否患有帕金森病。在实施方案中,本文中所述的方法可用于确定受试者是否处于帕金森病的风险中。在实施方案中,本文中所述的方法可用于监测帕金森病的治疗或潜在治疗的有效性。
173、帕金森病(pd)是老年人中最常见的慢性进行性神经变性病症之一。据报道,全世界65岁及以上个体中pd的发病率为1%-2%。所述疾病还影响了很多年轻人。帕金森病患者遭受运动功能损害,例如运动徐缓、静止性震颤、强直、姿势障碍和步态改变,包括步态冻结(fog)和频繁跌倒。除运动功能以外,患者还常常遭受非运动功能损害,诸如认知损害、睡眠障碍和抑郁症。帕金森病最显著的体征和症状是当基底神经节(脑中控制运动的区域)中的神经细胞开始受损和/或死亡时发生的。帕金森病(pd)的运动症状是由黑质致密部(snc)中多巴胺能神经元的死亡引起的。
174、目前,左旋多巴(例如inbrija)是帕金森病的主要治疗。左旋多巴可与卡比多巴(例如sinemet、sinemet-cr、parcopa、rytary)一起服用,卡比多巴可预防或减少左旋多巴治疗的一些副作用(例如恶心、呕吐、低血压和躁动),并减少改善症状所需的左旋多巴的量。可开处方用于治疗帕金森病症状的其他治疗剂包括:多巴胺激动剂(例如,普拉克索(mirapex、mirapex er)、罗替高汀(neupro、eldepryl)、阿扑吗啡(apokyn、kynmobi)、罗匹尼罗(requip)、吡贝地尔、溴隐亭、卡麦角林(abergoline)、麦角乙脲(lisuride)、培高利特);酶抑制剂(例如,mao-b抑制剂(例如,司来吉兰(zelapar)、雷沙吉兰(azilect)、沙芬酰胺(safinamide)(xadago));comt抑制剂(例如,恩他卡朋(comtan)、奥匹卡朋(opicapone)(ongentys)、托卡朋(tasmar))),以通过减缓脑中分解多巴胺的酶来增加多巴胺的量;金刚烷胺(symmetrel、gocovri、osmolex),以帮助减少不自主运动;抗胆碱能药物(例如苯扎托品(benztropine)(cogentin)、苯海索(artane)),以减少震颤和肌肉强直;腺苷受体拮抗剂(a2a受体拮抗剂)(例如伊曲茶碱(nourianz);以及匹莫范色林(pimavanserin)(nuplazid)。其他联合治疗包括卡比多巴-左旋多巴-恩他卡朋(duopa、stalevo)。
175、在实施方案中,向来自神经元的cfdna量增加的受试者施用一种或多种治疗剂用于治疗帕金森病。在实施方案中,向受试者施用左旋多巴。在实施方案中,向受试者施用卡比多巴。在实施方案中,向受试者施用多巴胺激动剂。在实施方案中,向受试者施用普拉克索。在实施方案中,向受试者施用罗替高汀。在实施方案中,向受试者施用阿扑吗啡。在实施方案中,向受试者施用罗匹尼罗。在实施方案中,向受试者施用吡贝地尔。在实施方案中,向受试者施用溴隐亭。在实施方案中,向受试者施用卡麦角林。在实施方案中,向受试者施用麦角乙脲。在实施方案中,向受试者施用培高利特。在实施方案中,向受试者施用酶抑制剂。在实施方案中,向受试者施用mao-b抑制剂。在实施方案中,向受试者施用司来吉兰。在实施方案中,向受试者施用雷沙吉兰。在实施方案中,向受试者施用沙芬酰胺。在实施方案中,向受试者施用omt抑制剂。在实施方案中,向受试者施用恩他卡朋。在实施方案中,向受试者施用奥匹卡朋。在实施方案中,向受试者施用托卡朋。在实施方案中,向受试者施用金刚烷胺。在实施方案中,向受试者施用抗胆碱能药物。在实施方案中,向受试者施用苯扎托品。在实施方案中,向受试者施用苯海索。在实施方案中,向受试者施用腺苷受体拮抗剂(a2a受体拮抗剂)。在实施方案中,向受试者施用伊曲茶碱。在实施方案中,向受试者施用匹莫范色林。在实施方案中,向受试者施用卡比多巴和左旋多巴。在实施方案中,向受试者施用卡比多巴、左旋多巴和恩他卡朋。在实施方案中,明确排除一种或多种药剂。
176、阿尔茨海默氏病
177、在实施方案中,本文中所述的方法可用于确定受试者是否患有阿尔茨海默氏病。在实施方案中,本文中所述的方法可用于确定受试者是否处于阿尔茨海默氏病的风险中。在实施方案中,本文中所述的方法可用于监测阿尔茨海默氏病的治疗或潜在治疗的有效性。
178、阿尔茨海默氏病是一种慢性神经变性疾病,其破坏脑细胞,导致脑功能随时间而恶化。阿尔茨海默氏病的常见症状包括记忆丧失、语言问题以及冲动或不可预测的行为。所述疾病的主要特征是脑中存在斑块和缠结,以及脑神经元之间连接的损失。阿尔茨海默氏病占美国痴呆病例的约60–80%。
179、虽然目前尚无已知的阿尔茨海默氏病治疗方法,但可以使用各种药物来减少或减缓认知症状的进展。fda已批准几种胆碱酯酶抑制剂用于此目的,包括多奈哌齐(aricept)、加兰他敏(razadyne)、利斯的明(exelon)。其他治疗包括美金刚(namenda)、阿杜卡努单抗(aducanumab)和仑卡奈单抗(仑卡奈单抗-irmb;leqembi)。
180、在实施方案中,向受试者施用胆碱酯酶抑制剂。在实施方案中,向受试者施用多奈哌齐。在实施方案中,向受试者施用加兰他敏。在实施方案中,向受试者施用利斯的明。在实施方案中,向受试者施用美金刚。在实施方案中,向受试者施用阿杜卡努单抗。在实施方案中,向受试者施用仑卡奈单抗。
181、其他治疗剂在临床试验中用于治疗阿尔茨海默氏病。这些包括但不限于:阿杜卡努单抗;agb101(低剂量左乙拉西坦);atuzaginstat(cor388);avp-786;axs-05;blarcamesine(anavex2-73);bpdo-1603;布瑞哌唑;咖啡因;多奈单抗(donanemab);多奈单抗和阿杜卡努单抗;多奈哌齐;艾司西酞普兰;gantenerumab;更汀芦单抗(gantenerumab)和索拉珠单抗(solanezumab);胍法辛;gv-971;肼屈嗪;二十碳五烯酸乙酯(ipe);氯沙坦、氨氯地平和阿托伐他汀;二甲双胍;纳比隆(nabilone);ne3107;尼洛替尼be;琥珀八氢氨吖啶(octohydroaminoacridine succinate);ω-3(dha+epa);司美格鲁肽;simufilam(pti-125);索拉珠单抗;tricaprilin;trx0237;valiltramiprosate(alz-801)。abvac40;aci-35;ad-35;al002;别孕烷醇酮(allopregnanolone);aph-1105;巴瑞替尼;贝瑞奈单抗(bepranemab);bcg疫苗;bpn14770;溴隐亭;苔藓抑素1;bxcl-501;卡那单抗(canakinumab);cort108297;克伦单抗(crenezumab);cst-2032;姜黄素;cy6463;daoib;达格列净;达雷妥尤单抗;达沙替尼和槲皮素;去铁酮;dha;屈大麻酚;e2814;edonerpic(t-817ma);elayta(ct1812);explas(运动血浆);fosgonimeton(ath-1017);脑穿梭(brainshuttle)更汀芦单抗(ro7126209);gb301;葡萄籽提取物;gv1001;鼻内胰岛素;鼻内胰岛素和恩格列净;ionis maptrx(biib080);jnj-63733657;拉米夫定(3tc);来那度胺;左乙拉西坦;l-丝氨酸;lupron(醋酸亮丙瑞林储库);ly3372689;美金刚;代谢辅助因子补充;mib-626;孟鲁司特;mw150;奈夫拉莫德(neflamapimod)(vx-745);烟酰胺;尼古丁透皮贴剂;奥西曲匹(obicetrapib);ω-3pufa;pepinemab(vx15);posiphen;哌唑嗪;pu-ad;雷帕霉素(西罗莫司);沙格司亭;西瑞奈单抗(semorinemab)(ro7105705);塞尼卡泊(senicapoc);sovateltide(pmz-1620);simufilam(pti-125);苏沃雷生(suvorexant);t3d-959;tb006;替米沙坦和培哚普利;tdap疫苗;不含thc的cbd油;硫乙拉嗪(thiethylperazine)(tep);曲鲁唑(troriluzole)(bhv4157);伐昔洛韦;varoglutamstat(pq912);vgh-ad1;xanamem;养血清脑丸(yangxue qingnao pills);aav-htert;acu193;asn51;bey2153;bms-984923;bdpp(生物活性膳食多酚制剂);contraloid醋酸盐;cor588;达比加群;依地可替尼(edicotinib)(jnj-40346527);依法韦仑;恩曲他滨;igc ad1;lu af87908;lx1001;ly3372993;mk-1942和多奈哌齐;nni-362;rem0046127;双水杨酯;shr-1707;tb006;替米沙坦;海藻糖;tricaprilin(ac-1202);伏立诺他;vt301;xpro1595。正在测试的其他治疗包括:同种异体人类msc;snk01(自体自然杀伤细胞);同种异体脂肪msc-外泌体;cb-ac-02(胎盘来源的msc);人脐带血来源的msc(neurostem);同种异体人msc;astrostem(自体脂肪来源的msc)。在实施方案中,向受试者施用一种或多种所列药剂。在实施方案中,明确排除一种或多种药剂。
182、亨廷顿氏病
183、在实施方案中,本文中所述的方法可用于确定受试者是否患有亨廷顿氏病。在实施方案中,本文中所述的方法可用于确定受试者是否处于亨廷顿氏病的风险中。在实施方案中,本文中所述的方法可用于监测亨廷顿氏病的治疗或潜在治疗的有效性。
184、亨廷顿氏病是一种遗传性疾病,其导致脑中神经细胞的进行性变性。亨廷顿氏病通常导致运动、思维(认知)和精神障碍。
185、目前尚无治疗可以阻止或减缓亨廷顿氏病的进展。患者可通过处方治疗来减轻影响,包括抗抑郁剂(例如选择性血清素再摄取抑制剂)、抗精神病药、精神抑制剂(奥氮平、丁苯那嗪、阿立哌唑)、运动疗法等。实验性治疗包括但不限于缬苯那嗪(valbenazine)、氘丁苯那嗪、盐酸贝凡洛尔、普利多匹定(pridopidine)、tominersen、wve-003、anx-005。
186、在实施方案中,向受试者施用抗抑郁剂。在实施方案中,向受试者施用抗精神病药。在实施方案中,向受试者施用精神抑制剂。在实施方案中,向受试者施用奥氮平。在实施方案中,向受试者施用丁苯那嗪。在实施方案中,向受试者施用阿立哌唑。在实施方案中,向受试者施用运动疗法。在实施方案中,向受试者施用缬苯那嗪。在实施方案中,向受试者施用氘丁苯那嗪。在实施方案中,向受试者施用盐酸贝凡洛尔。在实施方案中,向受试者施用普利多匹定。在实施方案中,向受试者施用tominersen。在实施方案中,向受试者施用wve-003。在实施方案中,向受试者施用anx-005。
187、肌萎缩侧索硬化(als)
188、在实施方案中,本文中所述的方法可用于确定受试者是否患有als。在实施方案中,本文中所述的方法可用于确定受试者是否处于als的风险中。在实施方案中,本文中所述的方法可用于监测als的治疗或潜在治疗的有效性。
189、als是一种进行性神经系统疾病,其影响脑和脊髓中的神经细胞,导致肌肉控制损失。症状可能包括:行走或正常日常活动困难、绊倒和跌倒、腿、脚或脚踝无力、手无力或笨拙、言语不清或吞咽困难、手臂、肩膀和舌头的肌肉痛性痉挛和颤搐、不适宜的哭、笑或打呵欠,和/或认知和行为变化。
190、已批准用于治疗als的药物包括利鲁唑(rilutek、exservan、tiglutik药盒)、依达拉奉(radicava)、苯丁酸钠和牛磺酸二醇(taurursodiol)(relyvrio)。右美沙芬hbr和硫酸奎尼丁(nuedexta)可开处方用于治疗假性延髓情感(pba),所述假性延髓情感的特征是频繁、不自主且经常突然发作的夸张的和/或与实际感觉不符的哭和/或笑。
191、在实施方案中,向受试者施用利鲁唑。在实施方案中,向受试者施用依达拉奉。在实施方案中,向受试者施用苯丁酸钠和牛磺酸二醇。在实施方案中,向受试者施用右美沙芬。在实施方案中,向受试者施用硫酸奎尼丁。
192、共济失调
193、在实施方案中,本文中所述的方法可用于确定受试者是否患有共济失调。在实施方案中,本文中所述的方法可用于确定受试者是否处于共济失调的风险中。在实施方案中,本文中所述的方法可用于监测共济失调的治疗或潜在治疗的有效性。
194、共济失调是一种异常缺乏协调性的情况,可导致蹒跚步态、精细运动活动困难以及视力问题和有时发生的言语问题。共济失调可能是另一健康问题(例如营养不良或遗传性病症)的症状。
195、多发性硬化(ms)
196、在实施方案中,本文中所述的方法可用于确定受试者是否患有ms。在实施方案中,本文中所述的方法可用于确定受试者是否处于ms的风险中。在实施方案中,本文中所述的方法可用于监测ms的治疗或潜在治疗的有效性。
197、当免疫系统攻击保护神经纤维的髓鞘时,会引起多发性硬化(ms)。最终,所述疾病可导致神经纤维的永久性损伤或恶化。治疗包括皮质类固醇(例如,糖皮质激素,诸如泼尼松、甲泼尼龙)、促肾上腺皮质激素(acth)、血浆分离、干扰素β药物((干扰素β-1a)、(干扰素β-1b)、(聚乙二醇干扰素β-1a))、醋酸格拉替雷(copaxone、glatopa)、单克隆抗体(奥法妥木单抗(kesimpta、arzerra)、利妥昔单抗、阿仑单抗奥瑞珠单抗(ocrevus)、那他珠单抗(tysabri))、特立氟胺(aubagio)、富马酸单甲酯(bafiertamtm)、富马酸二甲酯(tecfidera)、富马酸地洛西美(vumerity)、芬戈莫德(gilenya)、克拉屈滨(mavenclad)、西尼莫德(mayzent)、波内西莫德(ponesimod)(ponvory)、奥扎莫德(zeposia)、米托蒽醌。
198、在实施方案中,向受试者施用皮质类固醇。在实施方案中,皮质类固醇是糖皮质激素。在实施方案中,向受试者施用泼尼松。在实施方案中,向受试者施用甲泼尼龙。在实施方案中,向受试者施用acth。在实施方案中,向受试者施用血浆分离。在实施方案中,向受试者施用干扰素β药物。在实施方案中,向受试者施用干扰素β-1a。在实施方案中,向受试者施用干扰素β-1b。在实施方案中,向受试者施用聚乙二醇干扰素β-1a。在实施方案中,向受试者施用醋酸格拉替雷。在实施方案中,向受试者施用单克隆抗体。在实施方案中,向受试者施用奥法妥木单抗。在实施方案中,向受试者施用利妥昔单抗。在实施方案中,向受试者施用阿仑珠单抗。在实施方案中,向受试者施用奥瑞珠单抗。在实施方案中,向受试者施用那他珠单抗。在实施方案中,向受试者施用特立氟胺。在实施方案中,向受试者施用富马酸单甲酯。在实施方案中,向受试者施用富马酸二甲酯。在实施方案中,向受试者施用富马酸地洛西美。在实施方案中,向受试者施用芬戈莫德。在实施方案中,向受试者施用克拉屈滨。在实施方案中,向受试者施用西尼莫德。在实施方案中,向受试者施用波内西莫德。在实施方案中,向受试者施用奥扎莫德。在实施方案中,向受试者施用米托蒽醌。
199、多系统萎缩(msa)
200、在实施方案中,本文中所述的方法可用于确定受试者是否患有msa。在实施方案中,本文中所述的方法可用于确定受试者是否处于msa的风险中。在实施方案中,本文中所述的方法可用于监测msa的治疗或潜在治疗的有效性。
201、多系统萎缩(msa)是一种罕见的、退行性神经障碍,影响自主神经功能(例如血压)和运动控制。根据症状,msa有两种类型:帕金森病型和小脑型。帕金森型症状可包括肌肉僵硬、四肢弯曲困难、运动徐缓、震颤、声音柔和以及平衡和姿势问题。小脑型症状可包括共济失调、运动和协调损害、构音障碍、视觉障碍、吞咽困难和言语改变。
202、对msa没有已知的治愈方法。可使用升高血压药物和减轻帕金森病样症状的药物来治疗症状(参见帕金森病治疗)。
203、轻度外伤性脑损伤和其他脑损伤
204、在实施方案中,本文中所述的方法可用于确定受试者是否患有mtbi。在实施方案中,本文中所述的方法可用于确定mtbi的严重程度。在实施方案中,本文描述的方法可用于监测受试者从mtbi恢复的情况。在实施方案中,本文中所述的方法可用于监测mtbi的治疗或潜在治疗的有效性。
205、在实施方案中,本文中所述的方法可用于确定受试者是否患有脑损伤。在实施方案中,本文中所述的方法可用于确定脑损伤的严重程度。在实施方案中,本文描述的方法可用于监测受试者从脑损伤恢复的情况。在实施方案中,本文中所述的方法可用于监测脑损伤的治疗或潜在治疗的有效性。在实施方案中,脑损伤包括脑肿胀。在实施方案中,神经元的cfdna的减少指示脑肿胀的减少。
206、轻度外伤性脑损伤(mtbi),通常包括脑震荡,是对脑的损害,所述损害进而会对脑造成长期损伤/伤害。它最常由于直接接触头部而发生,但也可由间接损伤(例如,挥鞭样损伤或剧烈摇晃头部)引起。遭受过一次脑损伤的个体有更大风险遭受第二次脑损伤,而且更容易受到后续损伤。连续的mtbi所造成的损伤被认为具有累积性。
207、mtbi所致的长期损伤包括认知和运动技能恶化,诸如精神运动放缓、注意力和注意检索差(poor concentration and attention retrieval),从而导致表现变异性增加、总体执行功能障碍,以及睡眠功能障碍和情绪/行为变化。mtbi长期影响的常见实例可见于士兵、拳击手、美式足球运动员(football player)、英式足球运动员(soccer player)等。有证据充分的个体实例在发生mtbi很久之后,开始通过丧失一种或多种认知技能和/或运动技能而表现出脑的累积损伤。
208、不存在经批准的治疗剂用于治疗轻度外伤性脑损伤(例如脑震荡)。一般来说,会建议患者进行身体和精神上的休息,并且可能会给他们开具止痛药(例如,抗炎止痛药)。目前葛瑞林(ghrelin)在临床试验中用于治疗脑震荡。在实施方案中,向受试者施用止痛药。在实施方案中,向受试者施用抗炎止痛药。在实施方案中,向受试者施用葛瑞林。
209、应理解,本文所述的实施例和实施方案仅为了举例说明的目的,并且本领域技术人员将想到根据本发明的各种修改或变化,这些均包括在本技术的精神和权限以及所附权利要求书的范围之内。本文引用的所有出版物、专利和专利申请均出于所有目的通过引用整体特此并入。
210、实施例
211、本领域技术人员将会理解,本文中所述的实例仅用于说明的目的,并且本公开不受该说明的限制。
212、实施例1.cfdna的甲基化的分析
213、按照制造商的说明并作出一些修改,使用qiaamp minelute ccfdna mini kit(目录号55204)从人类患者的血浆中提取cfdna。简而言之,磁珠在使用前被升温至37摄氏度。将血浆与蛋白酶k、磁珠和缓冲液在振摇下一起温育约20min,然后旋转两次(每次旋转在200x g下30s),并去除上清液。将珠重悬于洗脱缓冲液中,并在室温下在振摇下温育10分钟。除去上清液,加入缓冲液,混合物运行通过minelute柱,cfdna从柱中洗脱出来。
214、然后对cfdna进行亚硫酸氢盐转化(ez dna methylation-lightning试剂盒,zymoresearch)或酶转化(nebnext甲基测序转化模块(methyl-seq conversion module),newengland biolabs)以转化甲基化碱基。
215、亚硫酸氢盐转化后,所关注的区域被扩增。简而言之,将亚硫酸氢盐转化的cfdna(2μl)、正向引物、反向引物和zymotaq预混液(25μl,zymo research)以及不含rna酶/dna酶的水混合,并在以下条件下在热循环仪上运行:
216、95℃1个循环持续10分钟;
217、38个循环:95℃持续30秒,55℃持续40秒,72℃持续40秒;
218、72℃1个循环持续7分钟,然后在4℃下温育。
219、扩增后,将样本用于制备文库,然后进行测序(纳米孔sqk-nbd114.96)。
220、对于阿尔茨海默氏病,靶向chr3:42190679,42191148的扩增。选择该区域是因为其在纯化的神经元与血浆之间的甲基化中存在显著差异。血浆的平均信号为甲基化β值:.9。纯化神经元dna的平均信号为甲基化β值:.04。这些值意味着该区域的神经元分子中将完全未甲基化。
221、所述区域的实际核苷酸序列为:ctgacgtcaccctctaggcg tctggataggacgatcctggctactcccattcagggctgctgtccagtgctgctttattggcagtgctgccagggtctccgttagctctctgcaaattgccttcctttctgctcctcctactccctccttcccccatagaatttttcttttcattgcccactttactgttttggctccagactgtcgttaagaatgtacagcctaattctggtgtgtttcgggatattcttctgtccagtattctggaagggcggggaggcatggcagcgttttacttgacgttgatggtgctgtgaagtccattctttcctctgcaagactactgactatgcagaaatttatcgaagcggattattatgaactagactggtattatgaagaatgctcggatggtaattatggcccctgcaaaacagagccgggatgtataggggtattgtctccttctg(chr3:42190679,42191148)(seq id no:1)。所述区域的亚硫酸氢盐转化形式为:ttgacgttattttttaggcgtttggataggacgattttggttatttttatttagggttgttgtttagtgttgttttattggtagtgttgttagggttttcgttagttttttgtaaattgtttttttttttgttttttttatttttttttttttttatagaatttttttttttattgtttattttattgttttggttttagattgtcgttaagaatgtatagtttaattttggtgtgtttcgggatatttttttgtttagtattttggaagggcggggaggtatggtagcgttttatttgacgttgatggtgttgtgaagtttatttttttttttgtaagattattgattatgtagaaatttatcgaagcggattattatgaattagattggtattatgaagaatgttcggatggtaattatggtttttgtaaaatagagtcgggatgtataggggtattgtttttttttg(chr3:42190679,42191148)(seq id no:2)。这些是使用ttttattgttttggttttagattgt(chr3:42190859,42190884)(seq id no:3)和gttgatggtgttgtg aagtttattt(chr3:42190979,42191004)(seq id no:4)作为正向引物,并使用aaataaacttcacaacaccatcaac(chr3:42190859,42190884)(seq id no:5)和acaatctaaaaccaaaacaataaaa(chr3:42190979,42191004)(seqid no:6)作为反向引物来进行扩增。
本文地址:https://www.jishuxx.com/zhuanli/20241120/333350.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。