一种根癌农杆菌介导杜梨遗传转化体系的建立方法
- 国知局
- 2024-12-06 12:42:57
本发明属于植物转基因,主要涉及在进行苹果亚属梨砧木杜梨的基因功能和基因编辑研究时,以杜梨叶片、叶柄为外植体的根癌农杆菌介导的遗传转化体系,具体公开了一种根癌农杆菌介导杜梨遗传转化体系的建立方法。
背景技术:
1、我国主要野生梨砧木资源中应用最广的砧木品种有杜梨(pyrus betuleafolia)、豆梨(pyrus calleryana)、川梨(pyrus pashia)等,不同砧木适应性和适应气候条件存在差异,其中杜梨适应性最广,与白梨(pyrus bretschneideri)、砂梨(pyrus pyrifolia)、秋子梨(pyrus ussuriensis)和西洋梨(pyrus communis)都具有较好的亲和性。梨树体高大,通过矮化砧矮化栽培可有效降低人工成本和建园设施投入。梨矮化栽培最早应用于东欧、美洲等地的西洋梨栽培中,大部分采用榅桲矮化栽培,有效控制树体生长、早花早果、提高果实品质等。但榅桲根系浅、耐盐碱性弱,易产生缺铁性黄化病,且与东方梨嫁接亲合性差。为开发适于国内栽培的梨矮化砧木,自上世纪八十年代起,通过杂交选育的方式开展梨砧木新品种培育工作。现阶段培育品种主要有:中矮1~3号、青砧d3号等,主要通过自然群体或杂交群体筛选,筛选效率较低(姜淑苓等1991,1999,2003),目前还未大规模应用,适应性还需进一步验证。砧木育种已成为果树育种的重要组成部分。我国可应用梨砧木品种较少,随着分子生物学的发展,通过基因改良的方法进行梨砧木育种,有利于加快步伐。通过建立稳定高效的杜梨遗传转化体系,是基因编辑技术的基础,有助于基因功能研究和梨砧木新种质的创制。
2、以杜梨为代表的遗传转化体系、基因编辑体系已取得较大发展(叶宇等,2022;宋平丽等,2022;杨冠宇等,2022)。但杜梨遗传转化效率还较低,目前仅杜梨子叶和豆梨子叶、砀山酥梨叶片获得10~20%左右的转化率,杜梨叶片外植体转化率为0%,叶柄外植体转化还未有报道(杜宜南等,2018)。应用于基因编辑中的遗传转化外植体也主要为子叶。但子叶外植体来源于种子,遗传背景复杂,影响稳定转化材料的获得。
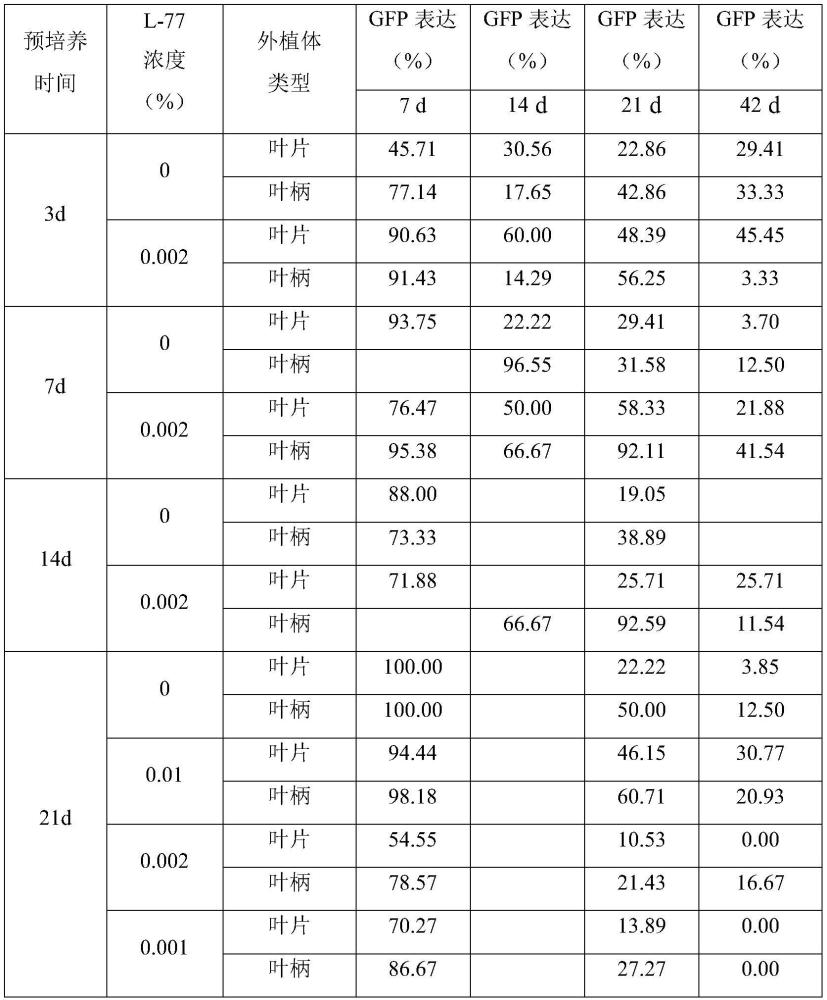
3、种子或组培苗子叶、叶片和叶柄外植体,在不同生长时期存在较大差异,当组织处于幼嫩且肥厚的阶段时,处于生长的旺盛期,原生细胞的数量和分化速度增加。因此通过合适的培养基和培养条件,获得良好的组培苗生长时期和状态,合适组织部位和切割方法是获得稳定遗传转化效率的基础。此外,有研究报道,一些维持原生细胞状态的组织,如叶脉、叶柄和茎等维管组织的髓部等处的细胞具有更强的分化和再生能力,这些部位最先进入伤口愈合、愈伤诱导和生长的状态。进入再分化阶段后,也通常为叶柄和叶片主脉切口部位,或叶表皮远轴端表皮上最先形成再生芽。外植体通过预培养一定时间后能促进遗传转化效率的提高,但杜梨叶片和叶柄外植体所需的预培养时间还未知。
4、包含gfp荧光表达蛋白的工程菌株常用于植物遗传转化体系构建,可快速、实时、无损检测遗传转化效果。工程菌株的类型、od600值、侵染时的附加物等,均影响侵染和遗传转化效果。适宜浓度的表面活性剂l-77处理一定时间后能提高细胞膜的透性,有利于外源基因的插入。看护培养能促进植物的生长、分化和提高再生频率。共培养阶段,通过加入as能促进双子叶植物的转化。但一些转化效率高的植物,其汁液中是否存在含有利于转化的物质,是否利于遗传转化效率的增加还未知。我们前期研究表明,与其它植物不同,杜梨在脱分化培养阶段易受光的影响,光强越强越易产生光敏色素,影响愈伤的生长、愈伤由脱分化向再分化的转变。在此阶段光照强度、培养时间、培养基成分等参数均对转化效率产生着影响。
5、基于此,研发了本技术。
技术实现思路
1、本发明目的在于克服现有技术缺陷,提供一种根癌农杆菌介导杜梨遗传转化体系的建立方法。该方法以杜梨叶片、叶柄为外植体通过根癌农杆菌介导获得一套稳定高效的杜梨遗传转化体系,可以有效提高转化效率,为梨属植物的遗传转化和基因编辑研究奠定。
2、为实现上述目的,本发明采用了以下技术方案:
3、一种根癌农杆菌介导杜梨遗传转化体系的建立方法,其包括如下步骤:
4、1)杜梨叶片和叶柄外植体的获得:
5、2)叶片外植体的预培养:将灭菌好的脱分化培养基分装至培养皿中,轻放一张灭菌滤纸在脱分化培养基上,将切好的叶片外植体轻放至灭菌滤纸上且叶片外植体近轴面朝上,置于25±3℃暗培养2-4d后备用;
6、3)叶柄外植体的预培养:将灭菌好的脱分化培养基分装至培养皿中,轻放一张灭菌滤纸在脱分化培养基上,将叶柄外植体平放,置于25±3℃暗培养6-8d后备用;
7、4)侵染菌液的制备:于外植体侵染前2-4d,挑取活化好携带有目的基因的根癌农杆菌单菌落,接种至含20-60mg/l kan和20-60mg/l rif(即含相应菌株抗性和目的基因抗性的抗生素)的lb液体培养基中,置于恒温摇床上25±3℃培养至农杆菌浓度为od600=0.7-0.9;可以取10ml菌液加入到50ml新鲜lb培养基培养3-5h,转移至50ml灭菌离心管中,平衡后离心10-30min,倒去上清液,用新鲜lb液体培养基重悬,调整菌液od600=0.4-0.6,加入0.001-0.003%表面活性剂l-77和45-55mg/l as,置于恒温摇床25±3℃培养1-3h后,获得侵染菌液,备用;
8、5)共培养看护培养液的制备:于外植体侵染前30min内,取增殖培养20-30d的矮牵牛组培苗厚实嫩叶,将嫩叶置于灭菌研钵中,加入研磨液研磨成汁,再加入0.001-0.003%表面活性剂l-77和45-55mg/l as研磨混匀后,备用;
9、6)侵染:在侵染菌液中加入表面活性剂l-77,将制备好的侵染菌液倒入无菌培养皿中,将完成预培养的外植体转入侵染菌液,侵染20-45min后,将外植体转至灭菌滤纸上,吸除表面菌液,然后将外植体转至表面覆盖有灭菌滤纸的共培养基上,再用一张新的灭菌滤纸吸附共培养看护培养液后覆盖至外植体上方,获得共培养外植体;
10、7)共培养:将共培养外植体,置于25±3℃暗培养2-4d后,经除菌清洗、选择培养脱分化培养阶段、选择培养再分化培养阶段、增殖培养、生根培养和炼苗移栽,即得。
11、具体的,步骤1)中,叶片外植体取材要求:取杜梨壮苗培养15-25d后的幼嫩且厚实叶片,用解剖刀切断叶片和叶柄连接处,沿叶中脉垂直方向切断叶中脉至一侧叶边缘,获得叶片外植体;叶柄外植体的取材要求:用解剖刀切去叶柄基部后切成0.5-1cm小段,获得叶柄外植体;所述壮苗培养基为ms+0.5mg/l 6-ba+0.01mg/l naa+30g/l蔗糖+6.5mg/l琼脂粉,ph5.8。
12、具体的,步骤2)和3)中,所述脱分化培养基为:ms+0.5mg/l tdz+0.1mg/l naa+0.1mg/l iba+0.5mg/l iaa+0.5mg/l zt+1mg/l fa+150mg/l椰汁+30g/l蔗糖+6.5g/l琼脂粉,ph5.8。
13、具体的,步骤5)中,将3-6g嫩叶置于灭菌研钵中,加入8-15ml研磨液研磨成汁,再加入40-60mg/l as研磨混匀后备用;所述矮牵牛增殖培养基为:ms+0.01mg/l naa+30g/l蔗糖+6.5mg/l琼脂粉;所述研磨液为1/2ms液体培养基。
14、具体的,步骤6)中,侵染叶片时,侵染菌液中加入0.001-0.004%表面活性剂l-77;侵染叶柄时,侵染菌液中加入0.01-0.04%表面活性剂l-77;所述共培养基为:脱分化培养基+50mg/l as。
15、进一步的,步骤7)中,所述除菌清洗具体为:取出共培养过的共培养外植体并转入含350-450mg/l cef的1/2ms液体培养基中,搅拌浸泡5-30min后,转入新的灭菌滤纸上吸干表面菌液,备用。
16、进一步的,步骤7)中,所述选择培养脱分化培养阶段具体为:将除菌清洗过的共培养外植体转入含20-50mg/l kan和200-300mg/l cef的脱分化培养基中,置于25±3℃暗培养25-35d后,更换一次培养基,继续置于25±3℃、16h光照/8h弱光培养25-35d,光照强度10-20μmol·m2·s-1。
17、进一步的,步骤7)中,所述选择培养再分化培养阶段具体为:将完成选择培养脱分化培养阶段的外植体转入含20-50mg/l kan和200-300mg/l cef的再分化培养基中,置于25±3℃、16h光照/8h黑暗培养,光照强度20~40μmol·m2·s-1,培养至长出再生芽,每25-35d更换一次培养基;所述再分化培养基为:ms+5mg/l6-ba+0.05mg/l iba+1mg/l fa+1mg/l zt+30g/l蔗糖+6.5g/l琼脂粉,ph5.8。
18、进一步的,步骤7)中,所述增殖培养具体为:将长至1-2cm、具有完整茎结构的再生芽,沿茎基部从外植体上切下,获得单株抗性株系,转至含350-450mg/l cef的增殖培养基中培养;所述增殖培养基为:ms+0.5mg/l 6-ba+0.01mg/l naa+30g/l蔗糖+150ml椰汁+6.5mg/l琼脂粉,ph5.8。
19、进一步的,步骤7)中,所述生根培养具体为:每个株系取3-5个长至2-3cm的植株,沿茎基部从外植体上切下,转至含350-450mg/l cef的生根培养基中培养;所述生根培养基为:ms+0.2mg/l iba+30g/l蔗糖+6.5mg/l琼脂粉,ph5.8。
20、进一步的,步骤7)中,所述炼苗移栽具体为:将生根苗取出,自来水冲洗干净根部培养基,移栽至颗粒径≤0.5cm的营养土中,覆膜10-20μmol·m2·s-1弱光培养7-10d后,揭膜并转入100-200μmol·m2·s-1正常光培养;在移栽20-40d后浇水溶复合肥,促进移栽苗生长。
21、在构建杜梨遗传转化体系的过程中,外植体的取材时期、取材部位、预培养时间、侵染菌液、共培养添加试剂和处理方法、除菌清洗、选择脱分化培养阶段和再分化培养阶段的培养时间、光照强度等是获得稳定高效转化率的关键。通过试验表明,原来的一些相关参数与条件还有待进一步优化。
22、本发明通过优化不同外植体取材条件、取材时间和预培养时间,获得最适于侵染的各类外植体材料;通过比较侵染菌液加入不同附加物后的侵染效果,筛选最佳侵染菌液;通过在共培养阶段比较不同看护培养液对侵染效果的影响,筛选最佳共培养方案;通过控制选择脱分化培养和选择再分化培养基阶段的光照条件,培养基成分和培养基更换频率等,提高杜梨叶片、叶柄外植体的遗传转化效率;创新使用了表面活性剂l-77制备侵染菌液和侵染方法,创新了共培养看护培养液的制备与使用方法,有效提高了遗传转化效率。本发明整体目标在于构建了一套稳定高效的根癌农杆菌介导杜梨遗传转化体系,为梨属植物的遗传转化和基因编辑研究了奠定。该方法可应用于梨基因编辑技术、基因功能和新种质创制研究等。
23、和现有技术相比,本发明的有益效果如下:
24、本发明通过稳定外植体获取方法和预培养获得合适最佳的侵染外植体材料,通过优化侵染菌液附加物、共培养看护培养液制作方法和附加物、选择培养脱分化与再分化两阶段的培养基、培养周期、光照条件等控制,降低了光敏色素产生对再生的影响,提高了遗传转化频率。本发明通过构建一套完整高效稳定的根癌农杆菌介导杜梨遗传转化体系,为加快梨基因编辑体系的建立、梨新种质创制和功能基因研究奠定了基础。
本文地址:https://www.jishuxx.com/zhuanli/20241204/342608.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表