用于治疗登革热感染的给药方案的制作方法
- 国知局
- 2025-01-10 13:28:21
发明领域本发明提供了用于治疗或预防登革热病毒感染的有利的治疗组合物、其组合及其用途。
背景技术:
0、发明背景
1、登革热是由四种相关病毒引起的,称为登革热病毒血清型1-4。登革热病毒(denv)是黄病毒科黄病毒属的成员。它们是包膜病毒,具有11kb的正义rna基因组,可编码十种蛋白质。这些蛋白质是膜(m)蛋白、包膜(e)蛋白、衣壳(c)蛋白和非结构(ns)蛋白。ns蛋白是ns1、ns2a、ns2b、ns3、ns4a、ns5b和ns5。这些蛋白质被翻译成单一的多聚蛋白,其被蛋白酶切割成单个蛋白质。ns5蛋白是最大的非结构蛋白,充当病毒rna依赖性rna聚合酶以及rna2'-o-甲基转移酶。rna依赖性rna聚合酶(rdrp)活性负责病毒基因组的复制。
2、登革热是热带地区的地方性流行病,包括东地中海、美洲、东南亚、西太平洋和非洲。随着携带登革热的伊蚊分布范围扩大,以前从未发现过登革热的地区也出现了新病例。美国疾病控制与预防中心报告称,最近在夏威夷(2015年)、佛罗里达(2013年、2020年)和德克萨斯(2013年)爆发了本地感染登革热疫情(https://www.cdc.gov/dengue/areaswithrisk/in-the-us.html)。携带登革热的蚊子现在在美国东南部大部分地区都很常见(rivera等人.2020.travel-associated and locally acquired dengue cases-united states,2010-2017.mmwr morb mortal wkly rep 69:149-154)。
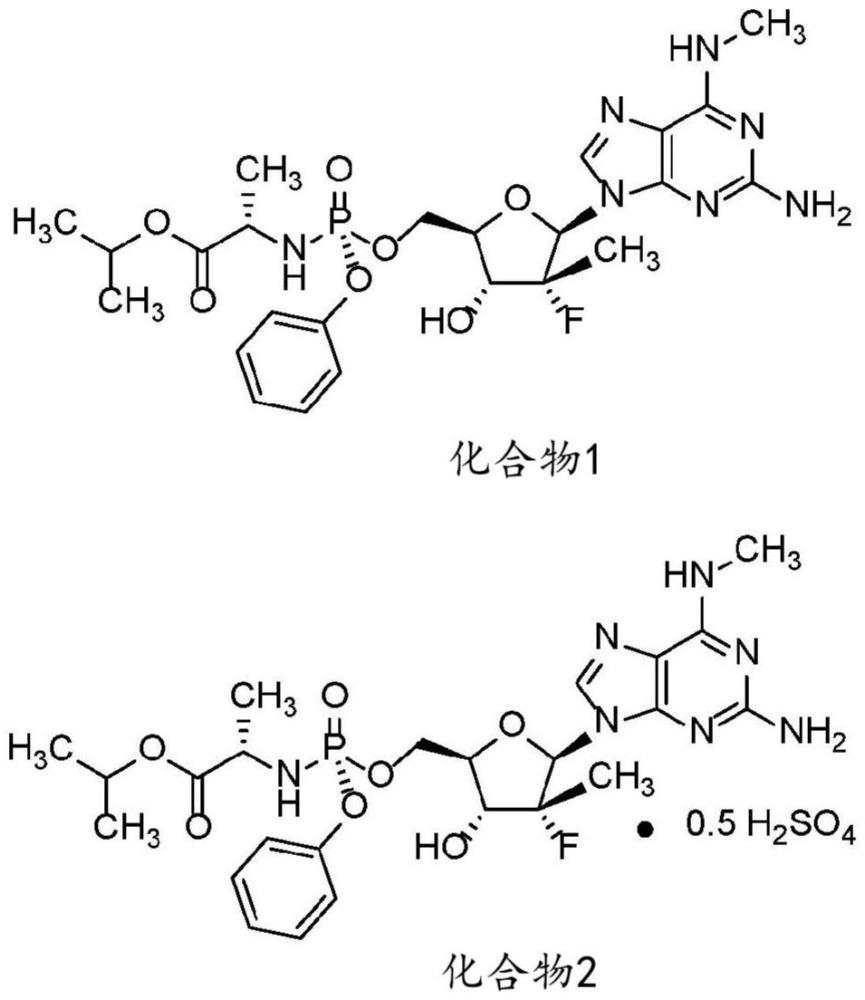
3、尽管以前登革热血清型的分布仅限于特定地区,但随着疾病在世界范围内传播,血清型的分布也变得更加普遍(《自然》杂志“登革热病毒”)。这尤其令人担忧,因为如果一个人感染了一种血清型,后来又感染了第二种血清型,他们患上严重登革热的风险就会更大。严重登革热(或登革出血热)伴有严重的血浆渗漏、严重出血、休克和器官受损。如果不治疗,严重登革热的死亡率为13%(疾病控制和预防中心,dengue for healthcareproviders,clinical presentation,2023年4月13日更新)。
4、除了登革热疫情的地理分布外,最近的疫情更为严重。自2000年以来,全球发病率增加了8倍。不仅疫情爆发的频率增加了,而且规模也增加了。世界卫生组织估计,全球一半人口面临感染风险,每年有数亿人感染(https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue)。还报告了近50万例严重登革热病例。大多数面临感染登革热风险的人是儿童(aranda c等人,2018.arbovirus surveillance:first denguevirus detection in local aedes albopictus mosquitoes in europe,catalonia,spain,2015.euro surveill 23,wilder-smith等人,2014.the 2012dengue outbreak inmadeira:exploring the origins.euro surveill 19:20718)。
5、针对登革热的疫苗已经研发出来,但存在一些缺点。最显著的是一种被称为抗体依赖性增强(ade)的现象。唯一获得许可的疫苗dengvaxia针对不同血清型提供的保护不全面(https://www.fda.gov/news-events/press-announcements/first-fda-approved-vaccine-prevention-dengue-disease-endemic-regions)且不均衡,对denv1的保护率仅为50%,对denv2的保护率更低(sabchareon等人,2012.protective efficacy of therecombinant,live-attenuated,cyd tetravalent dengue vaccine in thai schoolchildren:a randomized,controlled phase 2b trial.lancet 380:1559-67;villar等人,2015.efficacy of a tetravalent dengue vaccine in children in latinamerica.n engl j med.372:113-23)。因此,接种疫苗可能会促进ade,从而导致未感染登革热的个体出现严重感染(aguiar等人,2016.the impact ofnewly licensed denguevaccine in endemic countries.plos negl trop dis.10:e0005179)。因此,疫苗接种仅限于9-16岁且至少有过一次登革热病毒感染记录的个体。尽管登革热病毒目前已成为全球范围内的健康威胁,且其重要性日益凸显,但安全有效的泛登革热疫苗尚未研制成功。
6、因此,全球范围内对抗登革热的潜在策略是药物,例如直接作用抗病毒药物(daa)。不幸的是,目前还没有批准用于治疗登革热的daa。在denv中,病毒聚合酶是非结构蛋白ns5(karuna等人,2020年,acyclic phosphoramidate prodrug of 2’-deoxy-2’-fluoro-2’c-methylguanosine for the treatment of dengue virusinfection.antimicrob agents chemother 64)。尽管denv rdrp已成为许多研究性daa的靶点,包括许多核苷/核苷酸类似物(troost等人,2020.recent advances in antiviraldrug development towards dengue virus.curr opin virol 43:9-21),但迄今为止,只对一种核苷即胞嘧啶类似物巴拉匹韦进行了临床测试(karuna等人,2020.acyclicphosphoramidate prodrug of 2’-deoxy-2’-fluoro-2’c-methylguanosine for thetreatment of dengue virus infection.antimicrob agents chemother 64;nguyen等人,2013.arandomized,double-blind placebo-controlled trial of balapiravir,apolymerase inhibitor,in adult dengue patients.j infect dis.207:1442-50)。不幸的是,在抗病毒反应、细胞因子谱和退烧时间方面,化合物治疗和安慰剂治疗之间没有观察到差异(nguyen等人,2013.arandomized,double-blind placebo-controlled trial ofbalapiravir,a polymerase inhibitor,in adult dengue patients.j infect dis.207:1442-50)。
7、文献中还报道了其他靶向ns5或其他病毒蛋白的化合物。在2017年,janssen公开了一系列与ns3蛋白结合的化合物(wo 2017/167951)。在2020年,manfroni实验室描述了抑制ns5的吡啶并苯并噻唑酮(cannalire,r.等人.pyridobenzothiazolones exert potentanti-dengue activity by hampering multiple functions of ns5 polymerase,acsmed chem lett,2020 11,773-782)。描述登革热抑制剂的其他出版物包括但不限于moquin等人,nitd-688,apan-serotype inhibitor of the dengue virus ns4b protein,showsfavorable pharmacokinetics and efficacy in preclinical animal models.sciencetranslational medicine,2021,13,579;kaptein,s.等人apan-serotype dengue virusinhibitor targeting the ns3-ns4b interaction.nature,2021,598,504-509;shimizu,h.等人discovery of a small molecule inhibitor targeting dengue virus ns5 rna-dependent rnapolymerase.plos negl trop dis.2019,13,e0007894;yin,z.等人anadenosine nucleoside inhibitor of dengue virus,pnas,2009,106,20435-20439;putra,h.等人identification of natural product compounds as ns5 rdrp inhibitorfor dengue virus serotype 1-4through in silico analysis.aip conferenceproceedings 2020,2237;wang,q.-y.等人a small-molecule dengue virus entryinhibitor.antimicrobial agents and chemotherapy,2009,53,1823-1831;deoliviera,l.等人the small molecule azd6244 inhibits dengue virus replicationin vitro and protects against lethal challenges in a mouse model.2020,archives of virology,doi:10.1007/s00705-020-04524-7;和celegato,m.等人small-molecule inhibitor of flaviviral ns3-ns5 interaction with broad-spectrumactivity and efficacy in vivo,antimicrobial chemotherapy,2022 14(1)e03097-22。
8、治疗某些rna病毒的特定抗病毒化合物包括化合物1和化合物2。例如,在美国专利号9,828,410中公开了游离碱化合物1。
9、
10、化合物2(公开于美国专利号10,519,186中)是((r)-(((2r,3r,4r,5r)-5-(2-氨基-6-(甲基氨基)-9h-嘌呤-9-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基)-l-丙氨酸异丙酯的半硫酸盐,并且特别公开了其用于治疗病毒感染,例如丙型肝炎病毒。据报道化合物2还对sars-cov2(covid19感染的病原体)具有活性(参见例如美国专利10,874,687)。化合物2的s-磷非对映异构体目前正在进行人体临床试验,用于治疗hcv和covid19。
11、
12、在美国专利号10,946,033中,atea pharmaceuticals,inc.公开了化合物1或化合物2通常用于治疗黄病毒的用途,并具有针对黄热病、登革热(血清型2)、西尼罗病毒和寨卡病毒的活性数据。
13、尽管有这些披露,但由于上述挑战性问题,有效治疗登革热仍很困难。医学上仍然迫切需要确定安全、有效和耐受性良好的治疗登革热的适当方案。
14、因此,本发明的目的是提供治疗登革热感染的有利方案。本发明的另一个目的是提供化合物1和化合物2(其为磷r-非对映异构体)的新制备方法。
技术实现思路
1、意外地发现,当将高剂量(即,每剂至少约700mg或750mg,更通常为700-1000mg(为了方便,可以以一个、两个或三个单独的剂型递送),每日两次、三次或更多次)的化合物1或化合物2(其中化合物1可以是其药学上可接受的盐)施用于有此需要的宿主(例如人类)时,有利于治疗登革热病毒。在典型的实施方案中,化合物1或化合物2以一种或多种药物组合物提供以达到此有效量。
2、此外,还发现化合物1或化合物2还对登革热血清型1、3和4具有活性。通过这一新发现,证实了本文所述的高剂量方案中的化合物1和化合物2对所有血清型的登革热病毒(登革热病毒血清型1、2、3和4)均具有效力。
3、
4、本说明书中使用的术语“化合物1”可以指其游离碱或其药学上可接受的盐。化合物1是((r)-(((2r,3r,4r,5r)-5-(2-氨基-6-(甲基氨基)-9h-嘌呤-9-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)(苯氧基)磷酰基)-l-丙氨酸异丙酯。
5、还发现化合物1(及其半硫酸盐化合物2)具有有利的双重作用机制。活性代谢物是病毒蛋白ns5的rna依赖性rna聚合酶(rdrp)域的抑制剂,也是ns5的2'-o-甲基转移酶(mtase)域的抑制剂。ns5蛋白的两种功能都是复制所必需的。抑制参与rna复制的两种关键蛋白质功能可降低形成抗性突变体的机会。
6、如实施例2中所述以及表1和图2中所示,已发现化合物1(at-281)对所有四种登革热血清型均表现出体外效力,包括血清型1(ec50=0.57μm)、血清型2(多种菌株中ec50<7μm)、血清型3(多种菌株中ec50<1.5μm)和血清型4(多种菌株中ec50<1.2μm)。泛血清型活性是有利的,因为它将严重登革热的风险降至最低,并减少或消除了在施用该化合物之前进行血清型测试的需要。
7、或者,化合物1可以以游离碱形式或任何所需的药学上可接受的盐形式用于本文所述的高剂量方案。化合物2是化合物1的半硫酸盐,其是具有改进的体内特性的化合物1的有利形式。例如,化合物2在登革热感染(d2y98p病毒株)的小鼠模型中体内有效,如实施例18所述。例如,使用化合物2可在感染后(pi)第6天和第8天观察到图8a所示血液中和图8b所示脾脏中的病毒血症有显著差异。此外,与载体对照处理的动物相比,在感染后第3天至第8天观察到图9a所示体重减轻和图9b所示健康评分恶化的显著预防效果。重要的是,如图10所示,存活时间显著延长,这证明了化合物2对抗登革热病毒的功效,或者化合物1作为游离碱或其药学上可接受的盐的功效。
8、在某些方面,化合物2或化合物1(作为游离碱或其药学上可接受的盐)通常以本文所述的高剂量方案施用于患者,其中该患者患有多种黄病毒,其中一种黄病毒是登革热,例如患者患有登革热血清型1、2、3或4和另一种黄病毒。化合物1(at-281)在降低3种不同细胞类型中体外测试的7种黄病毒的11种不同菌株的病毒滴度方面表现出强效作用,0.21至1.41μm的浓度范围可实现对病毒诱导的细胞病变效应(cpe)的50%抑制(表1和图2)。
9、如实施例10所述和图1所示,化合物2或化合物1的活性代谢物(化合物5)充当gtp类似物,并通过ns5 rna依赖性rna聚合酶(rdrp)掺入rna,从而立即终止合成。
10、
11、使用所有四种denv血清型,在竞争性核苷酸掺入试验中测量了化合物5的链终止效率。与天然底物三磷酸鸟苷相比,化合物5掺入rna的量少9到12倍(即每掺入约7-8个gtp,就会掺入一个at-9010)。相比之下,每掺入100个utp(天然三磷酸尿苷),三磷酸索非布韦会掺入不到1次rna。
12、鉴别试验数据如下。
13、 偏好 denv1 denv2 denv3 denv4 gtp>at-9010 7.7±0.5 9.3±0.1 11.6±1.3 11.2±0.7 gtp>at-9002 19.4±2.8 18.2±0.2 17.5±1.5 41.5±7.3 utp>sof-tp >100 >100 >100 >100
14、化合物5(以及化合物1和化合物2)也是登革热病毒ns5的2'-o-甲基转移酶(mtase)结构域的抑制剂。mtase结构域负责封闭复制的病毒rna的2'端。rna帽可减轻宿主对病毒rna的免疫反应。抑制mtase结构域是化合物5的第二种作用机制。
15、通过热位移分析测量了化合物5与mtase结构域的结合。化合物5对denv1、denv2、denv3和denv4 mtase结构域的稳定性几乎是之前报道的mtase抑制剂西奈芬净(sinefungin)的两倍(西奈芬净为1.9±0.1℃,而化合物5为3.8±0.1℃)。
16、此外,化合物5比天然底物三磷酸鸟苷更有效地稳定了rdrp结构域(化合物5为5.6±0.1℃,而gtp为4.5±0.2℃),而西奈芬净对rdrp结构域的稳定作用可忽略不计(0.1℃±0.1℃)。
17、确认化合物5针对mtase结构域的活性,在过滤结合试验中测得的ic50为29.6+2μm。之前已证明化合物5在细胞中的浓度可达数百微摩尔(good,s.等人preclinicalevaluation of at-527,a novel guanosine nucleotide prodrugwith potent,pan-genotypic activity against hepatitis c virus,plos one 15(1):e0227104),ic50为29.6μm表明化合物5是mtase结构域的有效抑制剂。
18、因此,化合物5(其是化合物2和化合物1的活性代谢物)具有多种对抗登革热病毒的作用机制。多种作用机制可能阻止耐药性的产生,尤其是针对高度保守的mtase结构域。
19、在本发明的某些方面中,式i化合物或其药学上可接受的盐任选地在药学上可接受的载体中,以高剂量(每剂至少700或750mg,例如每剂700-1000mg(其可以为方便吞咽提供1、2、3或4种不同的剂型),每日两次、三次或更多次)施用,以治疗有此需要的宿主(通常是人类)的登革热病毒感染:
20、
21、其中:
22、r2为c1-6烷基(包括甲基、乙基、丙基和异丙基)、c3-7环烷基、芳基、芳基(c1-c4烷基)-、杂芳基、杂芳基(c1-c4烷基)-或杂烷基,其各自任选地被1、2、3或4个取代基取代,所述取代基在每种情况下独立地选自r22;
23、r3为氢或任选取代有1、2、3或4个取代基的c1-6烷基,所述取代基在每种情况下独立地选自r33;
24、r4a和r4b独立地选自氢、c1-6烷基、芳基(c1-6烷基)-、c3-7环烷基、c3-7环烷基(c1-6烷基)-、杂芳基(c1-6烷基)-和芳基,其每个任选地被1、2、3或4个取代基取代,所述取代基在每种情况下独立地选自r44;
25、r5为氢、c1-6烷基(包括甲基、乙基、丙基和异丙基)、c1-6卤代烷基或c3-7环烷基,且在替代性实施方案中,r5为芳基(c1-c4烷基)-、芳基、杂芳基或杂烷基,其任选地被1、2、3或4个取代基取代,所述取代基在每种情况下独立地选自r55;
26、r22、r33、r44和r55在每种情况下独立地选自氢、c1-c6烷基、c3-c7环烷基、烯基、炔基、f、cl、br、i、杂环、杂环烷基、卤代烷氧基、卤代烷基、c(o)r66、c(o)or66、c(o)n(r66)2和氰基;
27、r66在每种情况下独立地选自氢、c1-c6烷基、芳基(c1-c6烷基)-、c3-c7环烷基、c3-c7环烷基(c1-c6烷基)-、杂芳基(c1-c6烷基)-和芳基。
28、在本发明的某些方面中,式ii化合物或其药学上可接受的盐任选地在药学上可接受的载体中,以高剂量(每剂至少700-1000mg,例如每剂700-850mg,每日两次、三次或更多次)施用,以治疗有此需要的宿主(通常是人类)的登革热病毒感染:
29、
30、其中:
31、r3为氢或任选取代有1、2、3或4个取代基的c1-6烷基,所述取代基在每种情况下独立地选自r33;
32、r4a和r4b独立地选自氢、c1-6烷基、芳基(c1-6烷基)-、c3-7环烷基、c3-7环烷基(c1-6烷基)-、杂芳基(c1-6烷基)-和芳基,其每个任选地被1、2、3或4个取代基取代,所述取代基在每种情况下独立地选自r44;
33、r5为氢、c1-6烷基(包括甲基、乙基、丙基和异丙基)、c1-6卤代烷基或c3-7环烷基,且在替代性实施方案中,r5为芳基(c1-c4烷基)-、芳基、杂芳基或杂烷基,其任选地被1、2、3或4个取代基取代,所述取代基在每种情况下独立地选自r55;
34、r22、r33、r44和r55在每种情况下独立地选自氢、c1-c6烷基、c3-c7环烷基、烯基、炔基、f、cl、br、i、杂环、杂环烷基、卤代烷氧基、卤代烷基、c(o)r66、c(o)or66、c(o)n(r66)2和氰基;
35、r66在每种情况下独立地选自氢、c1-c6烷基、芳基(c1-c6烷基)-、c3-c7环烷基、c3-c7环烷基(c1-c6烷基)-、杂芳基(c1-c6烷基)-和芳基。
36、所有r基团均应以不包括冗余的方式进行解释,即如本领域所知,烷基不会被烷基取代;但是,例如被烷氧基取代的烷氧基不是冗余的。被芳基取代的芳基在有限的范围内落入芳基的定义。除非上下文中明确指出,否则r基团不是任选取代的。
37、c1-c6烷基的非限制性实例包括甲基、乙基、丙基、异丙基、丁基、叔丁基、仲丁基、异丁基、-ch2c(ch3)3、-ch(ch2ch3)2和-ch2ch(ch2ch3)2。c3-c6环烷基的非限制性实例包括环丙基、ch2-环丙基、环丁基和ch2-环丁基。
38、芳基(c1-c4烷基)-的非限制性实例是苄基。芳基的非限制性实例是苯基和萘基。
39、在某些方面,该化合物是式iia化合物或其药学上可接受的盐:
40、
41、其中所有变量如本文所定义。
42、在某些方面,该化合物是式iib化合物或其药学上可接受的盐:
43、
44、其中所有变量如本文所定义。
45、在某些方面,本文所述的选定化合物用于治疗登革热病毒感染,其可为血清型1、3和/或4。在一些实施方案中,本文所述的选定化合物用于治疗登革热病毒感染,其可为血清型1、2、3和/或4,通过向有此需要的患者施用约700-1000mg(例如每剂700-850mg)的剂量,每日两次、三次或更多次(并且在一些实施方案中,施用650、675、700、725、750、775、800、825、850、875、900、925、950、975或1000mg的剂量,每日两次或三次)来治疗。在某些实施方案中,化合物1或化合物2以约700-1000mg的剂量施用,例如每次给药至少约700、750或800mg(其可以以多种固体剂型递送以达到全剂量)。
46、在特定实施方案中,化合物2以每日两次、每次三个250mg游离碱重量的固体剂型的剂量递送,以达到750mg的总剂型剂量。在其他实施方案中,化合物2以每日两次、每次两个375mg固体剂型的剂量递送,以达到750mg的总剂型剂量。
47、在某些实施方案中,将化合物1或化合物2每日给药两次、三次或四次,持续四天、五天、六天、七天、八天、九天或十天。在某些实施方案中,该治疗方案可治疗登革热病毒血清型1、3和/或4,或甚至1、2、3和/或4。为清楚起见,除非另有说明,施用的活性化合物的毫克剂量基于核苷酸氨基磷酸酯(nucleotide phosphoramidate)的盐的重量(如果使用药学上可接受的盐)。出于换算目的,约750mg剂量的化合物2对应于约692mg剂量的化合物1(在“约700mg”的范围内),化合物1为游离碱形式。
48、本发明包括治疗和预防性(prophylactic或preventative)疗法。在一些实施方案中,根据本文提供的高剂量方法,将本文所述的活性ns5rdrp抑制化合物作为预防剂施用于已暴露于登革热病毒感染(例如登革热1型病毒、登革热2型病毒、登革热3型病毒和/或登革热4型病毒)并因此有感染登革热病毒感染风险的宿主(例如人类)。在另一替代实施方案中,提供了预防传播的方法,包括在暴露于可能被感染的人群之前(包括在旅行或公共活动或会议期间)向人类施用本文所述的高剂量有效量的本文所述的化合物之一持续足够长的时间,包括例如在传染性情况发生前最多3、5、7、10、12、14天或更多天。
49、本发明还提供了用于可扩展制备化合物1的立体选择性方法,其中rp非对映异构体以基本纯的形式生成。非对映异构体的基本上纯的形式通常是指rp非对映异构体相对于sp非对映异构体至少约90%或更多。式中间体a、中间体b的化合物与基于脲的活化剂(例如1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu))的反应优先形成sp氨基磷酸酯中间体c。wo 2022/040473a1中描述了类似的方法,该专利已转让给atea pharmaceuticals,其中所需产物是sp氨基磷酸酯。
50、
51、中间体c的氨基磷酸酯上的芳氧基被一个、两个或三个r6基团取代,从而激活它例如通过吸电子作用进行置换。在第二步中,活化的苯氧基离去基团被苯酚替换,从而反转磷立体化学以形成化合物1。
52、在某些实施方案中,基本上纯的r-磷非对映异构体的纯度为约93%或更高、纯度为约95%或更高、纯度为约98%或更高或者甚至纯度为99%或更高。
53、在某些实施方案中,将700mg至1,000mg剂量以三种固体剂型施用于需要治疗登革热的患者,其中将总计约700mg至约1,000mg固体剂型的化合物1或2每日施用两次(每日共六粒)。在某些实施方案中,将总计约700mg至约1,000mg的三种固体剂型的化合物1或2连续施用四天、五天、六天或七天。在某些实施方案中,将总计约700mg至约1,000mg的三种固体剂型的化合物1或2连续施用八天、九天、十天、十一天、十二天、十三天或十四天。
54、在某些实施方案中,将组合物b连续施用四、五、六或七天。在某些实施方案中,将组合物a连续施用八、九、十、十一、十二、十三或十四天。
55、在一些实施方案中,化合物1或其药学上可接受的盐用于组合物a或组合物b。
56、在某些实施方案中,将化合物1或化合物2每日施用两次,剂量至少约675、700、725、750、775、800、825、850、875、900、925、950、975或1000mg,其中作为示例性实例,每8+/-2小时施用一次化合物。
57、在某些方面,本文所述的给药方案是在症状出现后四、三天、两天或一天内给药。在某些实施方案中,本文所述的给药方案是在症状出现后48小时内给药。
58、因此,本发明包括以下特点:
59、(a)化合物1或化合物2的给药方案包括每日两次或三次向患有登革热血清型1、2、3和/或4的患者施用每剂至少约675-1000mg或700-1000mg,例如675、700、725、750、775、800、825、850、875、900、925、950、975或1000mg的化合物1或化合物2。
60、(b)如本文进一步描述的对登革热血清型1、3或4的治疗。
61、(c)化合物1或化合物2的给药方案包括每日两次或三次向患有登革热血清型1、3和/或4的患者施用每剂至少约675-1000mg,例如675、700、725、750、775、800、825、850、875、900、925、950、975或1000mg的化合物1或化合物2。
62、(d)(a)、(b)或(c)的给药方案,其中将化合物1或化合物2连续施用三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天、十四天或十五天。
63、(e)(a)、(b)或(c)的给药方案,其中将化合物1或化合物2以约750mg的剂量每日三次施用十四天。
64、(f)(a)、(b)或(c)的给药方案,其中将化合物1或化合物2以按游离碱重量计约750mg的剂量每日三次施用持续五天。
65、(g)(a)或(b)的给药方案,其中化合物1或化合物2以按游离碱重量计约1,000mg的剂量每日两次施用持续五天、六天或七天。
66、(h)(a)-(g)中任一项的给药方案,其中将化合物2施用于患者。
67、(i)(h)的给药方案,其中将约675mg至1,000mg的剂量以三种固体剂型给药。
68、(j)(a)-(g)中任一项的给药方案,其中将化合物1施用于患者。
69、(k)治疗有此需要的患者中登革热的方法,该方法包括按照(a)-(j)中任一项的给药方案施用化合物1或化合物2。
70、(l)(k)的方法,其中该给药方案包括施用包含化合物1或化合物2的药物组合物。
71、(m)(a)-(k)中任一项的给药方案在制备用于治疗登革热的药物中的用途。
72、(n)(l)或(m)的用途,其中该给药方案包括施用包含化合物1或化合物2的药物组合物。
73、(o)治疗有此需要的患者中登革热的方法,该方法包括根据本文描述的高剂量方案施用式i化合物。
74、(p)治疗有此需要的患者中登革热的方法,该方法包括根据本文所述的高剂量方案施用式ii、式iia或式iib的化合物。
75、(q)制备化合物1或2的方法,包括如上所述使式中间体a、中间体b的化合物与脲基活化剂(例如1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu))以优先形成sp氨基磷酸酯中间体c的方式发生反应,然后在第二步中,用苯酚替代活化的苯氧基离去基团,从而反转磷立体化学以形成r-磷非对映异构体构型的化合物1。
76、(r)(q)的方法,其中基本上纯的r-磷非对映异构体的纯度为约93%或更高、约95%或更高、约98%或更高、或者甚至99%或更高。
本文地址:https://www.jishuxx.com/zhuanli/20250110/353319.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。