抗BDCA2抗体及其制备方法和应用与流程
- 国知局
- 2024-09-19 14:45:19
本公开涉及生物、医药领域。具体而言,本公开涉及一种特异性结合人bdca2的抗体,尤其是特异性结合人bdca2的兔源抗体及其人源化抗体。
背景技术:
1、bdca2(血液树突细胞抗原2,blood dendritic cell antigen 2)也称为clec4c或cd303,是c型凝集素家族的第4个成员,是一类含有213个氨基酸的新的二型跨膜糖蛋白。bdca2主要表达在浆细胞样树突状细胞(pdc)表面,其自然配体尚未明确。
2、bdca2细胞外部分包含c型碳水化合物识别结构域,可以与甘露糖、葡萄糖或n-乙酰葡糖胺结合,通过一种依赖于钙动员和蛋白酪氨酸的机制,有效地抑制了pdc中i型干扰素(ifn-i)的分泌。靶向bdca2的抗体可以使bdca2从pdc表面快速内化并减少包括i型干扰素在内的炎性细胞因子的产生,在自身免疫性疾病如系统性红斑狼疮(sle)中发挥重要作用。
技术实现思路
1、特异性结合人bdca2的抗体
2、一方面,本公开提供了特异性结合人bdca2的抗体或其抗原结合片段,其包含重链可变区(vh)和轻链可变区(vl),所述重链可变区和所述轻链可变区选自以下任一组:
3、所述重链可变区包含seq id no:33所示序列中的hcdr1、hcdr2、hcdr3;所述轻链可变区包含seq id no:34所示序列中的lcdr1、lcdr2、lcdr3;或
4、所述重链可变区包含seq id no:37所示序列中的hcdr1、hcdr2、hcdr3;所述轻链可变区包含seq id no:38所示序列中的lcdr1、lcdr2、lcdr3;或
5、所述重链可变区包含seq id no:31所示序列中的hcdr1、hcdr2、hcdr3;所述轻链可变区包含seq id no:32所示序列中的lcdr1、lcdr2、lcdr3;或
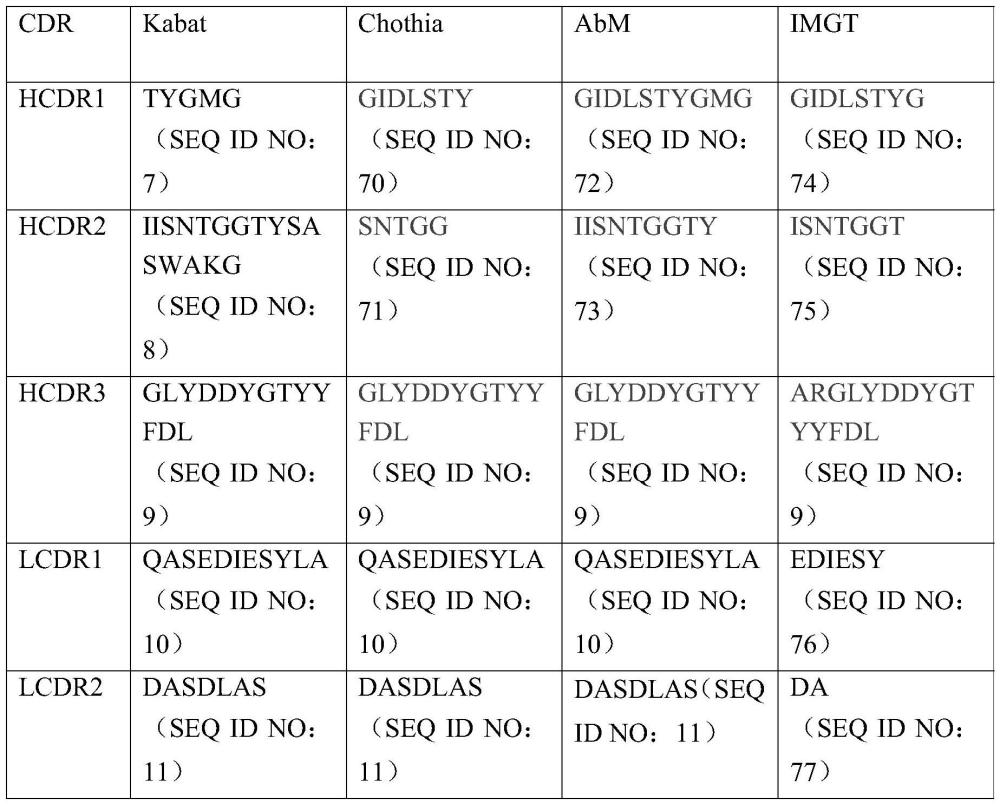
6、所述重链可变区包含seq id no:35所示序列中的hcdr1、hcdr2、hcdr3;所述轻链可变区包含seq id no:36所示序列中的lcdr1、lcdr2、lcdr3;或
7、所述重链可变区包含seq id no:39所示序列中的hcdr1、hcdr2、hcdr3;所述轻链可变区包含seq id no:40所示序列中的lcdr1、lcdr2、lcdr3;
8、在一些实施方案中,所述hcdr和所述lcdr按照kabat,chothia,abm或imtg编号系统确定。
9、在一些实施方案中,所述hcdr和所述lcdr按照kabat编号系统确定。
10、在一些实施方案中,如前所述的特异性结合人bdca2的抗体或其抗原结合片段,其包含重链可变区和轻链可变区;所述重链可变区和所述轻链可变区选自以下任一组:
11、1)所述重链可变区包含seq id no:1所示的hcdr1、seq id no:2所示的hcdr2、seqid no:3所示的hcdr3;和
12、所述轻链可变区包含seq id no:4所示的lcdr1、seq id no:5所示的lcdr2、seqid no:6所示的lcdr3;或
13、2)所述重链可变区包含seq id no:7所示的hcdr1、seq id no:8所示的hcdr2、seqid no:9所示的hcdr3;和
14、所述轻链可变区包含seq id no:10所示的lcdr1、seq id no:11所示的lcdr2、seqid no:12所示的lcdr3;或
15、3)所述重链可变区包含seq id no:13所示的hcdr1、seq id no:14所示的hcdr2、seq id no:15所示的hcdr3;和
16、所述轻链可变区包含seq id no:16所示的lcdr1、seq id no:17所示的lcdr2、seqid no:18所示的lcdr3;或
17、4)所述重链可变区包含seq id no:19所示的hcdr1、seq id no:20所示的hcdr2、seq id no:21所示的hcdr3;和
18、所述轻链可变区包含seq id no:22所示的lcdr1、seq id no:23所示的lcdr2、seqid no:24所示的lcdr3;或
19、5)所述重链可变区包含seq id no:25所示的hcdr1、seq id no:26所示的hcdr2、seq id no:27所示的hcdr3;和
20、所述轻链可变区包含seq id no:28所示的lcdr1、seq id no:29所示的lcdr2、seqid no:30所示的lcdr3;
21、所述hcdr和所述lcdr按照kabat编号系统确定。
22、在一些实施方案中,如前所述的特异性结合人bdca2的抗体或其抗原结合片段,其中所述重链可变区和所述轻链可变区选自以下任一组:
23、1)重链可变区包含seq id no:33所示的氨基酸序列或包含与seq id no:33具有至少85%的序列同一性的氨基酸序列,和
24、轻链可变区包含seq id no:34所示的氨基酸序列或包含与seq id no:34具有至少85%的序列同一性的氨基酸序列;
25、2)重链可变区包含seq id no:37所示的氨基酸序列或包含与seq id no:37具有至少85%的序列同一性的氨基酸序列,和
26、轻链可变区包含seq id no:38所示的氨基酸序列或包含与seq id no:38具有至少85%的序列同一性的氨基酸序列;
27、3)重链可变区包含seq id no:31所示的氨基酸序列或包含与seq id no:31具有至少85%的序列同一性的氨基酸序列,和
28、轻链可变区包含seq id no:32所示的氨基酸序列或包含与seq id no:32具有至少85%的序列同一性的氨基酸序列;
29、4)重链可变区包含seq id no:35所示的氨基酸序列或包含与seq id no:35具有至少85%的序列同一性的氨基酸序列,和
30、轻链可变区包含seq id no:36所示的氨基酸序列或包含与seq id no:36具有至少85%的序列同一性的氨基酸序列;
31、5)重链可变区包含seq id no:39所示的氨基酸序列或包含与seq id no:39具有至少85%的序列同一性的氨基酸序列,和
32、轻链可变区包含seq id no:40所示的氨基酸序列或包含与seq id no:40具有至少85%的序列同一性的氨基酸序列;
33、在上下文中,“至少85%”是指至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%、或前述任意两个数值之间的范围,可以是整数或小数。
34、在一些实施方案中,如前所述的特异性结合人bdca2的抗体或其抗原结合片段,其包含重链可变区和轻链可变区,所述重链可变区和所述轻链可变区选自以下任一组:
35、1)所述重链可变区的氨基酸序列如seq id no:31所示,以及所述轻链可变区的氨基酸序列如seq id no:32所示;
36、2)所述重链可变区的氨基酸序列如seq id no:33所示,以及所述轻链可变区的氨基酸序列如seq id no:34所示;
37、3)所述重链可变区的氨基酸序列如seq id no:35所示,以及所述轻链可变区的氨基酸序列如seq id no:36所示;
38、4)所述重链可变区的氨基酸序列如seq id no:37所示,以及所述轻链可变区的氨基酸序列如seq id no:38所示;
39、5)所述重链可变区的氨基酸序列如seq id no:39所示,以及所述轻链可变区的氨基酸序列如seq id no:40所示。
40、在一些实施方案中,如前任一项所述的特异性结合人bdca2的抗体或其抗原结合片段,所述抗体为兔源抗体、嵌合抗体、或人源化抗体。
41、在一些实施方案中,前述任意特异性结合人bdca2的抗体的抗原结合片段选自以下任一项:fab、scfv、fv、fab’、f(ab′)2、单域抗体、scfab、线性抗体和多特异性抗体。
42、在一些实施方案中,前述任意特异性结合人bdca2的抗体或其抗原结合片段还包含重链恒定区和轻链恒定区。
43、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段是兔源的。
44、在另一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段是嵌合的。
45、在另一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段是人源化的。
46、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链可变区和轻链可变区,其中:
47、1)所述重链可变区包含选自seq id no:43至47中任一项所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含选自seq id no:48至49中任一项所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
48、2)所述重链可变区包含选自seq id no:50至52中任一项所示的氨基酸序列或包含与其具有至少85%序列同一性的氨基酸序列,和所述轻链可变区包含选自seq id no:53至54中任一项所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列。
49、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链可变区和轻链可变区,其中:
50、1)所述重链可变区包含seq id no:43所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:48所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
51、2)所述重链可变区包含seq id no:44所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:48所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
52、3)所述重链可变区包含seq id no:45所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:48所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
53、4)所述重链可变区包含seq id no:46所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:48所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
54、5)所述重链可变区包含seq id no:47所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:48所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
55、6)所述重链可变区包含seq id no:43所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:49所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
56、7)所述重链可变区包含seq id no:44所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:49所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
57、8)所述重链可变区包含seq id no:45所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:49所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
58、9)所述重链可变区包含seq id no:46所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:49所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;或
59、10)所述重链可变区包含seq id no:47所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链可变区包含seq id no:49所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列。
60、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链可变区和轻链可变区,其中:
61、1)所述重链可变区的氨基酸序列如seq id no:43所示,和所述轻链可变区的氨基酸序列如seq id no:48所示;或
62、2)所述重链可变区的氨基酸序列如seq id no:44所示,和所述轻链可变区为seqid no:48所示的氨基酸序列;或
63、3)所述重链可变区的氨基酸序列如seq id no:45所示,和所述轻链可变区的氨基酸序列如seq id no:48所示;或
64、4)所述重链可变区的氨基酸序列如seq id no:46所示,和所述轻链可变区的氨基酸序列如seq id no:48所示;或
65、5)所述重链可变区的氨基酸序列如seq id no:47所示,和所述轻链可变区的氨基酸序列如seq id no:48所示;或
66、6)所述重链可变区的氨基酸序列如seq id no:43所示,和所述轻链可变区的氨基酸序列如seq id no:49所示;或
67、7)所述重链可变区的氨基酸序列如seq id no:44所示,和所述轻链可变区的氨基酸序列如seq id no:49所示;或
68、8)所述重链可变区的氨基酸序列如seq id no:45所示,和所述轻链可变区的氨基酸序列如seq id no:49所示;或
69、9)所述重链可变区的氨基酸序列如seq id no:46所示,和所述轻链可变区的氨基酸序列如seq id no:49所示;或
70、10)所述重链可变区的氨基酸序列如seq id no:47所示,和所述轻链可变区的氨基酸序列如seq id no:49所示。
71、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链可变区和轻链可变区,其中:
72、1)所述重链可变区包含seq id no:50所示的氨基酸序列,和所述轻链可变区包含seq id no:53所示的氨基酸序列;或
73、2)所述重链可变区包含seq id no:51所示的氨基酸序列,和所述轻链可变区包含seq id no:53所示的氨基酸序列;或
74、3)所述重链可变区包含seq id no:52所示的氨基酸序列,和所述轻链可变区包含seq id no:53所示的氨基酸序列;或
75、4)所述重链可变区包含seq id no:50所示的氨基酸序列,和所述轻链可变区包含seq id no:54所示的氨基酸序列;或
76、5)所述重链可变区包含seq id no:51所示的氨基酸序列,和所述轻链可变区包含seq id no:54所示的氨基酸序列;或
77、6)所述重链可变区包含seq id no:52所示的氨基酸序列,和所述轻链可变区包含seq id no:54所示的氨基酸序列。
78、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链可变区和轻链可变区,其中:
79、1)所述重链可变区的氨基酸序列如seq id no:50所示,和所述轻链可变区的氨基酸序列如seq id no:53所示;或
80、2)所述重链可变区的氨基酸序列如seq id no:51所示,和所述轻链可变区的氨基酸序列如seq id no:53所示;或
81、3)所述重链可变区的氨基酸序列如seq id no:52所示,和所述轻链可变区的氨基酸序列如seq id no:53所示;或
82、4)所述重链可变区的氨基酸序列如seq id no:50所示,和所述轻链可变区的氨基酸序列如seq id no:54所示;或
83、5)所述重链可变区的氨基酸序列如seq id no:51所示,和所述轻链可变区的氨基酸序列如seq id no:54所示;或
84、6)所述重链可变区的氨基酸序列如seq id no:52所示,和所述轻链可变区的氨基酸序列如seq id no:54所示。
85、在一些实施方案中,所述重链恒定区选自人igg1、人igg2、人igg3和人igg4的恒定区或其突变体,所述突变体在252位置的氨基酸为y,254位的氨基酸为t和256位的氨基酸为e,或428位的氨基酸为l和434位的氨基酸s突变,所述氨基酸位置通过eu编号确定。
86、在一些实施方案中,所述轻链恒定区选自λ和κ轻链恒定区。
87、在一些实施方案中,所述重链恒定区为人igg1的重链恒定区,所述轻链恒定区为κ轻链恒定区。
88、在一些实施方案中,所述重链恒定区包含seq id no:41、60或61所示的氨基酸序列,所述轻链恒定区包含seq id no:42所示的氨基酸序列。
89、在一些具体的实施方案中,所述重链恒定区包含seq id no:41的氨基酸序列,所述轻链恒定区包含seq id no:42的氨基酸序列。
90、在一些具体的实施方案中,所述重链恒定区的氨基酸序列如seq id no:41所示,所述轻链恒定区的氨基酸序列如seq id no:42所示。
91、在另一些具体的实施方案中,所述重链恒定区是seq id no:41所示氨基酸序列的变体,优选地所述重链恒定区的氨基酸序列如seq id no:60或61所示。
92、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链和轻链,所述重链和所述轻链选自以下任一组:
93、1)所述重链包含seq id no:55所示的氨基酸序列,和所述轻链包含seq id no:56所示的氨基酸序列;
94、2)所述重链包含seq id no:57所示的氨基酸序列,和所述轻链包含seq id no:58所示的氨基酸序列;
95、3)所述重链包含seq id no:62所示的氨基酸序列,和所述轻链包含seq id no:63所示的氨基酸序列;
96、4)所述重链包含seq id no:64所示的氨基酸序列,和所述轻链包含seq id no:65所示的氨基酸序列;
97、5)所述重链包含seq id no:66所示的氨基酸序列,和所述轻链包含seq id no:67所示的氨基酸序列;和
98、6)所述重链包含seq id no:68所示的氨基酸序列,和所述轻链包含seq id no:69所示的氨基酸序列。
99、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链和轻链,所述重链和所述轻链选自以下任一组:
100、1)所述重链包含seq id no:55所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链包含seq id no:56所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;
101、2)所述重链包含seq id no:57所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链包含seq id no:58所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;
102、3)所述重链包含seq id no:62所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链包含seq id no:63所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;
103、4)所述重链包含seq id no:64所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链包含seq id no:65所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;
104、5)所述重链包含seq id no:66所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链包含seq id no:67所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列;和
105、6)所述重链包含seq id no:68所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列,和所述轻链包含seq id no:69所示的氨基酸序列或包含与其具有至少85%的序列同一性的氨基酸序列。
106、在一些具体的实施方案中,本公开的特异性结合人bdca2的抗体或其抗原结合片段包含重链和轻链,所述重链和所述轻链选自以下任一组:
107、1)所述重链的氨基酸序列如seq id no:55所示,和所述轻链的氨基酸序列如seqid no:56所示;
108、2)所述重链的氨基酸序列如seq id no:57所示,和所述轻链的氨基酸序列如seqid no:58所示;
109、3)所述重链的氨基酸序列如seq id no:62所示,和所述轻链的氨基酸序列如seqid no:63所示;
110、4)所述重链的氨基酸序列如seq id no:64所示,和所述轻链的氨基酸序列如seqid no:65所示;
111、5)所述重链的氨基酸序列如seq id no:66所示,和所述轻链的氨基酸序列如seqid no:67所示;和
112、6)所述重链的氨基酸序列如seq id no:68所示,和所述轻链的氨基酸序列如seqid no:69所示。
113、在一些具体的实施方案中,本公开的人源化抗体或其抗原结合片段以不高于4e-09、3e-09、2e-09、1e-09、9e-10、8e-10、7e-10、6e-10、5e-10、4e-10、3e-10(m)的kd值,结合人bdca2或其胞外区。
114、在一些具体的实施方案中,本公开的人源化抗体或其抗原结合片段以不高于7e-09、6e-09、5e-09、4e-09、3e-09、2e-09、1e-09、9e-10、8e-10(m)的kd值,结合猴bdca2或其胞外区。
115、在另一些具体的实施方案中,本公开的嵌合抗体或其抗原结合片段以不高于0.04、0.03、0.02、0.019、0.018、0.017、0.016、0.015、0.014、0.013、0.012、0.011(μg/ml)的ec50,结合人bdca2或其胞外区。
116、在另一些具体的实施方案中,本公开的嵌合抗体或其抗原结合片段以不高于0.07、0.06、0.05、0.04、0.03、0.02(μg/ml)的ec50,结合猴bdca2或其胞外区。
117、在一些具体的实施方案中,本公开的嵌合和人源化抗体或其抗原结合片段与过表达bdca2细胞的结合。
118、本公开提供的特异性结合人bdca2抗体或其抗原结合片段具有以下任一项或多项功能特性:
119、1)以高结合亲和力与人或食蟹猴bdca2结合;
120、2)有效抑制人pbmc中tlr9诱导的ifn-α;
121、3)有效抑制人pbmc中tlr7诱导的ifn-α;和
122、4)通过adcc作用介导了对靶细胞的杀伤。
123、在具体的实施方案中,本公开提供的特异性结合人bdca2抗体或其抗原结合片段抑制人pbmc的tlr9诱导的ifn-α的分泌ec50值为0.0005546(μg/ml)。具体检测方法,可参考实施例7。
124、在具体的实施方案中,本披露提供的特异性结合人bdca2抗体或其抗原结合片段通过adcc活性介导对hek-hbdca2细胞的杀伤ec5值为0.002841(μg/ml),最大杀伤率为38.55%。具体的检测方案,可参考实施例9。
125、药物组合物
126、可将根据本公开的特异性结合人bdca2的抗体或其抗原结合片段配制为施用于受试者(例如以预防或治疗根据本公开的疾病)的药物组合物。因此,本公开提供了一种药物组合物,其含有预防或治疗有效量的前述任一项所述的特异性结合人bdca2的抗体或其抗原结合片段,以及一种或更多种药学上可接受的载体、稀释剂、缓冲剂或赋形剂。
127、通常,药物组合物包括药学可接受载体、稀释剂、缓冲剂或赋形剂。
128、在一些实施方案中,“药物组合物”表示含有一种或多种本文所述抗体或其抗原结合片段与其他组分的混合物,所述其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的之一是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
129、在一些实施方案中,本文所述抗体或其抗原结合片段为特异性结合人bdca2的抗体或其抗原结合片段。
130、药物的配制是一种公知的技术,例如在gennaro(ed.),remington:the scienceand practice of pharmacy,20th ed.,lippincott,williams&wilkins(2000);ansel等人,pharmaceutical dosage forms and drug delivery systems,7th ed.,lippincottwilliams&wilkins publishers(1999)当中进一步描述。
131、药物组合物也可呈多种形式,包括(例如)液体、半固体和固体剂型。例如,液体溶液(例如,可注射和可输注的溶液)、悬浮液、片剂、丸剂、粉剂、脂质体、栓剂。优选的形式可取决于施用模式和治疗应用。通常,本文所述药物组合物是可注射或可输注溶液的形式。
132、在一个实施方案中,在缓冲液中以合适的浓度,提供根据本公开的特异性结合人bdca2的抗体,并且储存于2-8℃。
133、药物组合物可通过肠胃外方式(例如,静脉内、皮下、腹膜内或肌肉内注射)施用。如本文所使用的“肠胃外施用”包括但不限于静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下
134、、蛛网膜下、脊柱内、硬膜外和胸骨内的注射和输注。在一些具体的实施方案中,静脉内施用特异性结合人bdca2的抗体或其抗原结合片段。
135、在一些实施方案中,可以将特异性结合人bdca2的抗体或其抗原结合片段与控制释放的载体(如控释制剂、植入物、微囊化递送系统)一起制备。用于制备此类制剂的方法通常是已知的。
136、分离的核酸
137、本公开还提供分离的核酸,其编码前述任一项所述的特异性结合人bdca2的抗体或其抗原结合片段。
138、应当理解,即便本技术提供了特定的核苷酸序列示例,但是能够“编码本公开特异性结合人bdca2的抗体或其抗原结合片段”的核苷酸序列不限于这些特定序列,因为根据表达宿主的密码子偏好性、密码子简并性,可以采用等同的核苷酸序列对相同的氨基酸序列进行编码。
139、表达载体
140、本公开还提供一种表达载体,其包含根据本公开的分离的核酸。
141、可以构建编码目的抗体或其片段的核酸,将其引入到表达载体中,并在合适的宿主细胞中表达。
142、该表达载体可以为细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或逆转录病毒。
143、宿主细胞
144、本公开还提供一种宿主细胞,其包含前述的核酸或表达载体用于表达本公开特异性结合人bdca2的抗体或其抗原结合片段。
145、宿主细胞包括原核和真核宿主细胞。真核宿主细胞包括但不限于:哺乳动物细胞、昆虫细胞、植物细胞和真菌细胞。哺乳动物细胞包括人、小鼠、大鼠、犬、猴、猪、山羊、牛、马、仓鼠细胞。示例性宿主细胞包括但不限于cho、nso、cos、sp2细胞、hela细胞、bhk细胞、人肝细胞癌细胞、a549细胞、3t3细胞和hek-293细胞。真菌细胞包括酵母,例如但不限于毕赤酵母属、酿酒酵母属、多形汉逊酵母属、克鲁维酵母属。
146、在本公开中,宿主细胞不能发育成完整的动物或植物个体。
147、产生抗体的方法
148、可以在细菌或真核细胞中产生抗体。抗体可以在细菌细胞中产生,也可以在真核细胞(例如cho、293e)中产生。为产生目的抗体,构建编码抗体的核酸,将其引入到表达载体中,然后在合适的宿主细胞中表达。将标准分子生物学技术用于制备重组表达载体,转染宿主细胞,选择转化体,培养宿主细胞和回收所述抗体。
149、如果在动物细胞(如cho)中表达抗体,表达载体包括表达所需的启动子,例如sv40启动子、ef1α启动子或cmv启动子。除编码抗体或其结构域的核酸序列之外,重组表达载体可以携带额外的序列,如选择标记。选择标记便于选择引入了载体的宿主细胞。例如,通常选择标记物对药物(如g418、潮霉素或甲氨喋呤)的抗性。
150、在一些实施方案中,在哺乳动物细胞中产生抗体。用于表达抗体的示性哺乳动物宿主细胞包括中国仓鼠卵巢(cho细胞)、人胚肾293细胞、cos细胞、nih3t3细胞、ns0骨髓瘤细胞、sp2细胞。
151、可以从宿主细胞分离本公开的抗体并纯化为基本上纯的抗体。可将通常用于抗体纯化的分离和纯化方法用于抗体的分离和纯化,例如层析、过滤、超滤、盐析、沉淀、萃取、蒸馏、电泳、等电点聚焦、透析、重结晶。层析包括例如亲和、离子交换、疏水、反相和吸附层析等。用于亲和层析的柱子,例如蛋白a柱和蛋白g柱。
152、在一些实施方案中,采用化学合成法产生抗体,即包括根据所述抗体或其抗原结合片段进行氨基酸序列合成等步骤。
153、在一些实施方案中,本发明中特异性结合人bdca2的抗体包括鼠源抗体、嵌合抗体和人源化抗体,优选人源化抗体。
154、预防或治疗方法
155、本公开所述的特异性结合人bdca2的抗体或其抗原结合片段可用于治疗或预防多种免疫疾病,如炎性和自身免疫性疾病。在一些实施方案中,所述疾病与bdca2在pdc的上异常表达或异常活性相关。
156、本公开提供一种预防或治疗疾病的方法,所述方法包括向受试者施用一种预防或治疗有效量的特异性结合人bdca2的抗体或其抗原结合片段、核酸或药物组合物。在一些实施方案中,所述疾病为炎性疾病或自身免疫性疾病;更优选地,所述炎性疾病或自身免疫性疾病选自:系统性红斑狼疮、盘状狼疮、狼疮性肾炎、表皮性红斑狼疮、类风湿性关节炎、炎性肠疾病、系统性硬化症、进行性系统性硬化症(硬皮病)、银屑病、银屑病关节炎、i型糖尿病、纤维化(例如皮肤纤维化、肺纤维化)、寻常型天疱疮、格雷夫斯病、硬斑病(局部性硬皮病)、干燥病、桥本病、皮肌炎、多肌炎、哮喘、贝切特氏病、克罗恩式病、自身免疫性肾小球肾炎、膜性肾小球病、幼年型类风湿关节炎、混合性结缔组织病、多发性硬化、肾病综合征、脂膜炎、类天疱疮、天疱疮、红斑型天疱疮、落叶型天疱疮、寻常型天疱疮、风湿性多肌痛、雷诺现象/综合征、斯耶格伦综合征和溃疡性结肠炎。
157、在具体的实施方案中,所述炎性或自身免疫性疾病是系统性红斑狼疮。
158、在具体的实施方案中,所述炎性或自身免疫性疾病是盘状狼疮。
159、在具体的实施方案中,所述炎性或自身免疫性疾病是表皮性红斑狼疮。
160、在具体的实施方案中,所述疾病或病症是bdca2介导的疾病。
161、系统性红斑狼疮是一种慢性的自身免疫性疾病,其中多个器官被免疫复合物和组织结合自身抗体损伤。系统性硬化症(或系统性硬皮病)是一种系统性结缔组织疾病。银屑病是一种影响皮肤的自身免疫性疾病。在免疫系统错将皮肤细胞当作病原体,并发送加速皮肤细胞的生长周期的错误信号时发生银屑病。类风湿性关节炎是一种慢性炎性疾病,其影响许多组织和器官,但主要攻击活动关节。炎性肠病(ibd)是一组结肠和小肠炎性疾病。ibd的主要类型是克罗恩氏病(crohn's disease)和溃疡性结肠炎(uc)。皮肌炎(dm)是与多肌炎(pm)相关的一类自身免疫性结缔组织病,其特征在于肌肉和皮肤的炎症。i型糖尿病是糖尿病的一种形式,其起因于胰腺的胰岛素产生β细胞的自身免疫性破坏,随后的胰岛素缺乏导致增加的血液和尿液葡萄糖。
162、适合用本公开的特异性结合人bdca2的抗体或其抗原结合片段来预防或治疗的其它疾病的示例包括哮喘、贝切特氏病、crest综合征、肺纤维化、自身免疫性肾小球肾炎、膜性肾小球病、幼年型类风湿关节炎、混合性结缔组织病、多发性硬化、肾病综合征、脂膜炎、类天疱疮、天疱疮、红斑型天疱疮、落叶型天疱疮、寻常型天疱疮。
163、对有这些疾病风险、诊断患有或具有这些疾病的受试者施用一定量的特异性结合人bdca2的抗体或其抗原结合片段一定时间,从而提供治疗效果。可以单独施用(单一疗法)特异性结合人bdca2的抗体(或其抗原结合片段)、或与第二治疗剂组合施用(联合治疗)。
164、在具体的实施方案中,受试者为易感于、疑似患有、已患有疾病的个体。
165、“治疗”意指向受试者提供特异性结合人bdca2的抗体或其抗原结合片段,或其药物组合物。所述受试者具有一种或多种疾病的症状。通常,在受治疗受试者或受试者群体中以有效缓解疾病症状的量施用特异性结合人bdca2的抗体或其抗原结合片段。
166、在具体的实施方案中,本领域技术人员可以基于对多种因素的考虑(例如经由临床试验)来确定有效量的选择,所述因素包括待治疗的疾病、所涉及的症状、施用途径、疾病的严重程度、受试者的体重、受试者的免疫状态、本领域技术人员已知的其他因素。
167、具体实施方案中的有效量,可以从来源于动物模型测试系统的剂量-应答曲线而得到,并允许根据医生的判断和每位受试者的情况来决定。作为示例,受试者一次施用所需的药物的量可以方便地通过计算受试者的体重和该受试者一次用药所需单位体重剂量的乘积得到。例如,在制备药物的过程中,一般认为成人体重为50-70kg,可以最初可以通过实验动物与人的单位体重剂量之间的等效剂量换算关系来确定用药量。例如,可以根据sfda、fda等药品管理机构提出的指导意见来确定。在一些实施方式中,可以使用按照人和小鼠的体表面积折算系数0.0026来换算人和小鼠的剂量。
168、本文中活性成分(例如特异性结合人bdca2的抗体或其抗原结合片段)可一次性施用,或者可分成许多更小的单位剂量,以一定时间间隔施用。应理解治疗的剂量、持续时间、间隔时间是所治疾病的函数,并且可使用动物或临床试验数据推断而确定。所述施用可包括单次施用,或者间隔适当时间间隔的两次或更多次施用。相邻两次的施用可间隔30分钟、40分钟、50分钟、60分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、一天半、2天、3天、4天、5天、6天、7天、8天、9天、10天、1周、2周、3周、4周、5周、6周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月。
169、本公开提供一种在受试者中减少浆细胞样树突细胞产生炎性细胞因子或趋化因子方法,所述方法包括使表达bdca2的浆细胞样树突细胞接触一定量的本公开所述的抗bdca2抗体或其抗原结合片段、或本公开所述的药物组合物。
170、在一些实施方案中,所述的特异性结合人bdca2抗体或其抗原结合片段、或本公开所述的药物组合物在制备用于诱导浆细胞样树突细胞死亡的药物中的用途。
171、在一些实施方案中,本公开所述的特异性结合人bdca2抗体或其抗原结合片段、或本公开所述的药物组合物在制备用于减少浆细胞样树突细胞产生炎性细胞因子或趋化因子的药物中的用途。
172、在一些实施方案中,本公开所述的特异性结合人bdca2抗体或其抗原结合片段、或本公开所述的药物组合物可用作诱导浆细胞样树突细胞死亡、或减少浆细胞样树突细胞产生炎性细胞因子或趋化因子的药物。
173、用途
174、另一个方面,本公开还提供特异性结合人bdca2的抗体或其抗原结合片段、核酸或药物组合物在制备治疗或预防疾病的药物中的用途。
175、在一些实施方案中,所述疾病为炎性疾病或自身免疫性疾病。
176、在一些具体实施方案中,所述炎性疾病或自身免疫性疾病选自:系统性红斑狼疮、盘状狼疮、狼疮性肾炎、表皮性红斑狼疮、类风湿性关节炎、炎性肠疾病、系统性硬化症、进行性系统性硬化症(硬皮病)、银屑病、银屑病关节炎、i型糖尿病、纤维化(例如皮肤纤维化、肺纤维化)、寻常型天疱疮、格雷夫斯病、硬斑病(局部性硬皮病)、干燥病、桥本病、皮肌炎、多肌炎、哮喘、贝切特氏病、克罗恩式病、自身免疫性肾小球肾炎、膜性肾小球病、幼年型类风湿关节炎、混合性结缔组织病、多发性硬化、肾病综合征、脂膜炎、类天疱疮、天疱疮、红斑型天疱疮、落叶型天疱疮、寻常型天疱疮、风湿性多肌痛、雷诺现象/综合征、斯耶格伦综合征和溃疡性结肠炎。
177、本公开还提供用作药物的特异性结合人bdca2的抗体或其抗原结合片段、核酸或药物组合物。在一些实施方案中,本公开还提供用作治疗疾病的药物的特异性结合人bdca2的抗体或其抗原结合片段、核酸或药物组合物。
178、在一些实施方案中,提供了前述特异性结合人bdca2的抗体或其抗原结合片段,其用于治疗疾病,所述特异性结合人bdca2的抗体或其抗原结合片段和第二治疗剂联合施用。
179、在一些实施方案中,特异性结合人bdca2的抗体或其抗原结合片段和第二治疗剂在相同或不同的容器中。
180、检测方法
181、本公开所述的特异性结合人bdca2的抗体或其抗原结合片段用于免疫分析。免疫分析包括通过使用本公开的特异性结合人bdca2的抗体或其抗原结合片段与生物样本接触,检测来自受试者的生物样本中bdca2的表达量。典型地,本公开的特异性结合人bdca2的抗体或其抗原结合片段可以与荧光标签或其他标签偶联。
182、试剂/药盒
183、本公开还提供一种药盒,其包含至少一个容器,所述容器各自独立地包含:前述任一项特异性结合人bdca2的抗体或其抗原结合片段、核酸或药物组合物。
184、在诊断或研究用途中,试剂盒包含如下一种或多种成分:分析试剂,缓冲液,和本公开的抗体或其抗原结合片段。此外,这些试剂/药盒可包含说明书。
185、本发明公开了一种特异性结合人bdca2胞外区的兔源抗体、其嵌合抗体以及人源化抗体,发现它们与bdca2蛋白具有高亲和力。该抗体在自身免疫性疾病中具有潜在的治疗作用。
本文地址:https://www.jishuxx.com/zhuanli/20240919/300057.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。