一种靶向GPC-3蛋白的多肽偶联化合物的制备方法及应用
- 国知局
- 2024-10-09 15:11:15
本发明涉及医药,具体地说,是一种靶向gpc-3蛋白的多肽偶联化合物的制备方法及应用。
背景技术:
1、在健康的细胞中,特定数量的蛋白质在特定的时间以特定的方式折叠,形成特定的三维复合结构发挥作用。但这种平衡可能被各种打破——细胞压力、基因突变、转录或翻译错误等事件会导致蛋白质在细胞的过表达、生产速度异常、折叠错误或突变,当蛋白质过表达或突变时,就会导致各类疾病。癌症的发生发展很多时候由于某个蛋白生物标志物水平过高,因此靶向蛋白降解变成一种极具前景的肿瘤治疗策略。
2、溶酶体靶向嵌合体因对膜蛋白具有一定的降解作用,近年来备受研究人员关注。然而目前开发的溶酶体靶向嵌合体通常是基于抗体或核酸适配体,分子量大、合成困难、成药性低是其主要缺陷。同时,可供选择的溶酶体靶向受体十分有限。
3、磷脂酰肌醇蛋白聚糖-3(glypicans-3,gpc-3)是近年来研究较多的原发性肝癌肿瘤标志物,它是一种蛋白多糖,通过磷脂酰肌醇锚定在细胞膜上。本研究发现,在肝癌等癌细胞中有特异性分布的gpc-3蛋白,具有内吞并定位至溶酶体的效应。通过将pd-l1蛋白配体bms-202与靶向gpc-3的多肽通过连接子进行连接,我们构造了一类基于gpc-3蛋白介导,通过内吞膜蛋白至溶酶体发挥pd-l1蛋白降解活性的化合物。这类化合物可通过gpc-3蛋白介导,靶向降解pd-l1蛋白,具有潜在的肿瘤治疗作用。
技术实现思路
1、本发明的第一个目的是,针对现有技术中的不足,克服现有药物治疗的缺陷,提供一种靶向gpc-3蛋白的多肽偶联化合物。
2、为实现上述第一个目的,本发明采取的技术方案是:
3、一种靶向gpc-3蛋白的多肽偶联化合物,所述的靶向gpc-3蛋白的多肽偶联化合物为具有式(1)结构的化合物或其药学上可接受的多肽:
4、
5、其中,x为任意具有靶向gpc-3蛋白能力的多肽,包括但不仅限于以下多肽序列:d-y-e-m-h-l-w-w-g-t-e-l、d-h-l-a-s-l-w-w-g-t-e-l、s-n-d-r-p-p-n-i-l-q-k-r、r-l-n-v-g-g-t-y-f-l-t-t-r-q、k-k-k-r-l-n-v-g-g-t-y-f-l-t-t-r-q、t-h-v-s-p-n-q-g-g-l-p-s、a-l-l-a-n-h-e-e-l-f-q-t、q-l-e-l-t-f-h-a-n-l-e-a;
6、y为任意具有靶向pd-l1蛋白能力的小分子化合物或多肽,包括但不仅限于pd-l1小分子抑制剂bms-202,其具有式(2)结构:
7、
8、式(2);所述连接子用于将-nh和y进行连接。连接子包括但不限于下列结构:
9、其中n=0,1,2,3或4。
10、具体地,
11、n=0,连接子结构为
12、n=1,连接子结构为
13、n=2,连接子结构为
14、n=3,连接子结构为
15、n=4,连接子结构为
16、在另一方面,本发明提供一种上述的靶向gpc-3蛋白的多肽偶联化合物的方法,该方法包括以下:
17、(1)合成化合物8:
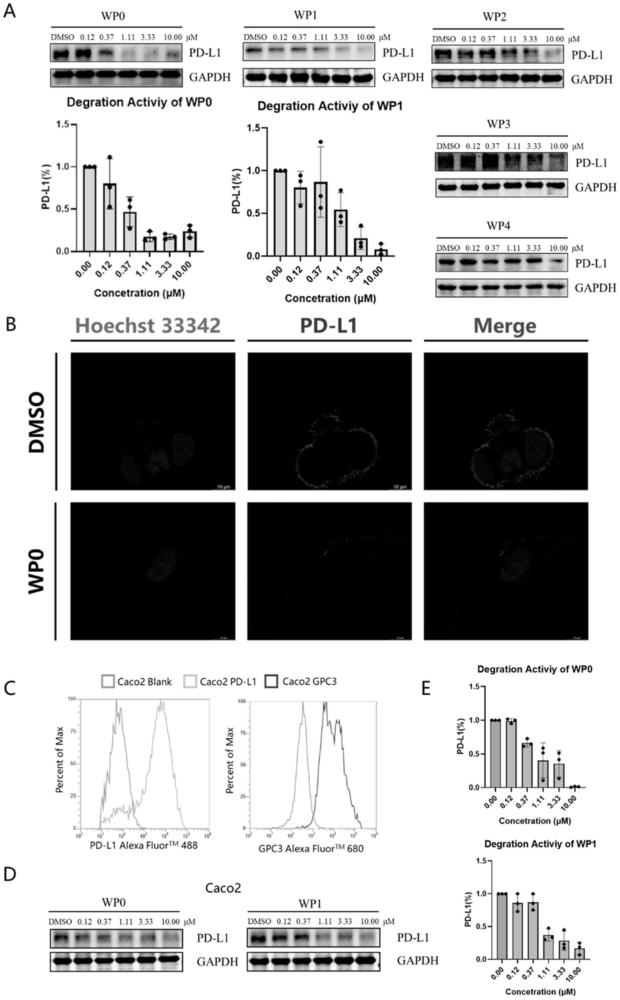
18、
19、以n-boc乙二胺为原料,在edci,hobt,dipea催化条件下与5-乙炔酸反应酰胺化得到化合物3,化合物3在hcl作用下脱boc得到化合物4;3-羟甲基-2-甲基联苯在cs2co3,t-buxphos,pd(oac)2,催化条件下与6-氯-2-甲氧基烟醛反应得到化合物7;化合物7在dipea、stab条件下与化合物4反应得到化合物8;
20、(2)采用标准的芴甲氧羰基(fmoc)固相多肽合成(spps)方法,以2-氯三苯甲基氯树脂为原料,添加带fmoc保护的氨基酸、化合物8以合成所述的靶向gpc-3蛋白的多肽偶联化合物:
21、
22、所述步骤(2)中靶向gpc-3蛋白的多肽偶联化合物的具体合成步骤为:,以2-氯三苯甲基氯树脂为固体支持物,20%的无水哌啶dmf(v/v)溶液对fmoc保护基进行脱保护,使用hobt和dic作为偶联剂,将脱保护树脂与氨基酸(2.0eq.)在无水dmf中于30°c下偶联,使用茚三酮法确认每个偶联步骤的完成,将最终氨基酸与树脂偶联后,得到化合物9,氨基酸加入顺序即多肽序列顺序;使用20%的无水哌啶dmf(v/v)溶液脱去化合物9的fmoc保护基团,得到化合物10,该化合物10为一种连接在树脂上的多肽;以hatu和dipea 为偶联剂,将叠氮-pegn-酸化合物(2.0当量)依次与化合物10偶联,得到化合物11;为使肽衍生物从树脂中切除,使用三氟乙酸将化合物从树脂上分离然后过滤,将所得滤液倒入冷乙醚中,形成大量白色沉淀,离心收集沉淀;沉淀用冷乙醚洗涤2-3次,得到化合物12。最后,通过简单的点击反应,将化合物12、化合物8、cuso4和抗坏血酸钠混合,在室温下反应5小时,并通过hplc进行纯化,得到化合物13。
23、第三方面,本技术还涉及所述的靶向gpc-3蛋白的多肽偶联化合物基于gpc-3蛋白介导,通过内吞至溶酶体降解pd-l1蛋白在制备预防和/或治疗与gpc-3表达和pd-l1表达相关疾病的药物中的用途。在某些实施例中,所述与gpc-3表达和pd-l1表达相关疾病包括肝癌。
24、本发明的有益效果:
25、靶向蛋白降解技术是重要的药物研发策略。溶酶体靶向嵌合体因对膜蛋白具有一定的降解作用,近年来备受研究人员关注。然而目前开发的溶酶体靶向嵌合体通常是基于抗体或核酸适配体,分子量大、合成困难、成药性低是其主要缺陷。同时,可供选择的溶酶体靶向受体十分有限。申请人发现在肝癌等癌细胞中有特异性分布的蛋白gpc-3,具有内吞并定位至溶酶体的效应,由此开发了gpc-3介导的溶酶体降解策略,在多种癌细胞中实现了pd-l1等多种癌症相关膜蛋白的降解。
26、靶向性不足是pd-l1小分子抑制剂所面临的主要问题之一,本发明将可与肝癌细胞肿瘤标志物gpc-3特异性结合的多肽与pd-l1小分子配体相连接获得本发明的目标化合物,即靶向gpc-3介导pd-l1溶酶体降解的多肽偶联化合物。本发明大部分化合物表现出良好的体外活性,其中化合物wp0的活性最优,对肝癌细胞hepg2和caco2的dc50值分别为0.38和0.55μm,对pd-l1蛋白进行抗体荧光标记,利用荧光共聚焦实验,考察wp0的原位pd-l1降解效应。wp0分子能显著降低细胞表面pd-l1蛋白荧光强度。
27、利用inf-γ刺激hepg2细胞,使其稳定表达pd-l1,利用离子霉素与佛波醇刺激jurkat细胞,使其稳定表达pd-1。将待测化合加入hepg2细胞中,作用24小时,再加入jurkat细胞进行共孵育,模拟效应t淋巴细胞识别并杀伤肿瘤细胞的效应,并利用cck-8实验检测hepg2细胞的存活率。wp0相较于pd-l1小分子抑制剂显著降低了化合物脱靶效应。上述实验表明,“挟持”gpc-3蛋白的双功能分子降解剂wp0,能够在多种细胞中实现pd-l1降解,具有潜在的肿瘤治疗作用。
本文地址:https://www.jishuxx.com/zhuanli/20241009/307980.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表