一种含氮螺环化合物的药物组合物及其制备方法和应用与流程
- 国知局
- 2024-10-15 09:58:55
本发明涉及一种含氮螺环化合物的药物组合物及其制备方法和应用。
背景技术:
1、补体是广泛存在于人和脊椎动物血清、组织液和细胞膜表面的一种蛋白质,介导免疫和炎症反应,多数为糖蛋白,由肝细胞、巨噬细胞以及肠粘膜上皮细胞等多种细胞产生。补体是抗体实现其溶细胞作用必要的补充条件,故被命名为补体,但实际介导特异性和非特异性免疫。补体系统的3种激活途径包括经典途径、甘露聚糖结合凝集素途径(mbl)和替代(旁路)途径。补体因子d在补体旁路途径级联活化中起着早期和核心作用。旁路补体途径的活化由c3内的硫酯键自发水解产生c3(h2o)来引发,c3(h2o)与因子b缔合形成c3(h2o)b复合物。补体因子d的作用是断裂c3(h2o)b复合物内的因子b以形成ba和bb。bb除了与c3b结合形成c3转化酶,还参与预活化b淋巴细胞的增殖,而ba抑制其增殖。d因子在脂肪中表达水平高,能刺激葡萄糖运输,促进脂肪细胞中甘油三酯的积累,抑制脂肪分解。
2、补体系统失调在iga肾病(igan)、狼疮肾炎(ln)和阵发性睡眠性血红蛋白尿(pnh)的致病机制中都发挥了重要作用,igan、ln的肾脏病理检测中常可见补体成分与免疫符合物的沉积,补体则是导致pnh溶血的直接原因,而c5ar参与补体系统损伤放大,cfb和cfd为补体旁路途径的关键成分,直接参与补体激活的调节。因此c5ar、cfb、cfd与igan、ln和pnh的发病机制关系密切。
3、阵发性睡眠性血红蛋白尿(pnh)是一种罕见的、危及生命的血液疾病,特征是补体驱动的溶血、血栓形成和骨髓功能受损,导致贫血、疲劳和其他衰弱症状,这些症状会严重影响患者的生活质量。目前针对pnh上市的药品,主要是单抗类药品soliris和ultomiris。其中soliris于2007年首次获准上市,目前已批准多种超级罕见病,包括:阵发性睡眠性血红蛋白尿(pnh)、非典型溶血尿毒症综合征(ahus)、全身型重症肌无力(gmg)、视神经脊髓炎谱系障碍(nmosd)。ultomiris是soliris的升级版产品,是第二代、长效c5补体抑制剂,于2018年底首次获批上市,已批准的适应症包括:pnh、ahus。尽管使用当前的抗c5标准护理疗法进行治疗,很大一部分pnh患者仍然贫血,并依赖输血。
4、目前关于补体因子d的小分子抑制剂还没有药品上市,靶标是补体替代途径,是补体驱动的肾脏疾病(cdrd)的关键驱动因素,因此开发生物活性好的小分子抑制剂对于上述疾病的治疗具有积极意义。
技术实现思路
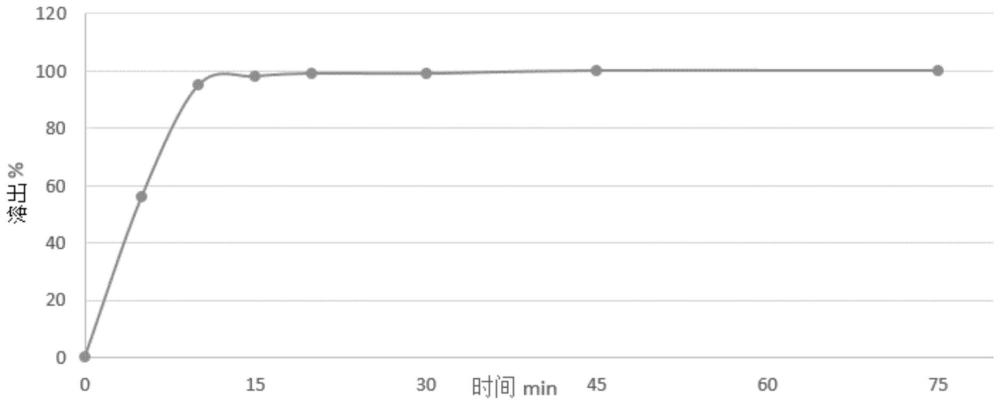
1、本发明所要解决的是现有补体因子d抑制剂的种类少、药物组合物少的技术问题,从而提供了一种含氮螺环化合物的药物组合物及其制备方法和应用。本发明的含氮螺环化合物的药物组合物具有较好的溶出度、稳定性和补体因子d抑制活性,对兔红细胞溶血具有很好的抑制作用,且具有较高的体内暴露量和较高的口服生物利用度。
2、本发明提供了一种含氮螺环化合物的药物组合物,其包含物质x和药用辅料,
3、
4、其中,所述的物质x为如式a所示化合物、其药学上可接受的盐、其溶剂合物或其药学上可接受的盐的溶剂合物;
5、所述的药用辅料选自填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、吸附剂、润滑剂和助流剂中的一种或多种。
6、所述的药用辅料可选自填充剂、粘合剂、崩解剂、润滑剂和助流剂中的一种或多种。较佳地,所述的药用辅料为1)填充剂、粘合剂、崩解剂、润滑剂和助流剂;或2)填充剂、粘合剂、崩解剂和润滑剂。
7、所述的物质x可为唯一活性成分。
8、所述的物质x的用量可为治疗有效量。
9、所述的填充剂可为本领域常规的填充剂,优选选自乳糖、甘露醇、微晶纤维素、乙基纤维素、果糖、麦芽糖醇、山梨糖醇、玉米淀粉、糊精、蔗糖、海藻糖和木糖醇中的一种或多种,更优选选自乳糖、甘露醇和微晶纤维素中的一种或多种。较佳地,所述的填充剂为1)乳糖和微晶纤维素的混合物,或2)甘露醇和微晶纤维素的混合物。所述的乳糖可为乳糖g200。所述的甘露醇可为甘露醇50c。所述的微晶纤维素可为微晶纤维素ph-102。
10、所述的粘合剂可为本领域常规的粘合剂,优选选自羟丙甲纤维素、聚维酮、甲基纤维素和明胶中的一种或多种,更优选聚维酮和/或羟丙甲纤维素。所述的聚维酮可为聚维酮k30。所述的羟丙甲纤维素可为羟丙甲纤维素e5。
11、所述的崩解剂可为本领域常规的崩解剂,优选选自交联羧甲基纤维素钠、交联聚维酮、海藻酸、壳聚糖、羧甲基淀粉钠和羟基乙酸淀粉钠中的一种或多种,更优选交联羧甲基纤维素钠,例如交联羧甲基纤维素钠sd711。
12、所述的助流剂可为本领域常规的助流剂,优选胶态二氧化硅或微粉硅胶,例如胶态二氧化硅200pharm。
13、所述的润滑剂可为本领域常规的润滑剂,优选选自硬脂酸镁、硬脂酸钙、单硬脂酸甘油酯、泊洛沙姆、苯甲酸钠、月桂基硫酸钠和滑石粉中的一种或多种,更优选硬脂酸镁,例如硬脂酸镁mf-2-v。
14、所述的物质x中的式a化合物以重量计可为所述的药物组合物总重量的10%~40%,优选20%~30%,例如25%。
15、所述的填充剂以重量计可为所述的药物组合物总重量的50%~80%,优选60%~70%,例如61%、63%、64%或65%。
16、当所述的填充剂为乳糖和微晶纤维素的混合物时,所述的填充剂以重量计可为所述的药物组合物总重量的64%或65%。所述的乳糖与所述的微晶纤维素的质量比可为30:(31~38),优选30:(34~35),例如30:35或30:34。
17、当所述的填充剂为甘露醇和微晶纤维素的混合物时,所述的填充剂以重量计可为所述的药物组合物总重量的61%、63%或64%。所述的甘露醇与所述的微晶纤维素的质量比可为(15~45):44,优选(20~42):44,例如20:44、30:33或28:33。
18、所述的粘合剂以重量计可为所述的药物组合物总重量的2%~6%,例如4%。
19、所述的崩解剂以重量计可为所述的药物组合物总重量的2%~10%,例如5%或7%。
20、所述的润滑剂以重量计可为所述的药物组合物总重量的0.5%~4%,例如1%或2%。
21、所述的助流剂以重量计可为所述的药物组合物总重量的0.5%~4%,例如1%。
22、在某一方案中,所述的药物组合物包含以重量计的如下组分:
23、10%~40%的所述的如式a所示化合物;50%~80%的所述的填充剂;2%~6%的所述的粘合剂;2%~10%的所述的崩解剂;0.5%~4%的所述的润滑剂;
24、较佳地,所述的药物组合物还包括0.5%~4%的所述的助流剂;
25、更佳地,所述的药物组合物由以上组分组成。
26、在某一方案中,所述的药物组合物包含以重量计的如下组分:
27、25%的所述的如式a所示化合物;61%、63%、64%或65%的所述的填充剂;4%的所述的粘合剂;5%或7%的所述的崩解剂;1%或2%的所述的润滑剂;
28、较佳地,所述的药物组合物还包括1%的所述的助流剂;
29、更佳地,所述的药物组合物由以上组分组成。
30、在某一方案中,所述的药物组合物包含以重量计的如下组分:
31、10%~40%的所述的如式a所示化合物,所述的如式a所示化合物为如式a所示化合物的晶型i;
32、50%~80%的所述的填充剂,所述的填充剂选自乳糖、甘露醇和微晶纤维素中的一种或多种;所述的填充剂可为1)乳糖和微晶纤维素的混合物,或2)甘露醇和微晶纤维素的混合物;
33、2%~6%的所述的粘合剂,所述的粘合剂为聚维酮和/或羟丙甲纤维素;
34、2%~10%的所述的崩解剂,所述的崩解剂为交联羧甲基纤维素钠;
35、0.5%~4%的所述的润滑剂,所述的润滑剂为硬脂酸镁;
36、较佳地,所述的药物组合物还包括0.5%~4%的所述的助流剂,所述的助流剂为胶态二氧化硅;
37、更佳地,所述的药物组合物由以上组分组成。
38、在某一方案中,所述的药物组合物为包含以重量计的如下组分的任一组合:
39、组合1:25%的如式a所示化合物的晶型i、30%的乳糖、35%的微晶纤维素、4%的聚维酮、5%的交联羧甲基纤维素钠和1%的硬脂酸镁;
40、组合2:25%的如式a所示化合物的晶型i、30%的乳糖、34%的微晶纤维素、4%的聚维酮、5%的交联羧甲基纤维素钠、1%的胶态二氧化硅和1%的硬脂酸镁;
41、组合3:25%的如式a所示化合物的晶型i、20%的甘露醇、44%的微晶纤维素、4%的聚维酮、5%的交联羧甲基纤维素钠、1%的胶态二氧化硅和1%的硬脂酸镁;
42、组合4:25%的如式a所示化合物的晶型i、30%的甘露醇、33%的微晶纤维素、4%的羟丙甲纤维素、5%的交联羧甲基纤维素钠、1%的胶态二氧化硅和2%的硬脂酸镁;
43、组合5:25%的如式a所示化合物的晶型i、30%的甘露醇、33%的微晶纤维素、4%的聚维酮、5%的交联羧甲基纤维素钠、1%的胶态二氧化硅和2%的硬脂酸镁;
44、组合6:25%的如式a所示化合物的晶型i、28%的甘露醇、33%的微晶纤维素、4%的羟丙甲纤维素、7%的交联羧甲基纤维素钠、1%的胶态二氧化硅和2%的硬脂酸镁;
45、较佳地,所述的药物组合物由以上组分组成。
46、所述的药物组合物可为口服制剂。
47、所述的药物组合物的单位剂型中,所述的如式a所示化合物的含量可为5~500mg,优选10~200mg,例如25mg或100mg。以片剂为例,所述的单位剂型中,所述的如式a所示化合物的含量可为5~500mg/片,优选10~200mg/片,例如25mg/片或100mg/片。
48、所述的药物组合物可为固体制剂。
49、所述的药物组合物可为固体口服制剂,例如片剂或胶囊剂。所述的片剂可为素片或包衣片。所述的包衣片优选薄膜包衣片。
50、所述的药物组合物还可包括包衣剂。
51、所述的包衣剂可为薄膜包衣预混剂。所述的薄膜包衣预混剂可为商品名为qx 321a180025-cn的薄膜包衣预混剂。
52、相对于未包衣的重量,包衣后,所述的包衣剂的重量增重可为1%~6%,优选2%~4%。
53、在某一方案中,所述的药物组合物为包含以重量计的如下组分的任一组合或由以重量计的如下组分组成的任一组合:
54、组合a:
55、片芯:25%的如式a所示化合物的晶型i、30%甘露醇、33%的微晶纤维素、4%的羟丙甲纤维素、5%的交联羧甲基纤维素钠、2%的硬脂酸镁和1%的胶态二氧化硅;
56、包衣:与片芯重量相比,所述的包衣剂的重量增重2%~4%;
57、组合b:
58、片芯:25%的如式a所示化合物的晶型i、28%甘露醇、33%的微晶纤维素、4%的羟丙甲纤维素、7%的交联羧甲基纤维素钠、2%的硬脂酸镁和1%的胶态二氧化硅;
59、包衣:与片芯重量相比,所述的包衣剂的重量增重2%~4%。
60、所述的如式a所示化合物可为如式a所示化合物的晶型i,其使用cu-kα辐射、以2θ角表示的x-射线粉末衍射(xrpd)图在5.67±0.20°、11.37±0.20°、16.69±0.20°、17.32±0.20°和19.73±0.20°处有衍射峰。
61、所述的如式a所示化合物的晶型i使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图还可在12.01±0.20°、13.89±0.20°、17.05±0.20°、19.42±0.20°、23.41±0.20°和27.86±0.20°中的一处或多处有衍射峰。
62、所述的如式a所示化合物的晶型i使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图还可在18.04±0.20°、18.43±0.20°、22.94±0.20°和26.01±0.20°中的一处或多处有衍射峰。
63、所述的如式a所示化合物的晶型i使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图可在5.67±0.20°、11.37±0.20°、12.01±0.20°、13.89±0.20°、16.69±0.20°、17.05±0.20°、17.32±0.20°、18.04±0.20°、18.43±0.20°、19.42±0.20°、19.73±0.20°、22.94±0.20°、23.41±0.20°、26.01±0.20°和27.86±0.20°处有衍射峰。
64、所述的如式a所示化合物的晶型i使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图,其衍射峰位置可如下表所示:
65、
66、
67、所述的如式a所示化合物的晶型i使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图,其衍射峰位置和相对强度可如下表所示:
68、 序号 位置2θ(°) 相对强度 序号 位置2θ(°) 相对强度 1 3.50 3.00% 23 22.94 10.60% 2 5.67 45.80% 24 23.41 25.50% 3 6.88 3.00% 25 24.03 3.40% 4 9.13 6.90% 26 24.23 5.90% 5 11.37 38.70% 27 24.45 3.40% 6 12.01 25.90% 28 25.00 1.80% 7 12.37 6.50% 29 25.45 2.30% 8 13.89 11.90% 30 26.01 10.40% 9 14.20 4.10% 31 27.19 1.80% 10 15.05 2.40% 32 27.36 1.50% 11 16.69 36.70% 33 27.86 15.00% 12 17.05 25.60% 34 28.76 2.80% 13 17.32 28.90% 35 29.57 4.70% 14 18.04 10.70% 36 31.29 3.40% 15 18.43 10.30% 37 33.18 0.90% 16 18.69 5.00% 38 33.62 2.00% 17 19.42 13.70% 39 35.40 0.90% 18 19.73 100.00% 40 35.87 1.60% 19 20.98 2.30% 41 36.75 0.60% 20 21.17 6.30% 42 38.23 0.60% 21 21.80 1.40% 43 39.71 1.00% 22 22.32 3.60%
69、。
70、所述的如式a所示化合物的晶型i使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图基本上可如图2所示。
71、所述的如式a所示化合物的晶型i的差示扫描量热图(dsc)可在231.1±2℃处有吸热峰。
72、所述的如式a所示化合物的晶型i的差示扫描量热图基本上可如图3所示。
73、所述的如式a所示化合物的晶型i的热重分析(tga)图可在200±2℃前无失重。
74、所述的如式a所示化合物的晶型i的热重分析图基本上可如图3所示。
75、所述的如式a所示化合物可为如式a所示化合物的晶型ii,其使用cu-kα辐射、以2θ角表示的x-射线粉末衍射(xrpd)图在11.32±0.20°、11.70±0.20°、11.93±0.20°、18.03±0.20°、18.81±0.20°和19.17±0.20°处有衍射峰。
76、所述的如式a所示化合物的晶型ii使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图还在5.54±0.20°、12.37±0.20°、13.78±0.20°、14.11±0.20°、15.78±0.20°和20.80±0.20°中的一处或多处有衍射峰;
77、所述的如式a所示化合物的晶型ii使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图还可在13.55±0.20°、16.40±0.20°、17.74±0.20°、20.49±0.20°和22.06±0.20°中的一处或多处有衍射峰。
78、所述的如式a所示化合物的晶型ii使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图可在5.54±0.20°、11.32±0.20°、11.70±0.20°、11.93±0.20°、12.37±0.20°、13.55±0.20°、13.78±0.20°、14.11±0.20°、15.78±0.20°、16.40±0.20°、17.74±0.20°、18.03±0.20°、18.81±0.20°、19.17±0.20°、20.49±0.20°、20.80±0.20°和22.06±0.20°处有衍射峰。
79、所述的如式a所示化合物的晶型ii使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图,其衍射峰位置可如下表所示:
80、
81、
82、所述的如式a所示化合物的晶型ii使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图,其衍射峰位置和相对强度可如下表所示:
83、 序号 位置2θ(°) 相对强度 序号 位置2θ(°) 相对强度 1 5.54 62.50% 23 19.17 100.00% 2 7.20 4.60% 24 19.68 31.90% 3 8.63 19.60% 25 20.21 11.00% 4 9.04 15.80% 26 20.49 48.80% 5 11.32 64.40% 27 20.80 51.00% 6 11.70 65.00% 28 21.23 10.40% 7 11.93 92.80% 29 22.06 50.40% 8 12.37 64.30% 30 22.52 34.30% 9 12.80 29.20% 31 23.15 27.40% 10 13.55 37.70% 32 23.54 16.90% 11 13.78 57.00% 33 24.44 13.00% 12 14.11 54.40% 34 24.78 19.60% 13 14.52 36.10% 35 25.33 11.20% 14 15.23 36.80% 36 25.92 9.40% 15 15.78 61.50% 37 26.40 9.00% 16 16.40 40.10% 38 26.68 8.20% 17 16.92 25.00% 39 27.52 13.40% 18 17.31 32.50% 40 28.36 5.40% 19 17.74 41.80% 41 29.62 6.50% 20 18.03 95.30% 42 30.06 5.90% 21 18.41 30.00% 43 31.61 3.80% 22 18.81 69.20% 44 34.52 5.70%
84、所述的如式a所示化合物的晶型ii使用cu-kα辐射、以2θ角表示的x-射线粉末衍射图基本上可如图12所示。
85、所述的如式a所示化合物的晶型ii的差示扫描量热图(dsc)可在230.7±2℃处有吸热峰。
86、所述的如式a所示化合物的晶型ii的差示扫描量热图可在159.1±2℃处有放热峰
87、所述的如式a所示化合物的晶型ii的差示扫描量热图基本上可如图13所示。
88、所述的如式a所示化合物的晶型ii的热重分析(tga)图可在210±2℃前失重1.71%。
89、所述的如式a所示化合物的晶型ii的热重分析图基本上可如图13所示。
90、本发明提供了一种所述的药物组合物的制备方法,其为干法制粒压片、湿法制粒压片或粉末直接压片,优选湿法制粒压片。
91、较佳地,所述的药物组合物的制备方法包括如下步骤:
92、1)预处理
93、将如式a所示化合物、填充剂、粘合剂和崩解剂分别过筛;
94、2)制粒
95、将根据步骤1)得到的如式a所示化合物、填充剂、粘合剂和崩解剂在湿法制粒锅中混合,得混合物1;
96、将混合物1与纯化水在湿法制粒锅中混合,得湿粒;
97、将湿粒过筛,干燥,得整粒;
98、3)将根据步骤2)得到的整粒与步骤1)得到的崩解剂、润滑剂和助流剂中的两种或三种混合,压片,得片芯;
99、4)用包衣剂对根据步骤3)得到的片芯进行包衣。
100、所述的1)预处理中,所述的过筛可为过35目筛。
101、所述的2)制粒中,所述的过筛可为通过孔径4.75mm方形筛网。
102、本发明提供了一种所述的药物组合物在制备治疗和/或预防补体因子d介导的疾病的药物中的应用,所述的补体因子d介导的疾病为血液疾病、肾脏疾病、心血管疾病、免疫病症、中枢神经系统疾病、呼吸系统疾病、泌尿生殖系统疾病或眼部病症。
103、较佳地,所述的补体因子d介导的疾病为冷凝集素病、灾难性抗磷脂综合征、溶血性贫血、抗中性粒细胞胞质抗体(anca)相关性血管炎(aav)、温抗体型自身免疫性溶血性贫血、阵发性睡眠性血红蛋白尿症、iga肾病、狼疮肾炎、非典型溶血性尿毒综合征、膜性增生性肾小球肾炎(mpgn)、致密沉积物病、c3肾小球肾炎、局灶性节段性肾小球硬化症、糖尿病肾病、系统性狼疮或红斑狼疮、类风湿性关节炎、炎症性肠病、银屑病、多发性硬化症、器官移植排斥反应、重症肌无力、阿尔兹海默症、呼吸窘迫综合征、哮喘、慢性阻塞性肺病、肺气肿、冠状病毒感染(如sars-cov、mers-cov或sars-cov-2感染)、黄斑变性、年龄相关性黄斑变性(amd)、黄斑水肿、糖尿病性黄斑水肿、脉络膜新生血管形成(cnv)、葡萄膜炎、白塞氏葡萄膜炎、增殖性糖尿病性视网膜病变、非增殖性糖尿病性视网膜病变、青光眼、高血压性视网膜病变、角膜新生血管化病、角膜移植后排斥反应、角膜营养不良病、自身免疫性干眼病、史蒂文斯-约翰逊综合征、舍格伦综合征、环境性干眼病、费氏角膜内皮营养不良、视网膜静脉阻塞或术后炎症。
104、本发明提供了一种所述的药物组合物在制备治疗和/或预防疾病的药物中的应用,所述的疾病为血液疾病、肾脏疾病、心血管疾病、免疫病症、中枢神经系统疾病、呼吸系统疾病、泌尿生殖系统疾病或眼部病症。
105、较佳地,所述的疾病为冷凝集素病、灾难性抗磷脂综合征、溶血性贫血、抗中性粒细胞胞质抗体(anca)相关性血管炎(aav)、温抗体型自身免疫性溶血性贫血、阵发性睡眠性血红蛋白尿症、iga肾病、狼疮肾炎、非典型溶血性尿毒综合征、膜性增生性肾小球肾炎(mpgn)、致密沉积物病、c3肾小球肾炎、局灶性节段性肾小球硬化症、糖尿病肾病、系统性狼疮或红斑狼疮、类风湿性关节炎、炎症性肠病、银屑病、多发性硬化症、器官移植排斥反应、重症肌无力、阿尔兹海默症、呼吸窘迫综合征、哮喘、慢性阻塞性肺病、肺气肿、冠状病毒感染(如sars-cov、mers-cov或sars-cov-2感染)、黄斑变性、年龄相关性黄斑变性(amd)、黄斑水肿、糖尿病性黄斑水肿、脉络膜新生血管形成(cnv)、葡萄膜炎、白塞氏葡萄膜炎、增殖性糖尿病性视网膜病变、非增殖性糖尿病性视网膜病变、青光眼、高血压性视网膜病变、角膜新生血管化病、角膜移植后排斥反应、角膜营养不良病、自身免疫性干眼病、史蒂文斯-约翰逊综合征、舍格伦综合征、环境性干眼病、费氏角膜内皮营养不良、视网膜静脉阻塞或术后炎症。
106、本发明提供了一种所述的药物组合物在制备补体因子d抑制剂中的应用。
107、所述的补体因子d抑制剂可用于哺乳动物生物体内;也可用于生物体外,主要作为实验用途,例如:作为标准样或对照样提供比对,或按照本领域常规方法制成试剂盒,为补体因子d的抑制效果提供快速检测。
108、本发明药物组合物中的晶型可以通过一种或几种固态分析方法进行鉴定。如x-射线粉末衍射、单晶x-射线衍射、差示扫描量热、热重分析等。本领域技术人员知道,x-射线粉末衍射的峰强度和/或峰情况可能会因为实验条件不同而不同。同时由于仪器不同的精确度,测得的2θ值会有约±0.20°的误差。而峰的相对强度值比峰的位置更依赖于所测定样品的某些性质,如晶体的尺寸大小,纯度高低,因此测得的峰强度可能出现约±20%的偏差。尽管存在试验误差、仪器误差和取向优先等,本领域技术人员还是可以从本专利提供的x射线粉末衍射数据获得足够的鉴别各个晶型的信息。而在dsc测量中,根据加热速率、晶体形状和纯度以及其它测量参数,实测获得的吸热峰的初始温度、最高温度和熔化热数据均具有一定程度的可变性。
109、术语解释:
110、术语“基本上”是指随着测量设备、测量条件、待测产品批次间的轻微变化,图中各峰的位置可以轻微变化,不视为绝对值。
111、术语“填充剂”,也称“稀释剂”,是指在科学的背景下用于增加药物组合物产品剂型的体积和重量的一类辅料。因此,填充剂可以是,例如:碳酸钙、磷酸钙、磷酸氢钙、硫酸钙、乙酸纤维素、乙基纤维素、果糖、乳糖、乳糖醇、麦芽糖、麦芽糊精、麦芽糖醇、甘露醇、微晶纤维素、聚右旋糖、聚乙二醇、碳酸氢钠、碳酸钠、氯化钠、山梨糖醇、玉米淀粉、糊精、蔗糖、海藻糖和木糖醇。
112、术语“粘合剂”,是指对无粘性或粘性不足的物料给予粘性,从而使物料聚结成粒的辅料。因此,黏合剂可以是,例如:淀粉浆、甲基纤维素、羟丙甲纤维素、聚维酮、明胶和聚乙二醇。
113、术语“崩解剂”,是指在科学的背景下用于促进药物组合物产品剂型在水环境中破裂成更小的碎片的一类辅料。因此,崩解剂可以是,例如:海藻酸、海藻酸钙、羧甲基纤维素钙、壳聚糖、交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠、低取代羟丙基纤维素、甘氨酸、瓜尔胶、硅酸铝镁、甲基纤维素、海藻酸钠、羟基乙酸淀粉钠和淀粉。
114、术语“润滑剂”,是指在科学的背景下用于改善药物组合物产品剂型加工过程的一类辅料。因此,润滑剂可以是,例如:硬脂酸钙、单硬脂酸甘油酯、山嵛酸甘油酯、硬脂酸镁、棕榈酸、泊洛沙姆、聚乙二醇、苯甲酸钾、苯甲酸钠、月桂基硫酸钠、硬脂酸钠、硬脂富马酸钠、硬脂酸、滑石粉、微粉硅胶和硬脂酸锌。
115、术语“助流剂”,是指降低颗粒间摩擦力,改善粉末流动性的一类辅料。因此,助流剂可以是,例如:二氧化硅(例如胶态二氧化硅)、微粉硅胶。
116、术语“润湿剂”,是指本身没有黏性,但能诱发待制粒物料的黏性,以利于制粒的液体。例如:蒸馏水和乙醇。
117、术语“吸收促进剂”,是指可以提高细胞膜流动性、降低黏液黏度或延长制剂在吸收部位的停留时间,进而改善制剂在胃肠道中的透过性,提高制剂口服生物利用度的一类辅料。例如:表面活性剂、螯合剂、壳聚糖及其衍生物和多肽制剂。
118、术语“吸附剂”,是指使活性成分附着在其颗粒表面,有利于实施均匀混合的一类辅料。例如:硅胶、氧化铝、活性炭和分子筛。
119、术语“包衣剂”、“薄膜包衣剂”或“薄膜包衣预混剂”,是指在科学的背景下用于改善药物组合物产品剂型外观的一类辅料。因此,包衣剂可以是,例如:蔗糖、羟丙基乙基纤维素、醋酸纤维素酞酸酯、聚乙烯醇、聚醋酸乙烯邻苯二甲酸酯、邻苯二酸羟丙甲纤维素酯和丙烯酸树脂。
120、术语“药学上可接受的盐”是指本发明化合物与相对无毒的、药学上可接受的酸或碱制备得到的盐。当本发明的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的药学上可接受的碱与这类化合物的中性形式接触的方式获得碱加成盐。药学上可接受的碱加成盐包括但不限于:锂盐、钠盐、钾盐、钙盐、铝盐、镁盐、锌盐、铋盐、铵盐、二乙醇胺盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的药学上可接受的酸与这类化合物的中性形式接触的方式获得酸加成盐。所述的药学上可接受的酸包括无机酸,所述无机酸包括但不限于:盐酸、氢溴酸、氢碘酸、硝酸、碳酸、磷酸、亚磷酸、硫酸等。所述的药学上可接受的酸包括有机酸,所述有机酸包括但不限于:乙酸、丙酸、草酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、水杨酸、酒石酸、甲磺酸、异烟酸、油酸、单宁酸、泛酸、酒石酸氢、抗坏血酸、龙胆酸、葡糖酸、糖酸、甲酸、乙磺酸、双羟萘酸(即4,4’-亚甲基-双(3-羟基-2-萘甲酸))、氨基酸(例如谷氨酸、精氨酸)等。当本发明的化合物中含有相对酸性和相对碱性的官能团时,可以被转换成碱加成盐或酸加成盐。具体可参见berge et al.,"pharmaceutical salts",journal ofpharmaceutical science 66:1-19(1977)、或handbook of pharmaceutical salts:properties,selection,and use(p.heinrich stahl and camille g.wermuth,ed.,wiley-vch,2002)。
121、术语“溶剂合物”是指本发明化合物与化学计量或非化学计量的溶剂结合形成的物质。溶剂合物中的溶剂分子可以有序或非有序排列的形式存在。所述的溶剂包括但不限于:水、甲醇、乙醇等。
122、术语“药学上可接受的盐的溶剂合物”中的“药学上可接受的盐”和“溶剂合物”如上所述,是指本发明化合物与相对无毒的、药学上可接受的酸或碱制备得到的,与化学计量或非化学计量的溶剂结合形成的物质。
123、本文所用术语“药用辅料”是指生产药品和调配处方时使用的赋形剂和附加剂,是除活性成分以外,包含在药物制剂中的所有物质。可参见中华人民共和国药典(2020年版)四部、或、handbook of pharmaceutical excipients(raymond c rowe,2009sixthedition)。
124、术语“治疗”指治疗性疗法。涉及具体病症时,治疗指:(1)缓解疾病或者病症的一种或多种生物学表现,(2)干扰(a)导致或引起病症的生物级联中的一个或多个点或(b)病症的一种或多种生物学表现,(3)改善与病症相关的一种或多种症状、影响或副作用,或者与病症或其治疗相关的一种或多种症状、影响或副作用,或(4)减缓病症或者病症的一种或多种生物学表现发展。
125、术语“预防”是指获得或发生疾病或障碍的风险降低。
126、术语“患者”是指根据本发明的实施例,即将或已经接受了该化合物或组合物给药的任何动物,哺乳动物为优。术语“哺乳动物”包括任何哺乳动物。哺乳动物的实例包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、家兔、豚鼠、猴、人等,以人类为优。
127、术语“治疗有效量”是指在给予患者时,足以有效治疗本文所述的疾病或病症的化合物的量。“治疗有效量”将根据化合物、病症及其严重度、以及欲治疗患者的年龄而变化,可由本领域技术人员根据需要进行调整。
128、在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
129、本发明所用试剂和原料均市售可得。
130、本发明的积极进步效果在于:本发明的含氮螺环化合物的药物组合物具有较好的稳定性、溶出度和补体因子d抑制活性,对兔红细胞溶血具有很好的抑制作用,且具有较高的体内暴露量和较高的口服生物利用度。
本文地址:https://www.jishuxx.com/zhuanli/20241015/315994.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。