一种表达植物基因OsTir1的转基因小鼠模型构建方法
- 国知局
- 2024-11-18 18:20:44
本发明涉及蛋白快速降解系统动物模型的构建,具体涉及通过in-fusion技术构建以含有点突变植物基因ostir1 cdna为目的基因序列、以6*sv40 polya为核心终止转录序列以及具有促进目的基因表达的序列的供体(donor)质粒,并利用该质粒进而构建表达ostir1的转基因小鼠模型。
背景技术:
1、aid(auxin-inducibledegron)是植物进化出一种蛋白质降解途径,其利用植物的生长激素,如吲哚-3-乙酸(iaa,indole-3-acetic acid),在植物细胞内作用于scf复合体,诱导泛素化aux/iaa蛋白家族的抑制因子,从而激活aux/iaa家族蛋白的表达,促进植物生长发育(blázquez et al.,2020,tan et al.,2007)。scf复合体是e3泛素连接酶家族成员,其含有3个关键亚基(skp1、cul1和f-box)。cul1亚基作为主要的支架,将skp1和rbx1结合在一起,rbx1负责将e2泛素结合酶募集至复合物;而skp1与f-box蛋白结合,f-box蛋白与含有降解基序的底物相互作用,从而降解蛋白(tan,et al.,2007)。转运抑制响应蛋白(transport inhibitor response 1,tir1)是一种植物特异性的f-box蛋白,在植物中生长激素首先结合到tir1,从而被aux/iaa识别,随后scf-tir1募集e2泛素结合酶,通过泛素化途径降解aux/iaa蛋白家族转录抑制因子(dharmasiri et al.,2005,kepinski andleyser,2005)。scf复合体在真核生物中高度保守(skaar et al.,2013),其他真核生物虽然不具备对植物生长激素的直接应答,但存在scf介导的蛋白降解途径,这提示将植物体的生长激素诱导的蛋白质降解系统运用到其它真核生物体中成为可能。
2、nishimura等人最先将aid运用在酵母、鸡、小鼠、仓鼠和人类等真核生物细胞系中。其将靶基因的n末端或c末端融合一个aid序列(源自aux/iaa序列并被tir1识别),并表达外源性拟南芥tir1,随后通过植物生长激素诱导完成靶蛋白的降解(nishimura etal.,2009)。由于拟南芥tir1在动物细胞培养所需的温度孵育下变性,因此nishimura等人改用高温下更稳定的水稻直系同源物ostir1(具体为其突变体ostir1(f74g)),生长激素处理后靶蛋白降解非常迅速(半衰期为10~20分钟),可通过去除生长激素来恢复靶蛋白表达(nishimura,et al.,2009)。crispr-cas9技术的出现使构建aid系统更加简单,如可以将一个只有7kd的aid(maid)敲入到哺乳动物细胞的目的基因c端,在表达ostir1后加入iaa,从而可以在60分钟内迅速降解目的基因编码的蛋白质(natsume et al.,2016)。
3、aid系统对生长激素响应迅速,对靶蛋白的降解是快速、完全且可逆的,可应用于广泛物种的细胞系。由于传统的敲除、敲低方法无法精准探究蛋白的直接调控机制,aid系统在哺乳动物中的应用对于研究人员探究发生时间很短的进程(如有丝分裂、转录启动等)、生长发育必需的蛋白、三维基因组结构等相关研究具有重大意义。而成功构建aid系统的模式动物对于研究一些目的蛋白的功能极为重要,如有研究构建rosa26位点上cag启动子驱动植物基因ostir1表达的小鼠转基因系,但结果显示小鼠胚胎致死(yesbolatova etal.,2020)。这可能是由于从注射的供体质粒的许多拷贝中短暂表达ostir1导致胚胎中的非特异性蛋白质降解,从而影响胚胎发育。
4、另外,对于基于flox区域的条件表达模式构建的模型,其通常是利用对目的基因的敲除间接研究相关蛋白的功能,敲除发生后通常在动物基因组保留一个loxp序列,由于敲除了目的基因的原因,所以该loxp序列在基因组上对目的基因表达的影响是不确定的,而这种不确定性对于某些通过同源重组及loxp-stop-loxp序列构建的模型而言可能会导致模型构建成功率低的问题(例如在动物样本的蛋白表达验证中有时仅观察到标签表达而蛋白表达条带则缺失)。
5、综上所述,构建ostir1表达小鼠对于aid系统的模式动物的构建尤为关键。
技术实现思路
1、本发明的目的在于提供一种表达植物基因ostir1的转基因小鼠模型构建方法,为进一步构建蛋白快速降解系统模型小鼠奠定基础。
2、为达到上述目的,本发明采用了以下技术方案:
3、该小鼠模型构建方法包括以下步骤:
4、1)将含有loxp-stop-loxp序列的植物基因ostir1表达盒作为目的序列敲入到小鼠基因组中,得到敲入鼠;其中,所述植物基因ostir1表达盒包括kozak序列、ostir1编码序列和rbg pa序列;
5、2)将敲入鼠通过同源重组去除基因组中的loxp-stop-loxp序列,得到植物基因ostir1组织特异性表达小鼠。
6、优选的,所述步骤1中,利用crispr/cas9技术并通过同源重组修复将目的序列敲入至小鼠6号染色体上的rosa26基因第一内含子中。
7、优选的,所述同源重组修复是针对在grna引导下由结合到敲入位点附近的cas9蛋白造成的rosa26基因dna双链断裂进行的,所述敲入位点位于rosa26基因第一内含子中的grna靶位点,该靶位点的序列如下所示:5’—ctccagtctttctagaagatggg—3’。
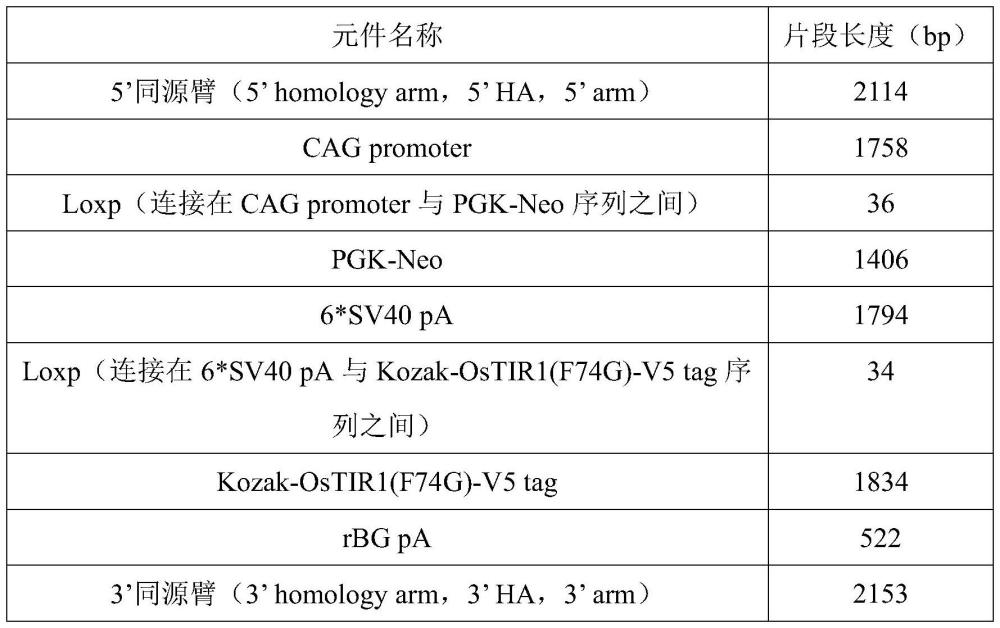
8、优选的,所述同源重组修复中采用的供体(donor)载体包括5’同源臂、3’同源臂,以及沿5’同源臂到3’同源臂方向依次排列的用于表达植物基因ostir1的启动子、以转录终止序列6*sv40 pa为核心组成的loxp-stop-loxp序列、以kozak序列和植物基因ostir1cds序列(或突变的植物基因ostir1 cds序列)及rbg pa序列为核心组成的表达序列;其中,5’同源臂为与rosa26基因第一内含子中敲入位点上游一段2.1~2.2kb的dna序列同源的序列片段,3’同源臂为与rosa26基因第一内含子中敲入位点下游一段2.1~2.2kb的dna序列同源的序列片段。
9、优选的,所述用于表达植物基因ostir1的启动子为cag启动子(cag promoter)。
10、优选的,所述donor载体还包括用于鉴定植物基因ostir1表达与否的标签序列(例如v5 tag序列)。
11、优选的,所述loxp-stop-loxp序列具体包括位于5’端loxp与3’端loxp之间的终止转录盒,所述终止转录盒包括pgk启动子和6*sv40 pa序列。
12、优选的,所述终止转录盒还包括位于pgk启动子和6*sv40 pa序列之间的抗性基因序列。
13、优选的,所述终止转录盒包括依次排列的pgk启动子、新霉素抗性基因序列(neo或neor)和6*sv40 pa序列。
14、优选的,所述步骤1具体包括以下步骤:
15、1.1)利用所述5’同源臂、cag启动子、loxp-stop-loxp序列以及所述表达序列和3’同源臂为主体构建donor载体;
16、1.2)将grna、cas9蛋白和构建得到的donor载体导入到野生型小鼠的受精卵中,然后将受精卵移植到假孕母鼠体内(所述cas9蛋白在grna引导下结合到位于rosa26基因第一内含子中的靶位点,进而由该cas9蛋白在其所识别的该靶位点的pam区附近进行剪切并造成rosa26基因dna双链断裂,从而引发同源重组修复),由假孕母鼠产出f0代小鼠;
17、1.3)将f0代小鼠与野生型小鼠交配并获得f1代小鼠,将f1代小鼠中保留有目的序列的杂合转基因小鼠自交,然后对子代小鼠中保留有目的序列的纯合转基因小鼠进行鉴定,得到可用于与组织特异性cre工具鼠配种繁育的纯合转基因鼠,即敲入鼠。
18、优选的,所述5’同源臂如seq.id.no.2所示,所述cag启动子参见seq.id.no.3,所述loxp-stop-loxp序列如seq.id.no.4所示,所述表达序列参见seq.id.no.5,所述3’同源臂如seq.id.no.6所示。
19、优选的,所述步骤2具体包括以下步骤:将敲入鼠与组织特异性cre工具鼠交配并获得cre阳性的杂合转基因子代,即表达植物基因ostir1的转基因小鼠。
20、优选的,所述cre工具鼠为pax7-cre工具鼠,该工具鼠的cre酶特异性表达于肌肉组织。
21、优选的,所述小鼠模型构建方法具体包括以下步骤:将含有5’同源臂的片段、含有cag启动子的片段、含有loxp-pgk-neo-6*sv40 pa-loxp序列的片段、含有kozak-osti r1(f74g)-v5 tag-rbg pa序列的片段和含有3’同源臂的片段,利用in-fusion技术与载体骨架连接,其中,ostir1(f74g)为第74位氨基酸由苯丙氨酸突变为甘氨酸的突变ostir 1的编码序列(即突变的植物基因ostir1 cds序列);将连接产物通过转化、单克隆筛选、菌液pcr及测序验证,得donor载体;将得到的donor载体与grna、cas9蛋白同时显微注射到野生型小鼠(例如c57bl/6j小鼠)的受精卵中,将经过显微注射的受精卵移植到假孕母鼠(例如c57bl/6j小鼠)体内并产出f0代小鼠,然后通过pcr和测序对含有目的序列的杂合小鼠(即完成敲入的阳性f0代杂合小鼠)进行鉴定;将完成敲入的阳性f0代杂合小鼠与野生型小鼠(例如c57bl/6j小鼠)交配后对获得的f1代小鼠进行pcr鉴定、自交,然后将子代(例如f2代)纯合转基因小鼠与肌肉特异性的pax7-cre工具鼠(例如改造自c57bl/6j小鼠)交配,然后通过pcr对子代(例如f3代)含有植物基因ostir1表达盒(即通过与cre工具鼠交配后使得转基因小鼠亲本所含目的序列中的loxp-pgk-neo-6*sv40 pa-loxp去除而形成的cagpromoter-loxp-kozak-ostir1(f74g)-v5 ta g-rbg pa序列)的cre阳性的杂合转基因小鼠进行鉴定,即获得肌肉组织特异性表达植物基因ostir1的转基因小鼠。
22、本发明的有益效果体现在:
23、本发明利用crispr/cas9技术在小鼠基因组定点敲入带有loxp-stop-loxp序列的植物基因ostir1表达盒,不仅可以通过同源重组的原理使小鼠后代的该序列发生缺失以实现所述表达盒的激活,从而构建了表达植物基因ostir1的转基因小鼠模型,而且通过所述表达盒中增强mrna翻译起始的kozak序列与提高终止转录效率的rbg pa序列的协同作用,为进一步构建蛋白快速降解系统模型小鼠提供了能够高效表达外源ostir1蛋白的小鼠样本。
24、进一步的,本发明通过对于以“loxp-stop-loxp序列”为条件激活元件的目的序列的优化,即在loxp-stop-loxp序列中引入由pgk启动子、6*sv40 pa序列构成的转录终止盒,解决了仅采用6*sv40 pa序列无法避免植物基因ostir1敲入小鼠(例如f0代小鼠)发生胚胎致死的问题。
25、进一步的,本发明通过在上述转录终止盒引入抗性基因序列(例如neo或neor),不仅使得植物基因ostir1敲入小鼠中引入了真核筛选标记,还可以使得基于cag-loxp-stop-loxp的目的序列在经同源重组后形成的植物基因ostir1表达盒(例如cag promoter-loxp-kozak-ostir1(f74g)-v5 tag-rbg pa序列)可以正常在小鼠体内表达(例如在肌肉组织中特异表达)。
26、进一步的,本发明针对利用crispr/cas9技术构建的f0代阳性鼠(即完成敲入的阳性f0代杂合小鼠)由于切割效率和可能的非同源修复会出现不同的遗传谱系,将f0代阳性鼠与野生型鼠交配,从而获得稳定基因型的f1代阳性鼠。
本文地址:https://www.jishuxx.com/zhuanli/20241118/328325.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。