通过温和氧化来生产改性的乳清蛋白组合物的方法、改性的乳清蛋白组合物以及改性的乳清蛋白组合物的营养用途与流程
- 国知局
- 2024-07-12 12:31:58
发明领域本发明涉及在暴露和选择性氧化β-乳球蛋白的游离硫醇基团的条件下通过温和氧化来制备改性的乳清蛋白组合物的方法。已经发现所得到的改性的乳清蛋白产品在例如富含蛋白质的饮料产品中具有优异的性能,并且已经特别发现在中性ph灭菌热处理期间以及在这样的饮料产品的消费期间产生降低水平的令人不愉快的气味。
背景技术:
0、背景
1、无菌、ph中性、富含乳清蛋白的饮料在热加工期间具有产生类似于臭鸡蛋气味的令人不愉快的气味的趋势。饮料通常在生产之后立即装瓶,并且因此当瓶子被打开时还使消费者暴露于令人不愉快的气味。
2、通过例如过氧化氢对乳清蛋白产品的氧化先前已经用于漂白乳清蛋白产品,并且产生具有改进的视觉品质和可接受的微生物学的乳清蛋白粉。然而,氧化还与感官问题有关,该感官问题诸如由于乳清蛋白组合物的某些组分的氧化降解而在储存期间产生令人不愉快的气味和颜色发展。
3、jervis等人(“effect of bleaching whey on sensory and functionalproperties of80%whey protein concentrate”;j.dairy sci.;95;第2848-2862页;2012)公开了在高温用过氧化氢或过氧化苯甲酰漂白高蛋白乳清蛋白浓缩物的效果的研究。使未加热的经重构的氧化的乳清蛋白粉的10%水溶液经历感官分析,其中观察到增加的“纸板风味”和“脂肪风味”,但“煮熟风味/乳风味”减少。
4、us20160235082a1公开了一种生产热稳定的乳清蛋白成分的方法,该方法可以通过在存在特定浓度的过氧化氢的情况下使乳清蛋白经历特定热处理来生产。乳清蛋白成分包括wpi、wpc或任何其他形式的乳清蛋白成分的热稳定的液体渗余物,并且wpi或wpc或任何其他乳清蛋白粉的热稳定粉末可以通过热处理与过氧化氢溶液混合的乳清蛋白溶液来制备。热稳定的乳清蛋白使起始乳清蛋白胱氨酸转化为胱氨酸磺酸,使得主要乳清蛋白β-乳球蛋白的游离氢巯基基团转化为化合物,诸如半胱氨酸磺酸和/或半胱氨酸,其被认为不仅最小化或消除不合意的胶凝,而且还是化合物的牛磺酸基团的前体。
技术实现思路
0、发明概述
1、本发明人已经发现,乳清蛋白产品的温和氧化可以用于减少或者甚至去除在生产含乳清蛋白的饮料期间产生的类似于臭鸡蛋气味的令人不愉快的气味。
2、本发明的方面涉及一种生产氧化的乳清蛋白组合物(oxidized whey proteincomposition)的方法,该方法包括
3、a)加工乳清蛋白源以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
4、-能够氧化半胱氨酸的硫醇基团的氧化剂,并且
5、具有:
6、-在6.5-9.5的范围内的ph,
7、-相对于氧化乳清蛋白溶液的重量的至少1%w/w的总蛋白质含量,
8、-相对于总蛋白质的至少10%w/w的β-乳球蛋白(blg)含量,
9、-优选地,相对于总固体的至少30%w/w的蛋白质含量,
10、-优选地,相对于总固体的至多3%w/w的总脂肪含量,
11、并且其中氧化乳清蛋白溶液还:
12、i)具有在0℃-160℃的范围内的温度,和/或
13、ii)被加压到在20巴-4000巴的范围内的压力,
14、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,优选地以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多15μmol/g蛋白质,所述一种或更多种条件涉及:
15、i)氧化乳清蛋白溶液具有在0℃-160℃的范围内的温度,和/或
16、ii)氧化乳清蛋白溶液被加压到在20巴-4000巴的范围内的压力,
17、c)任选地,但优选地,使从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物经历热处理步骤,该热处理步骤涉及加热到至少60℃的温度,
18、d)任选地,但优选地,干燥液体进料,该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
19、本发明的另一个方面涉及一种氧化的乳清蛋白组合物,该氧化的乳清蛋白组合物具有:
20、-相对于总固体的至少30%w/w的蛋白质含量,
21、-优选地,相对于总固体的至多3%w/w的脂肪含量,
22、-至多15μmol游离硫醇基团/g蛋白质,
23、-优选地,相对于总蛋白质的至少0.7%w/w的色氨酸含量,
24、-优选地,相对于总蛋白质的至少0.3%w/w的甲硫氨酸含量,
25、-优选地,至多0.2微克/mg蛋白质的犬尿氨酸含量,
26、-优选地,在100-600μmol/g蛋白质的范围内的蛋白质结合的硫的含量,
27、-优选地,在150-400μmol/g蛋白质的范围内的形成二硫键的蛋白质结合的半胱氨酸残基的含量。
28、-优选地,在18kda和10000kda之间、更优选地50kda-8000kda之间并且最优选地80kda-5000kda之间的范围内的蛋白质的重均分子量,和
29、-优选地,至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在18kda和10000kda之间的分子量。
30、本发明的另外的方面涉及一种生产食品产品的工艺,该工艺包括:
31、-加工本文描述的氧化的乳清蛋白组合物,和/或
32、-将所描述的氧化的乳清蛋白组合物和/或经加工的氧化的乳清蛋白组合物与一种或更多种另外的成分组合,并且任选地加工所述组合。
33、食品产品的优选的实例是具有5.5-8.5的ph的热处理的并且优选地热灭菌的饮料。
34、因此,本发明的更具体的方面涉及一种生产热处理的并且优选地热灭菌的饮料的工艺,该饮料具有5.5-8.5、更优选地6.5-7.5的ph,该工艺包括:
35、1)将如本文描述的氧化的乳清蛋白组合物与一种或更多种另外的成分组合,以获得液体混合物,该液体混合物具有5.5-8.5、更优选地6.5-7.5的ph,并且包含:
36、-足以贡献至少0.5%w/w蛋白质的量的氧化的乳清蛋白组合物,和
37、-水,
38、2)将液体混合物包装在容器、优选地无菌容器中,并且
39、其中液体混合物在包装之前和/或之后被热处理,并且优选地被热灭菌。
40、本发明的另外的方面涉及氧化的乳清蛋白组合物、优选地本发明的氧化的乳清蛋白组合物作为食品成分的用途,优选地用于改进气味和/或降低类似于热灭菌的饮料的臭鸡蛋气味的令人不愉快的气味水平,该热灭菌的饮料具有在5.5-8.5的范围内的ph,优选地具有至少3%w/w的乳清蛋白含量,并且优选地使用间接热处理进行热灭菌。
41、本发明的又一个方面涉及一种食品成分,该食品成分包含:
42、-本文描述的氧化的乳清蛋白组合物的固体,以及
43、-一种或更多种另外的成分,其优选地选自:
44、-乳品成分,优选地未氧化的乳品成分,
45、-基于植物的成分,
46、-非乳品碳水化合物来源,
47、-调味剂,和/或
48、-甜味剂(甜碳水化合物/多元醇/his)。
49、本发明的又一个方面涉及氧化的乳清蛋白组合物、优选地本发明的氧化的乳清蛋白组合物作为食品成分的用途,优选地用于改进气味和/或降低类似于热灭菌的饮料的臭鸡蛋气味的令人不愉快的气味水平,该热灭菌的饮料具有在5.5-8.5的范围内的ph,优选地具有至少3%w/w的乳清蛋白含量,并且优选地使用间接热处理进行热灭菌。
50、附图概述
51、图1示出了在实施例2b中经历模拟的uht处理的饮料样品的照片:样品1:wpi-b22(非加热的参考),样品2:wpi-b30;样品3:wpi-b29;样品4:wpi-b28;样品5:wpi-b27;样品6:wpi-b26;样品7:wpi-b25;样品8:wpi-b24;样品9:wpi-b23。
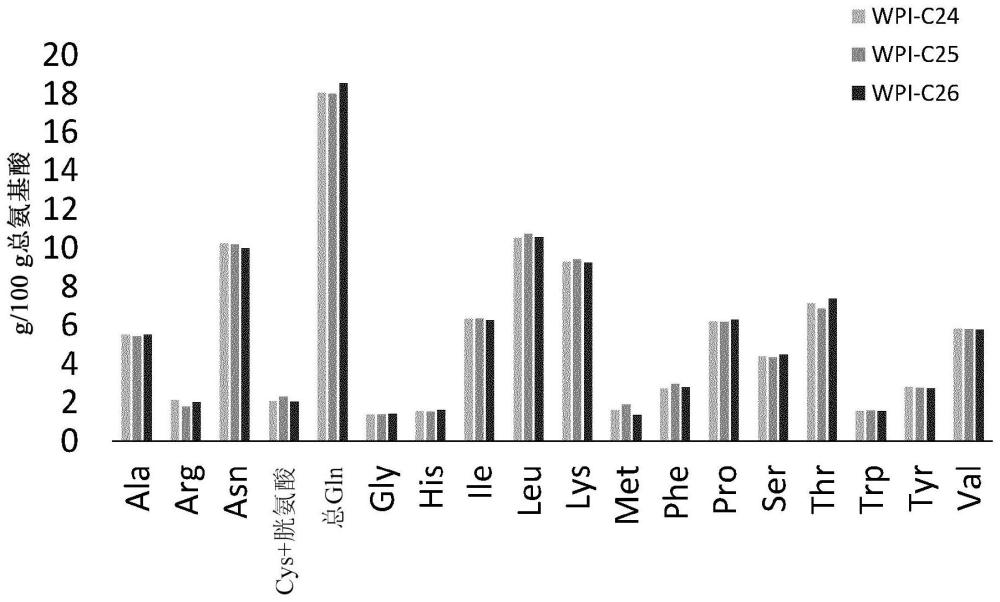
52、图2示出了未氧化的wpi参考(wpi-c24)、根据本发明的液体氧化的wpi(wpi-c25)和根据本发明的氧化的wpi粉末(wpi-c26)的氨基酸概况的图。图2证明了本发明允许β-乳球蛋白的游离硫醇的选择性氧化,而不损害乳清蛋白源的氨基酸组成。
53、发明描述
54、本发明的方面涉及一种生产氧化的乳清蛋白组合物的方法,该方法包括:
55、a)加工乳清蛋白源以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
56、-能够氧化半胱氨酸的硫醇基团的氧化剂,并且
57、具有:
58、-在6.5-9.5的范围内的ph,
59、-相对于氧化乳清蛋白溶液的重量的至少1%w/w的总蛋白质含量,
60、-相对于总蛋白质的至少10%w/w的β-乳球蛋白(blg)含量,
61、-优选地,相对于总固体的至少30%w/w的蛋白质含量,
62、-优选地,相对于总固体的至多3%w/w的总脂肪含量,
63、并且其中氧化乳清蛋白溶液还:
64、i)具有在0℃-160℃的范围内的温度,和/或
65、ii)被加压到在20巴-4000巴的范围内的压力,
66、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,优选地以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多15μmol/g蛋白质,所述一种或更多种条件涉及:
67、i)氧化乳清蛋白溶液具有在0℃-160℃的范围内的温度,和/或
68、ii)氧化乳清蛋白溶液被加压到在20巴-4000巴的范围内的压力,
69、c)任选地,但优选地,使从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物经历热处理步骤,该热处理步骤涉及加热到至少60℃的温度,
70、d)任选地,但优选地,干燥液体进料,该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
71、例如,本发明的优选的实施方案涉及一种生产氧化的乳清蛋白组合物的方法,该方法包括:
72、a)加工乳清蛋白源以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
73、-能够氧化半胱氨酸的硫醇基团的氧化剂,并且
74、具有:
75、-在6.5-9.5的范围内的ph,
76、-相对于氧化乳清蛋白溶液的重量的至少1%w/w的总蛋白质含量,
77、-相对于总蛋白质的至少10%w/w的β-乳球蛋白(blg)含量,
78、-优选地,相对于总固体的至少30%w/w的蛋白质含量,
79、-优选地,相对于总固体的至多3%w/w的总脂肪含量,
80、并且其中氧化乳清蛋白溶液还:
81、i)具有在0℃-65℃的范围内的温度,和/或
82、ii)被加压到在100巴-4000巴的范围内的压力,
83、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,优选地以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多15μmol/g蛋白质,所述一种或更多种条件涉及:
84、i)氧化乳清蛋白溶液具有在0℃-65℃的范围内的温度,和/或
85、ii)氧化乳清蛋白溶液被加压到在100巴-4000巴的范围内的压力,
86、c)任选地,但优选地,使从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物经历热处理步骤,该热处理步骤涉及加热到至少60℃的温度,
87、d)任选地,但优选地,干燥液体进料,该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
88、在本发明的上下文中,术语“氧化的乳清蛋白组合物”涉及这样的产品,该产品具有至多15μmol/g蛋白质并且最优选地至多10μmol/g蛋白质的游离硫醇基团含量,并且可以从本发明的方法可获得。
89、在本发明的上下文中,术语“游离硫醇基团”涉及例如存在于氨基酸半胱氨酸中的-sh基团。在乳清蛋白产品中,游离硫醇基团通常形成蛋白质的一部分,并且通常由蛋白质的半胱氨酸残基提供。在本发明的上下文中,术语“游离”意指-sh基团没有与其他-sh基团反应以形成二硫键(-s-s-)。根据分析e来测量游离硫醇基团的含量。
90、在本发明的上下文中,术语“硫醇基团的总量”涉及以-sh的形式(即作为游离硫醇)存在或以二硫键(-s-s-)的形式存在的硫醇基团的总和。根据分析e来测量硫醇基团的总量。
91、在本发明的上下文中,术语“氧化乳清蛋白溶液”涉及包含氧化剂诸如例如过氧化物的水性乳清蛋白溶液,该氧化剂可以氧化半胱氨酸的游离硫醇基团。
92、在本发明的上下文中,术语“β-乳球蛋白”或blg涉及来自哺乳动物物种的blg,例如呈天然形式和/或糖基化形式的blg,并且包括天然存在的遗传变体。术语blg还涵盖由重组微生物产生的哺乳动物blg。如本文使用的术语“blg”或“β-乳球蛋白”不包括解折叠的blg和聚集的blg。根据分析l来测量blg的含量。
93、在本发明的上下文中,术语“能够氧化半胱氨酸的硫醇基团的氧化剂”是指一种或更多种氧化剂,所述氧化剂通过它们氧化半胱氨酸的硫醇基团并且因此当使游离硫醇基团可获得时还氧化blg的游离硫醇基团的能力来表征。有用的实例是例如被批准用于食品生产的过氧化物,并且最优选地过氧化氢。
94、术语“乳清”涉及在乳中的酪蛋白已经沉淀和去除之后留下的液相。酪蛋白沉淀可以例如通过乳的酸化和/或通过使用凝乳酶(rennet enzyme)来实现。存在若干类型的乳清,诸如“甜乳清”,其是通过酪蛋白的基于凝乳酶的沉淀产生的乳清产品;以及“酸乳清(acid whey)”或“酸乳清(sour whey)”,其是通过酪蛋白的基于酸的沉淀产生的乳清产品。酪蛋白的基于酸的沉淀可以例如通过添加食品酸或通过细菌培养来完成。
95、术语“乳血清”涉及当酪蛋白和乳脂球已经例如通过微滤或大孔超滤从乳中去除时残留的液体。乳清还可以被称为“理想乳清”。
96、在本发明的上下文中,术语“乳清蛋白”涉及在乳清或乳血清中发现的蛋白质。乳清蛋白可以是在乳清或乳血清中发现的蛋白质物质的子集,并且甚至是单个乳清蛋白物质,或者它可以是在乳清中或/和在乳血清中发现的整套蛋白质物质。
97、未分级的乳清蛋白通常包含α-乳清蛋白(ala)、β-乳球蛋白(blg)、牛血清白蛋白、免疫球蛋白、骨桥蛋白、乳铁蛋白和乳过氧化物酶。除了其他蛋白质物质之外,衍生自凝乳酶处理的乳的乳清蛋白还包括酪蛋白巨肽(cmp)。
98、本文描述的分析方法用于确定与本发明相关的相应参数。
99、在本发明的一些优选的实施方案中,能够氧化半胱氨酸的硫醇基团的氧化剂包含以下项或者甚至由以下项组成:过氧化物、臭氧、分子氧或其组合。
100、特别优选的是,能够氧化半胱氨酸的硫醇基团的氧化剂包含一种或更多种过氧化物和溶解在氧化乳清蛋白溶液中的氧气或者甚至由一种或更多种过氧化物和溶解在氧化乳清蛋白溶液中的氧气组成。
101、甚至更优选地,能够氧化半胱氨酸的硫醇基团的氧化剂包含过氧化氢和溶解在氧化乳清蛋白溶液中的氧气或者甚至由过氧化氢和溶解在氧化乳清蛋白溶液中的氧气组成。
102、在本发明的一些优选的实施方案中,步骤a)的能够氧化半胱氨酸的硫醇基团的氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少50%mol/mol、更优选地至少70%mol/mol、甚至更优选地至少80%mol/mol并且最优选地至少90%mol/mol的量的过氧化物。
103、甚至更高含量的过氧化物通常是优选的,并且在本发明的一些优选的实施方案中,步骤a)的能够氧化半胱氨酸的硫醇基团的氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少92%mol/mol、更优选地至少94%mol/mol、甚至更优选地至少96%mol/mol并且最优选地至少98%mol/mol的量的过氧化物。
104、通常优选的是,能够氧化半胱氨酸的硫醇基团的氧化剂包含过氧化物或者甚至由过氧化物组成,所述过氧化物选自由过氧化氢、过氧化苯甲酰、过氧乙酸或其混合物组成的组。
105、特别优选的是,能够氧化半胱氨酸的硫醇基团的氧化剂包含过氧化氢或者甚至由过氧化氢组成。
106、在本发明的一些优选的实施方案中,步骤a)的能够氧化半胱氨酸的硫醇基团的氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少50%mol/mol、更优选地至少70%mol/mol、甚至更优选地至少80%mol/mol并且最优选地至少90%mol/mol的量的过氧化氢。
107、甚至更高含量的过氧化氢通常是优选的,并且在本发明的一些优选的实施方案中,步骤a)的能够氧化半胱氨酸的硫醇基团的氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少92%mol/mol、更优选地至少94%mol/mol、甚至更优选地至少96%mol/mol并且最优选地至少98%mol/mol的量的过氧化氢。
108、在本发明的一些优选的实施方案中,能够氧化半胱氨酸的硫醇基团的氧化剂用酶促方法产生。例如,通过使用乳糖氧化酶或己糖氧化酶,诸如例如葡萄糖氧化酶。
109、在其他优选的实施方案中,能够氧化半胱氨酸的硫醇基团的氧化剂用电化学方法产生。
110、存在两种主要方法用于将能够氧化半胱氨酸的硫醇基团的氧化剂定量供应到步骤a)的氧化乳清蛋白溶液。
111、在第一种方法中,在步骤a)期间添加所有需要的能够氧化半胱氨酸的硫醇基团的氧化剂,并且然后在步骤b)期间至少部分地使用。这种方法易于实施,但是通常比第二种方法略微更容易产生不期望的氧化。
112、第二种方法在步骤a)中使用相对低初始含量的能够氧化半胱氨酸的硫醇基团的氧化剂,但是涉及在步骤b)期间连续地或通过离散添加另外定量供应能够氧化半胱氨酸的硫醇基团的氧化剂。本发明人已经发现这种方法提供了游离硫醇基团的非常温和的氧化,但是比第一种方法实施略微更复杂。
113、此外,通过在步骤a)期间添加大部分氧化剂,但是在步骤b)期间补充一些氧化剂来实施该方法是可行的。
114、在本发明的一些优选的实施方案中,对于第一种方法特别有用的,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为至少1:2、更优选地至少1:1并且最优选地至少2:1:
115、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
116、-游离硫醇基团的总量。
117、通常优选的是,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为至少3:1、更优选地至少5:1并且最优选地至少10:1:
118、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
119、-游离硫醇基团的总量。
120、在本发明的上下文中,第一组分(a)的量和第二组分(b)的量之间的比意指a除以b,其还由a:b表示。
121、在第一种方法中,优选地,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:2-200:1、更优选地1:1-100:1、甚至更优选地2:1-30:1并且最优选地4:1-15:1:
122、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
123、-游离硫醇基团的总量。
124、可选择地,但关于第一种方法也是优选的,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:2-15:1、更优选地1:1.5-10:1、甚至更优选地1:1-8:1并且最优选地1:1-3:1:
125、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
126、-游离硫醇基团的总量。
127、通常优选的是,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:2-200:1、更优选地1:1-100:1、甚至更优选地2:1-30:1并且最优选地4:1-15:1:
128、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
129、-游离硫醇基团的总量。
130、可选择地,但也是优选的,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比可以为1:2-15:1、更优选地1:1.5-10:1、甚至更优选地1:1-8:1并且最优选地1:1-3:1:
131、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
132、-游离硫醇基团的总量。
133、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-15:1、更优选地1:1.5-10:1、甚至更优选地1:1.5-8:1并且最优选地1:1.5-3:1:
134、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
135、-游离硫醇基团的总量。
136、此外,关于第一种方法优选的是,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为2:1-30:1、更优选地3:1-25:1、甚至更优选地4:1-20:1并且最优选地5:1-15:1:
137、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
138、-游离硫醇基团的总量。
139、在本发明的其他优选的实施方案中,对于第二种方法特别有用的,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为至多5:1、更优选地至多2:1、甚至更优选地至多1:1并且最优选地至多1:2:
140、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
141、-游离硫醇基团的总量。
142、优选地,并且对于第二种方法特别有用的,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为至多1:4、更优选地至多1:10、甚至更优选地至多1:20并且最优选地至多1:40:
143、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
144、-游离硫醇基团的总量。
145、在第二种方法中,优选地,步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:100-5:1、更优选地1:60-2:1、甚至更优选地1:40-1:1并且最优选地1:20-1:2:
146、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
147、-游离硫醇基团的总量。
148、步骤a)的氧化乳清蛋白溶液具有在6.5-9.5的范围内的ph。
149、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液具有在7.0-9.5、更优选地7.1-8.5、甚至更优选地7.2-8.5并且最优选地7.4-8.2的范围内的ph。本发明人已经发现这些ph范围对于blg的游离硫醇基团的快速和选择性氧化特别有益。
150、在本发明的其他优选的实施方案中,步骤a)的氧化乳清蛋白溶液具有在7.5-9.5、更优选地7.6-8.5、甚至更优选地7.7-8.4并且最优选地7.7-8.3的范围内的ph。本发明人已经发现这些ph范围对于blg的游离硫醇基团的快速和选择性氧化特别有益。
151、可选择地,但也是优选的,步骤a)的氧化乳清蛋白溶液可以具有在6.5-8.5、更优选地6.6-8.0、甚至更优选地6.7-7.5并且最优选地6.8-7.3的范围内的ph。
152、本发明人已经发现,以至少1%w/w、优选地甚至更高的蛋白质含量操作该方法是有利的,以提高生产能力并减少该工艺的水和能量消耗,特别是当需要干燥时。
153、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的重量的至少2%w/w、更优选地至少3%w/w、甚至更优选地至少5%w/w并且最优选地至少6%w/w的总蛋白质含量。
154、优选地,步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的重量的1%w/w-30%w/w、更优选地3%w/w-20%w/w、甚至更优选地4%w/w-15%w/w并且最优选地至少6%w/w-10%w/w的范围内的总蛋白质含量。
155、本发明人已经观察到,将蛋白质含量保持在12%w/w或低于12%w/w通常是有利的,因为这似乎限制了在步骤b)期间引起的蛋白质聚集水平。通常优选的是,步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的重量的1%w/w-12%w/w、更优选地3%w/w-11%w/w、甚至更优选地4%w/w-10%w/w并且最优选地至少5%w/w-9%w/w的范围内的总蛋白质含量。
156、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的总固体的至少30%w/w、更优选地相对于氧化乳清蛋白溶液的总固体的至少50%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总固体的至少75%w/w并且最优选地相对于氧化乳清蛋白溶液的总固体的至少85%w/w的总蛋白质含量。
157、优选地,步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的总固体的30%w/w-99%w/w、更优选地相对于氧化乳清蛋白溶液的总固体的50%w/w-97%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总固体的75%w/w-96%w/w并且最优选地相对于氧化乳清蛋白溶液的总固体的至少85%w/w-95%w/w的范围内的总蛋白质含量。
158、步骤a)的氧化乳清蛋白溶液具有相对于总蛋白质的至少10%w/w的blg含量。
159、本发明人已经发现乳清蛋白blg至少是在ph中性食品产品的热处理期间令人不愉快的气味的形成的部分原因,并且blg的游离硫醇基团被认为参与气味形成。因此,本发明特别适用于乳清蛋白源的加工,该乳清蛋白源包含一些blg和优选地相对于总蛋白质的至少10%w/w的blg。
160、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的总蛋白质的至少20%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少40%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少45%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的至少50%w/w的blg含量。
161、甚至更优选的是,步骤a)的氧化乳清蛋白溶液可以具有相对于氧化乳清蛋白溶液的总蛋白质的至少55%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少60%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少80%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的至少90%w/w的blg含量。
162、优选地,步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的总蛋白质的10%w/w-99%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的45%w/w-98%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的80%w/w-96%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的90%w/w-95%w/w的范围内的blg含量。
163、可选择地,但也是优选的,步骤a)的氧化乳清蛋白溶液可以具有在相对于氧化乳清蛋白溶液的总蛋白质的10%w/w-90%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的20%w/w-80%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的30%w/w-75%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的45%w/w-70%w/w的范围内的blg含量。
164、关于乳清蛋白源的蛋白质组合物所描述的特征和偏好同样适用于步骤a)的氧化乳清蛋白溶液的蛋白质组合物。
165、步骤a)的氧化乳清蛋白溶液和已经从中制备其的乳清蛋白源通常还包含至少微量的其他乳清蛋白。例如,步骤a)的氧化乳清蛋白溶液和已经从中制备其的乳清蛋白源通常还包含α-乳清蛋白(ala)、酪蛋白巨肽(cmp)、牛血清白蛋白、免疫球蛋白、骨桥蛋白、乳铁蛋白和乳过氧化物酶中的一种或更多种。
166、步骤a)的氧化乳清蛋白溶液和已经从中制备其的乳清蛋白源优选地包含相对于总蛋白质的至多20%w/w、更优选地相对于总蛋白质的至多10%w/w、甚至更优选地相对于总蛋白质的至多6%w/w并且最优选地相对于总蛋白质的至多2%w/w的量的酪蛋白。
167、本发明人已经发现,步骤a)的氧化乳清蛋白溶液的脂肪水平优选地保持为低的,并且优选地低于通常在乳清蛋白浓缩物和高脂肪wpi中发现的脂肪水平。
168、优选地,步骤a)的氧化乳清蛋白溶液具有相对于总固体的至多3%w/w的总脂肪含量。
169、甚至更低水平的脂肪通常是优选的,并且通常优选的是,步骤a)的氧化乳清蛋白溶液具有相对于总固体的至多1%w/w、更优选地相对于总固体的至多0.5%w/w、甚至更优选地相对于总固体的至多0.2%w/w并且最优选地相对于总固体的至多0.1%w/w的总脂肪含量。
170、步骤a)的氧化乳清蛋白溶液可以包含多种量的碳水化合物。
171、然而,通常优选的是,步骤a)的氧化乳清蛋白溶液具有相对于总固体的至多65%w/w的碳水化合物含量。
172、甚至更低水平的碳水化合物通常是优选的,并且通常优选的是,步骤a)的氧化乳清蛋白溶液具有相对于总固体的至多20%w/w、更优选地相对于总固体的至多8%w/w、甚至更优选地相对于总固体的至多2%w/w并且最优选地相对于总固体的至多0.2%w/w的碳水化合物含量。
173、步骤a)的氧化乳清蛋白溶液优选地具有至多30%、更优选地至多25%、甚至更优选地至多20%并且最优选地至多15%的蛋白质变性程度。
174、根据wo 2020/002426的实施例1.3来确定蛋白质变性程度。
175、甚至更低的蛋白质变性程度通常是优选的,并且在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液优选地具有至多12%、更优选地至多10%、甚至更优选地至多8%并且最优选地至多5%的蛋白质变性程度。
176、步骤a)的氧化乳清蛋白溶液优选地具有相对于总固体的至多8%w/w、更优选地至多6%w/w、甚至更优选地至多5%并且最优选地至多4.0%的灰分含量。
177、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液优选地具有相对于总固体的0.4%w/w-8%w/w、更优选地相对于总固体的至多0.5%w/w-6%w/w、甚至更优选地相对于总固体的0.5%w/w-5%w/w并且最优选地相对于总固体的0.6%w/w-4.0%w/w的灰分含量。
178、根据wo 2020/002426的实施例1.13来确定组合物的灰分含量。
179、步骤a)的氧化乳清蛋白溶液优选地具有相对于总固体的至多1%w/w、更优选地相对于总固体的至多0.7%w/w、甚至更优选地相对于总固体的至多0.5%w/w并且最优选地相对于总固体的至多0.2%w/w的镁和钙的组合含量。
180、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液优选地具有相对于总固体的0.01%w/w-1%w/w、更优选地相对于总固体的至多0.001%w/w-0.7%w/w、甚至更优选地相对于总固体的0.01%w/w-0.5%w/w并且最优选地相对于总固体的0.01%w/w-0.2%w/w的镁和钙的组合含量。
181、步骤a)的氧化乳清蛋白溶液具有0.5%w/w-50%w/w、更优选地1%w/w-35%w/w、甚至更优选地2%w/w-20%w/w并且最优选地3%w/w-10%w/w的固体含量。
182、步骤a)的氧化乳清蛋白溶液的不由固体组成的部分优选地包含水。步骤a)的氧化乳清蛋白溶液的不由固体组成的部分优选地包含至少80%w/w、更优选地至少90%w/w、甚至更优选地95%w/w并且更优选地至少99%w/w的量的水。
183、步骤a)的氧化乳清蛋白溶液还:
184、i)具有在0℃-160℃的范围内的温度,和/或
185、ii)被加压到在20巴-4000巴的范围内的压力。
186、这意味着步骤a)的氧化乳清蛋白溶液必须:
187、i)具有在0℃-160℃的范围内的温度,或
188、ii)被加压到在20巴-4000巴的范围内的压力,或
189、i+ii)具有在0℃-160℃的范围内的温度并且被加压到在20巴-4000巴的范围内的压力。
190、在本发明的一些优选的实施方案中,步骤a)包括条件i)。
191、在本发明的其他优选的实施方案中,步骤a)包括条件ii)。
192、在本发明的另外优选的实施方案中,步骤a)包括特征i)和特征ii)两者。
193、同时使用i)的温度范围和ii)的压力范围两者来实施本发明是可行的,并且本发明人已经发现升高的温度和增加的压力两者都有利于在本文描述的条件下blg的游离硫醇的选择性氧化。
194、优选地,步骤a)的条件i)涉及氧化乳清蛋白溶液具有在5℃-65℃、更优选地10℃-65℃、甚至更优选地30℃-60℃并且最优选地40℃-55℃的范围内的温度。
195、本发明人已经发现,接近ph 6.5的最低ph范围需要比更高ph范围更高的温度来进行有效氧化。
196、在本发明的一些实施方案中,步骤a)的氧化乳清蛋白溶液的ph在6.5-7.0的范围内,并且其温度在40℃-65℃、更优选地45℃-65℃、甚至更优选地50℃-65℃并且最优选地55℃-65℃的范围内。
197、在本发明的一些优选的实施方案中,步骤a)的氧化乳清蛋白溶液的ph在7.1-9.5的范围内,并且其温度在5℃-65℃、更优选地10℃-65℃、甚至更优选地30℃-60℃并且最优选地40℃-55℃的范围内。
198、在本发明的其他优选的实施方案中,步骤a)的氧化乳清蛋白溶液的ph在8.5-9.5的范围内,并且其温度在0℃-65℃、更优选地0℃-50℃、甚至更优选地0℃-30℃并且最优选地5℃-25℃的范围内。
199、本发明人已经发现,特别优选的是,步骤a)的氧化乳清蛋白溶液的ph在7.5-8.5的范围内,并且其温度在5℃-60℃、更优选地10℃-60℃、甚至更优选地15℃-60℃并且最优选地20℃-60℃的范围内。这些范围似乎有利于blg的游离硫醇的选择性氧化和相对快速的反应动力学两者。
200、另外,本发明人已经发现,特别优选的是,步骤a)的氧化乳清蛋白溶液的ph在7.7-8.5的范围内,并且其温度在25℃-55℃、更优选地30℃-55℃、甚至更优选地35℃-50℃并且最优选地35℃-45℃的范围内。这些范围也似乎有利于blg的游离硫醇的选择性氧化和相对快速的反应动力学两者。
201、本发明人已经发现,从生产角度来看,步骤a)的氧化乳清蛋白溶液具有在6.8-7.5的范围内的ph有时是有利的,因为这减少了对在氧化之后ph调节的需求。
202、本发明人已经观察到,甚至更高的温度可以在步骤a)中使用,并且在本发明的一些优选的实施方案中,条件i)涉及步骤a)的氧化乳清蛋白溶液具有在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内的温度。
203、另外,本发明人已经发现,特别优选的是,步骤a)的氧化乳清蛋白溶液的ph在7.5-8.5、更优选地7.7-8.5的范围内,并且其温度在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内。这些范围还似乎有利于blg的游离硫醇的选择性氧化和相对快速的反应动力学两者。如实施例16中看到的,这些组合允许非常快速的步骤b),以及在大约几分钟或更短时间内完成的氧化过程。
204、当步骤a)使用条件i)时,氧化乳清蛋白溶液的压力通常小于100巴,并且通常在0.1巴-100巴的范围内并且更优选地在1巴-80巴的范围内。
205、100巴或更高的压力可以通过将步骤a)的条件i)和条件ii)组合来使用。
206、优选地,步骤a)的条件ii)涉及使步骤a)的氧化乳清蛋白溶液经历在20巴-4000巴、更优选地200巴-3500巴、甚至更优选地300巴-3000巴并且最优选地500巴-2500巴的范围内的压力。
207、在本发明的一些优选的实施方案中,步骤a)的条件ii)涉及使步骤a)的氧化乳清蛋白溶液经历在100巴-1000巴、更优选地150巴-800巴、甚至更优选地200巴-600巴并且最优选地200巴-500巴的范围内的压力。
208、在本发明的其他优选的实施方案中,条件ii)涉及使步骤a)的氧化乳清蛋白溶液经历在25巴-1000巴、更优选地30巴-500巴、甚至更优选地35巴-300巴并且最优选地40巴-200巴的范围内的压力。
209、当在步骤a)中使用条件ii)时,温度通常在0℃-65℃、更优选地5℃-65℃、甚至更优选地20℃-60℃并且最优选地40℃-60℃的范围内。因此,条件ii)优选地与条件i)一起使用,而可以在没有条件ii)的情况下使用条件i)。
210、本发明人已经发现,当步骤a)还涉及条件ii)时,较低的温度通常是足够的。在本发明的一些优选的实施方案中,步骤a)涉及条件ii)的使用,并且步骤a)的氧化乳清蛋白溶液具有在0℃-50℃、更优选地0℃-40℃、甚至更优选地0℃-30℃并且最优选地2℃-20℃的范围内的温度。
211、然而,当在步骤a)中使用条件ii)时,温度还可以在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内。
212、步骤a)中乳清蛋白源的加工通常涉及一个或更多个工艺步骤,所述一个或更多个工艺步骤使乳清蛋白源与能够氧化半胱氨酸的硫醇的氧化剂接触,并且将蛋白质含量、ph以及温度和/或压力调节至期望的水平。
213、优选地,步骤a)中乳清蛋白源的加工涉及以下项的至少i)和ii)以及任选地还有iii)和/或iv):
214、i)优选地通过组合或混合,使乳清蛋白源与至少一种能够氧化半胱氨酸的硫醇的氧化剂和任选地另外的成分例如水接触;
215、ii)如果需要,ph调节以获得期望的ph范围,例如在6.5-9.5的范围内的ph;
216、iii)任选地,加压以获得期望的压力范围,例如在20巴-4000巴,诸如例如100巴-4000巴或20巴-200巴的范围内的压力;
217、iv)任选地,将温度调节到期望的温度范围,例如在0℃-160℃,诸如例如0℃-65℃或66℃-160℃的范围内的温度。
218、通常优选的是,将氧化乳清蛋白溶液保持为液体形式,并且如果氧化乳清蛋白溶液的温度超过例如100℃,则该溶液可以被加压以避免沸腾和蒸发。
219、在步骤a)中,加工步骤i)、ii)、iii)和iv)的顺序不太重要,只要获得具有期望的特性的氧化乳清蛋白溶液。
220、加工步骤ii)的ph调节优选地在加工步骤i)之前或在加工步骤i)期间发生。可选择地,加工步骤ii)的ph调节可以在加工步骤i)之后发生。然而,在步骤a)中通常优选的是,使其中乳清蛋白源和氧化剂接触但是其中ph和温度和/或压力在期望的范围之外的持续时间最小化。
221、加工步骤iii)优选地在加工步骤i)之后发生。
222、加工步骤iv)优选地在加工步骤i)之前、在加工步骤i)期间或在加工步骤i)之后发生。
223、优选地,在步骤a)期间乳清蛋白源和包含乳清蛋白源的任何中间体混合物具有不高于65℃并且最优选地不高于55℃的温度。
224、在本发明的上下文中,术语“乳清蛋白源”涉及用于制备步骤a)的氧化乳清蛋白溶液的乳清蛋白组合物。乳清蛋白源可以是单一乳清蛋白组合物,例如乳清蛋白粉或水性乳清蛋白液体,或者它可以是若干个子源,例如若干种乳清蛋白粉和/或若干种水性乳清蛋白液体的组合。如果使用若干个子源,则它们可以在制备步骤a)的氧化乳清蛋白溶液之前组合以形成单一组合物,或者它们可以在制备步骤a)的氧化乳清蛋白溶液期间被单独地添加。如果使用若干个子源,则术语“乳清蛋白源”描述了所使用的子源的组合的特征。
225、乳清蛋白源可以是粉末或液体。如果以粉末形式提供,则优选的是,乳清蛋白源粉末在水中重构并且在进行另外的加工之前允许水合持续至少0.5小时。
226、乳清蛋白源优选地是乳清蛋白浓缩物(wpc)、乳清蛋白分离物(wpi)或其组合。
227、在本发明的上下文中,术语“乳清蛋白浓缩物(wpc)”涉及包含相对于总固体的20%w/w-89%w/w的蛋白质总量的干组合物或水性组合物。
228、wpc优选地包含:
229、相对于总固体的30%w/w-85%w/w的蛋白质,
230、相对于总蛋白质的15%w/w-90%w/w的blg,
231、相对于总蛋白质的4%w/w-50%w/w的ala,以及
232、相对于蛋白质的0%w/w-40%w/w的cmp。
233、最优选地,wpc包含:
234、相对于总固体的70%w/w-85%w/w的蛋白质,
235、相对于总蛋白质的30%w/w-90%w/w的blg,
236、相对于总蛋白质的4%w/w-35%w/w的ala,以及
237、相对于蛋白质的0%w/w-25%w/w的cmp。
238、基于乳血清蛋白的wpc通常不包含cmp或仅包含微量的cmp。
239、术语“乳清蛋白分离物(wpi)”涉及包含相对于总固体的86%w/w-100%w/w的蛋白质总量的干组合物或水性组合物。
240、wpi优选地包含:
241、相对于总固体的86%w/w-99%w/w的蛋白质,
242、相对于总蛋白质的30%w/w-100%w/w的blg,
243、相对于总蛋白质的0%w/w-35%w/w的ala,以及
244、相对于总蛋白质的0%w/w-25%w/w的cmp。
245、最优选地,wpi包含:
246、相对于总固体的90%w/w-99%w/w的蛋白质,
247、相对于总蛋白质的50%w/w-99%w/w的blg,
248、相对于总蛋白质的0%w/w-35%w/w的ala,以及
249、相对于总蛋白质的0%w/w-25%w/w的cmp。
250、基于乳血清蛋白的wpi通常不包含cmp或仅包含微量的cmp。
251、特别优选的是,乳清蛋白源是wpi。
252、关于步骤a)的氧化乳清蛋白溶液的蛋白质组成、脂肪组成、碳水化合物组成和矿物质组成所描述的特征和偏好同样适用于乳清蛋白源。
253、乳清蛋白源优选地具有至多30%、更优选地至多25%、甚至更优选地至多20%并且最优选地至多15%的蛋白质变性程度。
254、甚至更低的蛋白质变性程度通常是优选的,并且在本发明的一些优选的实施方案中,乳清蛋白源具有至多12%、更优选地至多10%、甚至更优选地至多8%并且最优选地至多5%的蛋白质变性程度。
255、在步骤b)中,氧化乳清蛋白溶液在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育。
256、“一种或更多种条件”意指在特定的温度条件下和/或在特定的压力条件下。
257、本发明人已经发现,如果该方法包括步骤c)的热处理,则即使游离硫醇基团中的仅一些游离硫醇基团的氧化,在本发明的上下文中被称为“部分氧化”,可能是足够的,并且已经看到氧化的硫醇基团在步骤c)期间与未氧化的游离硫醇基团反应并形成稳定的分子间二硫键的证据。
258、在本发明的一些优选的实施方案中,步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%。
259、在本发明的一些优选的实施方案中,步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%。当该方法包括步骤c)时,这些范围通常是优选的。
260、在本发明的一些优选的实施方案中,与步骤c)相关或与步骤c)不相关两者,步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%。
261、优选地,并且与步骤c)相关或与步骤c)不相关两者,步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多10%、更优选地初始量的至多5%、甚至更优选地初始量的至多3%并且最优选地初始量的至多1%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多10%、更优选地初始量的至多5%、甚至更优选地初始量的至多3%并且最优选地初始量的至多1%。
262、少量残余的游离硫醇通常可以是容忍的,并且甚至可以是合意的,以避免使乳清蛋白溶液的其他组分经历不必要的氧化损坏。优选地,步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的0.01%-30%、更优选地初始量的0.02%-25%、甚至更优选地初始量的0.05%-20%并且最优选地初始量的0.1%-10%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的0.01%-30%、更优选地初始量的0.02%-25%、甚至更优选地初始量的0.05%-20%并且最优选地初始量的0.1%-10%。
263、在本发明的一些优选的实施方案中,步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到至多15μmol/g蛋白质、更优选地至多14μmol/g蛋白质、甚至更优选地至多13μmol/g蛋白质并且最优选地至多12μmol/g蛋白质,或者进行步骤b)持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多15μmol/g蛋白质、更优选地至多14μmol/g蛋白质、甚至更优选地至多13μmol/g蛋白质并且最优选地至多12μmol/g蛋白质的持续时间。
264、优选地,步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-15μmol/g蛋白质、更优选地0.01-14μmol/g蛋白质、甚至更优选地0.01-13μmol/g蛋白质并且最优选地0.01-12μmol/g蛋白质,或者进行步骤b)持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-15μmol/g蛋白质、更优选地0.01-14μmol/g蛋白质、甚至更优选地0.01-13μmol/g蛋白质并且最优选地0.01-12μmol/g蛋白质的持续时间。
265、更低水平通常是优选的,并且在本发明的一些优选的实施方案中,步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质,或者进行步骤b)持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质的持续时间。
266、优选地,步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-10μmol/g蛋白质、更优选地0.01-8μmol/g蛋白质、更优选地0.01-5μmol/g蛋白质、甚至更优选地0.01-3μmol/g蛋白质并且最优选地0.01-2μmol/g蛋白质,或者进行步骤b)持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-10μmol/g蛋白质、更优选地0.01-8μmol/g蛋白质、更优选地0.01-5μmol/g蛋白质、甚至更优选地0.01-3μmol/g蛋白质并且最优选地0.01-2μmol/g蛋白质的持续时间。
267、甚至更低水平的游离硫醇基团可以是期望的,并且在本发明的一些优选的实施方案中,步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质,或者进行步骤b)持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质的持续时间。
268、本发明人已经观察到步骤b)的氧化引起乳清蛋白溶液的ph的轻微降低,并且已经发现在步骤b)期间调节ph以将其保持在期望的ph区间通常是有利的。特别地,当使用较高的在氧化剂和硫醇基团之间的比率时。
269、在本发明的一些优选的实施方案中,步骤b)涉及在氧化期间将ph调节到在6.5-9.5、更优选地7.0-8.5、甚至更优选地7.2-8.5并且最优选地7.5-8.5的范围内的ph。
270、本发明人已经发现,在ph 7.0-8.5、甚至更优选地7.2-8.5并且最优选地7.5-8.5的范围内进行氧化,相对于乳清蛋白溶液内的其他氧化靶诸如例如甲硫氨酸和色氨酸,产生游离硫醇基团的选择性氧化。
271、优选地,步骤b)涉及在氧化期间将ph调节到在7.5-9.5、更优选地7.6-8.5、甚至更优选地7.7-8.4并且最优选地7.7-8.3的范围内的ph。
272、步骤b)的ph调节可以例如涉及一个或更多个离散的ph调节,或者更优选地连续的ph控制,例如使用ph stat。ph调节优选地采用一种或更多种食品可接受的酸和/或碱。
273、本发明人已经发现,在步骤b)期间限制消耗的氧化剂的量是有益的,特别是为了避免不合意的氧化反应。
274、在本发明的一些优选的实施方案中,以下项之间的摩尔比为1:2-30:1、更优选地1:2-25:1、甚至更优选地1:2-20:1并且最优选地1:1-15:1:
275、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
276、-步骤a)中游离硫醇基团的初始量。
277、通常优选的是,以下项之间的摩尔比为2:1-30:1、更优选地3:1-25:1、甚至更优选地4:1-20:1并且最优选地5:1-15:1:
278、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
279、-步骤a)中游离硫醇基团的初始量。
280、本发明人已经发现,令人惊讶地,即使游离硫醇基团的部分氧化与步骤c)的热处理相结合产生具有非常低含量的游离硫醇基团的氧化的乳清蛋白组合物。因此,在本发明的一些优选的实施方案中,以下项之间的摩尔比为1:4-15:1、更优选地1:3-10:1、甚至更优选地1:2-5:1并且最优选地1:2-2:1:
281、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
282、-步骤a)中游离硫醇基团的初始量。
283、优选地,步骤b)和本发明的方法本身不涉及亚硫酸盐的添加并且不涉及亚硫酸化溶解(sulphitolysis)。
284、在本发明的一些优选的实施方案中,步骤b)的一种或更多种条件涉及i)氧化乳清蛋白溶液具有在5℃-65℃、更优选地10℃-65℃、甚至更优选地30℃-60℃并且最优选地40℃-60℃的范围内的温度。
285、步骤b)的氧化乳清蛋白溶液的温度的温度范围优选地与步骤a)的氧化乳清蛋白溶液的温度的温度范围相同。然而,本发明人还已经发现在步骤b)期间提高温度可能是有益的,例如如果步骤a)提供相对低的温度,并且他们已经发现步骤b)可以包含若干个不同的温度阶段。
286、本发明人已经发现,接近ph 6.5的最低ph范围需要比更高ph范围更高的温度来进行有效氧化。
287、在本发明的一些实施方案中,步骤b)的氧化乳清蛋白溶液的ph在6.5-7.0的范围内,并且其温度在40℃-65℃、更优选地45℃-65℃、甚至更优选地50℃-65℃并且最优选地55℃-65℃的范围内。
288、在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的ph在7.1-9.5的范围内,并且其温度在5℃-65℃、更优选地10℃-65℃、甚至更优选地30℃-60℃并且最优选地40℃-55℃的范围内。
289、在本发明的其他优选的实施方案中,步骤b)的氧化乳清蛋白溶液的ph在8.5-9.5的范围内,并且其温度在0℃-65℃、更优选地0℃-50℃、甚至更优选地0℃-30℃并且最优选地5℃-25℃的范围内。
290、本发明人已经发现,特别优选的是,步骤b)的氧化乳清蛋白溶液的ph在7.5-8.5的范围内,并且其温度在5℃-60℃、更优选地10℃-60℃、甚至更优选地15℃-60℃并且最优选地20℃-60℃的范围内。这些范围似乎有利于blg的游离硫醇的选择性氧化和相对快速的反应动力学两者。
291、另外,本发明人已经发现,特别优选的是,步骤b)的氧化乳清蛋白溶液的ph在7.7-8.5的范围内,并且其温度在25℃-55℃、更优选地30℃-55℃、甚至更优选地35℃-50℃并且最优选地35℃-45℃的范围内。这些范围也似乎有利于blg的游离硫醇的选择性氧化和相对快速的反应动力学两者。
292、本发明人已经发现,可以在步骤b)中使用甚至更高的温度,并且在本发明的一些优选的实施方案中,条件i)涉及步骤b)的氧化乳清蛋白溶液具有在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内的温度。
293、另外,本发明人已经发现,特别优选的是,步骤b)的氧化乳清蛋白溶液的ph在7.5-8.5、更优选地7.7-8.5的范围内,并且其温度在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内。这些范围也似乎有利于blg的游离硫醇的选择性氧化和相对快速的反应动力学两者。如实施例16中看到的,这些组合允许非常快速的步骤b),以及在大约几分钟或更短时间内完成的氧化过程。
294、本发明人已经发现,从生产角度来看,步骤b)的氧化乳清蛋白溶液具有在6.8-7.5的范围内的ph有时是有利的,因为这减少了对在氧化之后ph调节的需求。
295、在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%的持续时间。
296、如上文提及的,游离硫醇基团的部分氧化对于步骤c)的热处理可能是有利的,并且在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%的持续时间。
297、优选地,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%的持续时间。
298、优选地,在步骤b)期间,温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多10%、更优选地初始量的至多5%、甚至更优选地初始量的至多3%并且最优选地初始量的至多1%的持续时间。
299、优选地,在步骤b)期间,温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的0.01%-30%、更优选地初始量的0.02%-25%、甚至更优选地初始量的0.05%-20%并且最优选地初始量的0.1%-10%的持续时间。
300、优选地,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多15μmol/g蛋白质、更优选地至多14μmol/g蛋白质、甚至更优选地至多13μmol/g蛋白质并且最优选地至多12μmol/g蛋白质的持续时间。
301、通常,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-15μmol/g蛋白质、更优选地0.01-14μmol/g蛋白质、甚至更优选地0.01-13μmol/g蛋白质并且最优选地0.01-12μmol/g蛋白质的持续时间。
302、优选地,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质的持续时间。
303、优选地,步骤b)保持在期望的温度范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-10μmol/g蛋白质、更优选地0.01-8μmol/g蛋白质、更优选地0.01-5μmol/g蛋白质、甚至更优选地0.01-3μmol/g蛋白质并且最优选地0.01-2μmol/g蛋白质的持续时间。
304、甚至更低水平的游离硫醇基团可以是期望的,并且在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质的持续时间。
305、当步骤b)使用条件i)时,氧化乳清蛋白溶液的压力通常小于100巴,并且通常在0.1巴-100巴的范围内并且更优选地在1巴-80巴的范围内。
306、100巴或更高的压力可以通过将步骤b)的条件i)和条件ii)组合来使用。
307、在本发明的其他优选的实施方案中,步骤b)涉及条件ii),其中使氧化乳清蛋白溶液经历在20巴-4000巴、更优选地200巴-3500巴、甚至更优选地300巴-3000巴并且最优选地500巴-2500巴的范围内的压力。
308、然而,在本发明的另外优选的实施方案中,条件ii)涉及使氧化乳清蛋白溶液经历在20巴-500巴、更优选地30巴-300巴并且最优选地40巴-200巴的范围内的压力。
309、步骤b)的氧化乳清蛋白溶液的压力的压力范围优选地与步骤a)的氧化乳清蛋白溶液的压力的压力范围相同。
310、在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%的持续时间。
311、如上文提及的,游离硫醇基团的部分氧化对于步骤c)的热处理可能是有利的,并且在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%的持续时间。
312、优选地,使步骤b)的氧化乳清蛋白溶液经历压力,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%的持续时间。
313、优选地,在步骤b)期间,压力保持在期望的压力范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多10%、更优选地初始量的至多5%、甚至更优选地初始量的至多3%并且最优选地初始量的至多1%的持续时间。
314、优选地,在步骤b)期间,压力保持在期望的压力范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的0.01%-30%、更优选地初始量的0.02%-25%、甚至更优选地初始量的0.05%-20%并且最优选地初始量的0.1%-10%的持续时间。
315、优选地,并且与具有或不具有步骤c)的实施方案相关,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多15μmol/g蛋白质、更优选地至多14μmol/g蛋白质、甚至更优选地至多13μmol/g蛋白质并且最优选地至多12μmol/g蛋白质的持续时间。
316、在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-15μmol/g蛋白质、更优选地0.001-14μmol/g蛋白质、甚至更优选地0.001-13μmol/g蛋白质并且最优选地0.001-12μmol/g蛋白质的持续时间。
317、优选地,并且与具有或不具有步骤c)的实施方案相关,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质的持续时间。
318、在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到0.001-10μmol/g蛋白质、更优选地0.01-8μmol/g蛋白质、更优选地0.01-5μmol/g蛋白质、甚至更优选地0.01-3μmol/g蛋白质并且最优选地0.01-2μmol/g蛋白质的持续时间。
319、甚至更低水平的游离硫醇基团可以是期望的,并且在本发明的一些优选的实施方案中,步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将氧化乳清蛋白溶液的游离硫醇的量减少到至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质的持续时间。
320、当在步骤b)中使用条件ii)时,温度通常在0℃-65℃、更优选地5℃-65℃、甚至更优选地20℃-60℃并且最优选地40℃-60℃的范围内。因此,条件ii)通常与条件i)一起使用,而条件i)可以在没有条件ii)的情况下使用。
321、本发明人已经发现,当步骤b)还涉及条件ii)时,较低的温度通常是足够的。在本发明的一些优选的实施方案中,步骤b)涉及条件ii)的使用,氧化乳清蛋白溶液具有在0℃-50℃、更优选地0℃-40℃、甚至更优选地0℃-30℃并且最优选地2℃-20℃的范围内的温度。
322、然而,在本发明的一些实施方案中,步骤b)涉及条件ii)的使用,氧化乳清蛋白溶液具有在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内的温度。
323、本发明人已经看到在步骤b)期间缓慢升高温度允许乳清蛋白的游离硫醇基团的有效氧化的迹象。
324、在本发明的一些优选的实施方案中,步骤b)涉及在步骤b)期间将氧化乳清蛋白溶液的温度以至多2℃每分钟、更优选地至多1℃每分钟、甚至更优选地至多0.3℃每分钟并且最优选地至多0.1℃每分钟的加热速率升高到最大氧化温度。
325、当步骤b)的氧化乳清蛋白具有在6.5-7.5的范围内的ph时,在升高温度的情况下操作步骤b)是特别有用的。
326、温度可以连续地或分步升高。
327、根据分析b来测量ph。
328、本发明人还已经发现,即使在步骤b)期间快速升高温度可以是有利的,特别是如果ph在7.5-9.5并且更优选地7.7-8.5的范围内。
329、在本发明的这些优选的实施方案中,当步骤b)开始时,氧化乳清蛋白溶液的温度在0℃-65℃的范围内,并且在步骤b)期间,氧化乳清蛋白溶液的温度升高到在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内的温度。这种方法的益处在实施例16中示出。
330、在本发明的一些优选的实施方案中,对于上文提及的第一种方法特别有用的,步骤b)不涉及在步骤b)期间添加或产生另外的能够氧化半胱氨酸的硫醇基团的氧化剂。
331、这意味着在步骤a)中添加所有需要的氧化剂。
332、在本发明的其他优选的实施方案中,对于上文提及的第二种方法特别有用的,步骤b)涉及在步骤b)期间添加和/或产生另外的能够氧化半胱氨酸的硫醇基团的氧化剂。
333、在本发明的这样的优选的实施方案中,以下项之间的摩尔比为优选地至多5:1、更优选地至多2:1、甚至更优选地至多1:1并且最优选地至多1:2:
334、-在步骤b)期间存在于氧化乳清蛋白溶液中的能够氧化半胱氨酸的硫醇基团的氧化剂的最大量,和
335、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
336、优选地,并且特别是关于第二种方法,以下项之间的摩尔比为至多1:5、更优选地至多1:10、甚至更优选地至多1:20并且最优选地至多1:50:
337、-在步骤b)期间存在于氧化乳清蛋白溶液中的能够氧化半胱氨酸的硫醇基团的氧化剂的最大量,和
338、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
339、优选地,并且特别是关于第二种方法,以下项之间的摩尔比为1:1000-1:1、更优选地1:100-1:2、甚至更优选地1:70-1:5并且最优选地1:60-1:15:
340、-在步骤b)期间存在于氧化乳清蛋白溶液中的能够氧化半胱氨酸的硫醇基团的氧化剂的最大量,和
341、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
342、在本发明的一些优选的实施方案中,步骤b)的持续时间为至多48小时、更优选地至多36小时、甚至更优选地至多30小时并且最优选地至多25小时。
343、优选地,步骤b)的持续时间为0.1小时-48小时、更优选地3小时-36小时、甚至更优选地5小时-30小时并且最优选地10小时-25小时。
344、甚至更快的氧化步骤是可行的,并且在本发明的一些优选的实施方案中,步骤b)的持续时间为至多12小时、更优选地至多6小时、甚至更优选地至多3小时并且最优选地至多1小时。
345、优选地,步骤b)的持续时间为0.1小时-12小时、更优选地0.1小时-6小时、甚至更优选地0.1小时-3小时并且最优选地0.1小时-1小时。
346、游离硫醇的快速还原可以例如通过将该方法作为连续工艺实施和/或通过选择步骤a)和步骤b)的参数以接近最佳条件来完成。
347、本发明人已经发现,在大约半小时或更短的时间内进行步骤b)甚至是可行的。
348、在本发明的一些优选的实施方案中,步骤b)的持续时间为至多40分钟、更优选地至多30分钟、甚至更优选地至多20分钟并且最优选地至多10分钟。
349、甚至更快的氧化步骤是可行的,并且在本发明的一些优选的实施方案中,步骤b)的持续时间为至多10分钟、更优选地至多8分钟、甚至更优选地至多4分钟并且最优选地至多2分钟。
350、在本发明的一些优选的实施方案中,氧化乳清蛋白溶液在步骤b)期间具有不高于65℃、更优选地不高于60℃的温度。
351、然而,如上文提及的并如在实施例16中示出的,本发明人已经发现还可以使用更高的温度,特别是如果氧化的条件和氧化剂的剂量得到控制。
352、在本发明的一些优选的实施方案中,步骤b)涉及允许氧化进行,直到大体上所有能够氧化半胱氨酸的硫醇基团的氧化剂已经被消耗。
353、在本发明的其他优选的实施方案中,步骤b)涉及通过使步骤b)的氧化乳清蛋白溶液与组分(例如酶、催化剂或反应物)接触来停止氧化,所述组分消除残余的能够氧化半胱氨酸的硫醇基团的氧化剂。
354、合适的酶包括能够使过氧化物歧化的过氧化氢酶。
355、合适的反应物包括抗氧化剂。
356、在本发明的另外的实施方案中,步骤b)的氧化乳清蛋白溶液在步骤b)结束时仍然包含一些能够氧化半胱氨酸的硫醇基团的氧化剂。然而,通常优选的是,保持从步骤b)获得的氧化的乳清蛋白溶液的能够氧化半胱氨酸的硫醇基团的氧化剂的含量非常低。
357、优选地,以下项之间的摩尔比为至多1:50、更优选地至多1:100并且最优选地至多1:200:
358、-从步骤b)获得的氧化的乳清蛋白溶液的能够氧化半胱氨酸的硫醇基团的氧化剂的量,和
359、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
360、甚至更优选地,以下项之间的摩尔比为至多1:500、更优选地至多1:1000并且最优选地至多1:2000:
361、-从步骤b)获得的氧化的乳清蛋白溶液的能够氧化半胱氨酸的硫醇基团的氧化剂的量,和
362、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
363、最优选地,从步骤b)获得的氧化的乳清蛋白溶液不包含可检测水平的能够氧化半胱氨酸的硫醇基团的氧化剂。
364、如果能够氧化半胱氨酸的硫醇基团的氧化剂主要包含过氧化物,则优选的是在从步骤b)获得的氧化的乳清蛋白溶液中过氧化物的含量是低的。
365、优选地,以下项之间的摩尔比为至多1:50、更优选地至多1:100并且最优选地至多1:200:
366、-从步骤b)获得的氧化的乳清蛋白溶液的过氧化物的量,和
367、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
368、甚至更优选地,以下项之间的摩尔比为至多1:500、更优选地至多1:1000并且最优选地至多1:2000:
369、-从步骤b)获得的氧化的乳清蛋白溶液的过氧化物的量,和
370、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
371、最优选地,从步骤b)获得的氧化的乳清蛋白溶液不包含可检测水平的过氧化物。
372、如果能够氧化半胱氨酸的硫醇基团的氧化剂主要包含过氧化氢,则优选的是在从步骤b)获得的氧化的乳清蛋白溶液中过氧化氢的含量是低的。
373、优选地,以下项之间的摩尔比为至多1:50、更优选地至多1:100并且最优选地至多1:200:
374、-从步骤b)获得的氧化的乳清蛋白溶液的过氧化氢的量,和
375、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
376、甚至更优选地,以下项之间的摩尔比为至多1:500、更优选地至多1:1000并且最优选地至多1:2000:
377、-从步骤b)获得的氧化的乳清蛋白溶液的过氧化氢的量,和
378、-步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量。
379、最优选地,从步骤b)获得的氧化的乳清蛋白溶液不包含可检测水平的过氧化氢。
380、步骤b)优选地被实施为在促进有效氧化的一种或更多种条件下的单个孵育步骤,但是也可以被实施为在一种或更多种条件下的一系列孵育步骤,这些孵育步骤例如当例如添加的氧化剂已经被消耗时中断,并且当添加另外的氧化剂时再次开始。
381、步骤c)在本发明的一些实施方案不包括步骤c)的热处理的意义上是任选的。然而,步骤c)也是优选的,并且本发明的优选的方法通常包括步骤c)。
382、因此,通常优选的是,该方法还包括步骤c),步骤c)涉及使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,优选地随后冷却。例如,如果先前已经添加酶例如以产生氧化剂和/或消除残余的氧化剂,则步骤c)的热处理是优选的。
383、然后热处理可以起到使酶失活的目的。
384、可选择地或另外地,热处理可以引起残余的氧化剂被消耗。
385、此外,当已经进行步骤b)以仅获得游离硫醇基团的部分氧化时,步骤c)的热处理是优选的,这意味着步骤b)仅将氧化乳清蛋白溶液的游离硫醇基团的含量降低到步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量的20%-80%。
386、本发明人已经发现,部分氧化的乳清蛋白溶液的后续热处理导致游离硫醇基团的含量的进一步降低。因此,相对于游离硫醇基团的初始含量,部分氧化方法需要较少添加的氧化剂,并且因此降低了乳清蛋白的氧化损坏的风险。
387、步骤c)的热处理优选地涉及将从步骤b)获得的氧化的乳清蛋白溶液加热到60℃-160℃、更优选地65℃-95℃、甚至更优选地70℃-95℃并且最优选地80℃-90℃的温度,持续5秒-20分钟。
388、如果步骤b)的氧化通过添加酶诸如例如过氧化氢酶而终止,则热处理优选地进行持续足以使酶失活的持续时间,优选地使用在70℃-160℃并且最优选地80℃-150℃的范围内的温度进行持续足以使酶失活的持续时间。
389、本发明人已经发现,热灭菌可以用作步骤c),并且在本发明的一些优选的实施方案中,步骤c)涉及将步骤b)的氧化的乳清蛋白溶液加热到至少100℃的温度,持续足以获得无菌性的持续时间。优选地,该热处理涉及将步骤b)的氧化的乳清蛋白溶液加热到在140℃-160℃的范围内的温度,持续0.1秒-10秒的持续时间。
390、特别优选的是,当氧化的乳清蛋白溶液随后将被用作饮料本身时,步骤c)涉及热灭菌。在这样的实施方案中,优选地通过无菌填充(aseptic filing)将无菌氧化的乳清蛋白溶液填充到合适的容器中,以提供由无菌的氧化的乳清蛋白溶液组成的经包装的无菌饮料。
391、在本发明的其他实施方案中,步骤c)的热处理涉及将从步骤b)获得的氧化的乳清蛋白溶液加热到60℃-100℃的温度持续1秒-1小时,并且更优选地加热到65℃-95℃的温度持续2秒-50分钟,甚至更优选地加热到70℃-95℃的温度持续2秒-40分钟,并且最优选地加热到80℃-90℃的温度持续5秒-20分钟。
392、步骤d)在本发明的一些实施方案不包括干燥步骤的意义上是任选的。然而,优选的实施方案通常是这样。
393、因此,在本发明的一些优选的实施方案中,该方法还包括干燥液体进料的步骤d),该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
394、在本发明的上下文中,术语“衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质”意指液体进料的蛋白质是从步骤b)获得的氧化的乳清蛋白溶液的蛋白质,或者可选择地如果该方法包括步骤c),则是由步骤c)的热处理产生的蛋白质。
395、优选地,用于干燥的液体进料包含以下项或者甚至由以下项组成:
396、-从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物,或
397、-从步骤c)获得的经热处理的氧化的乳清蛋白溶液或其蛋白质浓缩物。
398、在本发明的上下文中,第一液体的“蛋白质浓缩物”是第二液体,其中至少蛋白质源自第一液体,但是该第二液体具有比第一液体高的相对于总固体的蛋白质含量。优选地,蛋白质浓缩物的大体上所有固体源自第一液体。第一液体的“蛋白质浓缩物”优选地通过超滤、纳滤、反渗透和/或蒸发制备。蛋白质浓缩超滤和/或纳滤可以例如与渗滤一起实施,以洗出一些小的非蛋白质固体。“蛋白质浓缩物”包含与第一液体相同的蛋白质物质,并且优选地具有与第一液体相同的乳清蛋白质物质相对于总蛋白质的重量百分比。蛋白质浓缩物的提供还可以涉及一个或更多个ph调节。
399、步骤d)的液体进料的制备还可以涉及ph调节,优选地以给予液体进料在6.0-8.0、更优选地6.5-7.7、甚至更优选地6.7-7.5并且最优选地6.8-7.3的范围内的ph。
400、因此,液体进料优选地具有在6.0-8.0、更优选地6.5-7.7、甚至更优选地6.7-7.5并且最优选地6.8-7.3的范围内的ph。
401、衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质优选地贡献液体进料的总蛋白质的至少50%w/w、更优选地至少70%w/w、甚至更优选地90%w/w并且最优选地至少99%w/w。
402、液体进料优选地是步骤b)的氧化的乳清蛋白溶液的蛋白质浓缩物或从步骤c)获得的经热处理的氧化的乳清蛋白溶液的蛋白质浓缩物。在已经生产液体进料之后,可以使液体进料直接经历干燥。可选择地,将液体进料保存在储存罐中直到干燥。
403、特别优选的是,衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质是液体进料的唯一蛋白质。
404、衍生自从步骤b)获得的氧化的乳清蛋白溶液的固体优选地贡献液体进料的固体的至少50%w/w、更优选地至少70%w/w、甚至更优选地90%w/w并且最优选地至少99%w/w。
405、特别优选的是,衍生自从步骤b)获得的氧化的乳清蛋白溶液的固体是液体进料的唯一蛋白质,可能除了在ph调节期间添加的矿物质。
406、用于干燥的液体进料优选地具有在8%w/w-22%w/w、更优选地10%w/w-18%w/w的范围内的蛋白质含量。
407、用于干燥的液体进料优选地具有在8%w/w-50%w/w、更优选地10%w/w-25%w/w的范围内的固体含量。
408、步骤d)的干燥优选地将液体进料转化为粉末。
409、步骤d)的干燥优选地涉及喷雾干燥。
410、此外,该方法通常包括包装从步骤d)获得的干燥的产品的步骤,所述干燥的产品通常是粉末。
411、通过该方法获得的氧化的乳清蛋白组合物是该方法的最终产物,并且优选地是从步骤b)获得的氧化的乳清蛋白溶液、从步骤c)获得的经热处理的氧化的乳清蛋白溶液或从步骤d)获得的氧化的乳清蛋白粉。
412、本发明的方法可以被实施为分批方法、半分批方法和连续方法。
413、在本发明的一些优选的实施方案中,该方法被实施为连续方法。特别优选的是,至少步骤a)和步骤b)或者步骤a)、步骤b)和步骤c)作为连续方法进行。
414、连续的实施方式对于本发明的实施方案通常是优选的,其中步骤b)的持续时间是相对短的,例如至多2小时、更优选地至多1小时、甚至更优选地至多30分钟、甚至更优选地至多20分钟并且最优选地至多10分钟。
415、在本发明的其他优选的实施方案中,该方法被实施为半分批方法。
416、该方法的特别优选的实施方案包括:
417、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
418、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
419、具有:
420、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
421、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
422、-相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
423、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
424、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
425、并且其中氧化乳清蛋白溶液还:
426、i)具有在20℃-65℃并且最优选地30℃-65℃的范围内的温度,
427、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
428、i)氧化乳清蛋白溶液具有在20℃-65℃并且最优选地30℃-60℃的范围内的温度,
429、其中步骤b)还涉及:
430、-将氧化乳清蛋白溶液的ph调节到在7.5-9.5、最优选地7.7-8.5的范围内,
431、-操作步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的30%-80%并且最优选地初始量的50%-75%,
432、-在步骤b)期间没有添加另外的氧化剂,
433、-通过添加过氧化氢酶终止步骤b)的氧化,
434、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到至少75℃的温度持续足以使过氧化氢酶失活的持续时间,最优选地加热到80℃-95℃的温度持续足以使过氧化氢酶失活的持续时间,
435、d)干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中:
436、-衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质优选地贡献液体进料的蛋白质的至少90%w/w并且最优选地至少99%w/w,
437、-液体进料具有在8%w/w-22%w/w、最优选地10%w/w-18%w/w的范围内的蛋白质含量,
438、-液体进料具有在6.7-7.5并且最优选地6.8-7.3的范围内的ph,
439、并且其中干燥涉及喷雾干燥。
440、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
441、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
442、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封被直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文所描述使它经历热灭菌。
443、该方法的另一种特别优选的实施方案包括:
444、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
445、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
446、具有:
447、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
448、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
449、-相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
450、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
451、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
452、并且其中氧化乳清蛋白溶液还:
453、i)具有在20℃-65℃并且最优选地30℃-65℃的范围内的温度,
454、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
455、i)氧化乳清蛋白溶液具有在20℃-65℃并且最优选地30℃-60℃的范围内的温度,
456、并且其中以下项之间的摩尔比为4:1-20:1并且最优选地5:1-15:1:
457、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
458、-步骤a)中游离硫醇基团的初始量,
459、其中步骤b)还涉及:
460、-将氧化乳清蛋白溶液的ph调节到在7.5-9.5、最优选地7.7-8.5的范围内,
461、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,
462、-在步骤b)期间没有添加另外的氧化剂,
463、-通过添加过氧化氢酶终止步骤b)的氧化,
464、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到至少75℃的温度持续足以使过氧化氢酶失活的持续时间,最优选地加热到80℃-95℃的温度持续足以使过氧化氢酶失活的持续时间,
465、d)干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中:
466、-衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质优选地贡献液体进料的蛋白质的至少90%w/w并且最优选地至少99%w/w,
467、-液体进料具有在8%w/w-22%w/w、最优选地10%w/w-18%w/w的范围内的蛋白质含量,
468、-液体进料具有在6.7-7.5并且最优选地6.8-7.3的范围内的ph,
469、并且其中干燥涉及喷雾干燥。
470、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
471、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
472、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
473、该方法的另外特别优选的实施方案包括:
474、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
475、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
476、具有:
477、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
478、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
479、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
480、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
481、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
482、并且其中氧化乳清蛋白溶液还:
483、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
484、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
485、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
486、并且其中以下项之间的摩尔比为1:1-10:1并且最优选地1:1-5:1:
487、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
488、-步骤a)中游离硫醇基团的初始量,
489、其中步骤b)还涉及:
490、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,
491、-通过添加过氧化氢酶来终止步骤b)的氧化,
492、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到至少75℃的温度持续足以使过氧化氢酶失活的持续时间,最优选地加热到80℃-95℃的温度持续足以使过氧化氢酶失活的持续时间,
493、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
494、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
495、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
496、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
497、该方法的另外特别优选的实施方案包括:
498、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
499、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
500、具有:
501、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
502、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
503、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
504、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
505、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
506、并且其中氧化乳清蛋白溶液还:
507、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
508、并且其中:
509、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为2:1-30:1并且最优选地4:1-15:1:
510、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
511、-游离硫醇基团的总量,
512、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
513、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
514、其中步骤b)还涉及:
515、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,以及
516、-通过添加过氧化氢酶来终止步骤b)的氧化,
517、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到至少75℃的温度持续足以使过氧化氢酶失活的持续时间,最优选地加热到80℃-95℃的温度持续足以使过氧化氢酶失活的持续时间,
518、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
519、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
520、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
521、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
522、该方法的又一种特别优选的实施方案包括:
523、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
524、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
525、具有:
526、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
527、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
528、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
529、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
530、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
531、并且其中氧化乳清蛋白溶液还:
532、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
533、并且其中:
534、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为2:1-30:1并且最优选地4:1-15:1:
535、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
536、-游离硫醇基团的总量,
537、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
538、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
539、其中步骤b)还涉及:
540、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,以及
541、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
542、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
543、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
544、代替干燥,从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
545、该方法的另一种特别优选的实施方案包括:
546、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
547、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
548、具有:
549、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
550、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
551、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
552、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
553、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
554、并且其中:
555、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1-8:1并且最优选地1:1-3:1:
556、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
557、-游离硫醇基团的总量,
558、-氧化乳清蛋白溶液还:
559、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
560、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
561、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
562、其中步骤b)还涉及:
563、-操作步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的30%-80%并且最优选地初始量的50%-75%,
564、-任选地,通过添加过氧化氢酶来终止步骤b)的氧化,
565、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到70℃-95℃的温度持续2秒-40分钟,
566、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
567、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
568、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
569、代替干燥,从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
570、该方法的又特别优选的实施方案包括:
571、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
572、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
573、具有:
574、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
575、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
576、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
577、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
578、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
579、并且其中:
580、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1.5-8:1并且最优选地1:1.5-3:1:
581、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
582、-游离硫醇基团的总量,
583、-氧化乳清蛋白溶液还:
584、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
585、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
586、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
587、其中步骤b)还涉及:
588、-操作步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的30%-80%并且最优选地初始量的50%-75%,
589、-任选地,通过添加过氧化氢酶来终止步骤b)的氧化,
590、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到70℃-95℃的温度持续2秒-40分钟,
591、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
592、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
593、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
594、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
595、该方法的又一种特别优选的实施方案包括:
596、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
597、-能够氧化半胱氨酸的硫醇基团的氧化剂,其包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
598、具有:
599、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
600、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
601、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
602、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
603、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
604、并且其中:
605、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1-8:1并且最优选地1:1-3:1:
606、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
607、-游离硫醇基团的总量,
608、-氧化乳清蛋白溶液还:
609、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
610、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
611、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
612、其中步骤b)还涉及:
613、-操作步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的30%-80%并且最优选地初始量的50%-75%,
614、-任选地,通过添加过氧化氢酶来终止步骤b)的氧化,
615、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到70℃-95℃的温度持续足以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质的持续时间,
616、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
617、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
618、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
619、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
620、该方法的另外特别优选的实施方案包括:
621、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
622、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
623、具有:
624、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
625、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
626、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
627、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
628、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
629、并且其中:
630、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1.5-8:1并且最优选地1:1.5-3:1:
631、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
632、-游离硫醇基团的总量,
633、-氧化乳清蛋白溶液还:
634、i)具有在0℃-65℃、最优选地30℃-65℃的范围内的温度,
635、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
636、i)氧化乳清蛋白溶液具有在20℃-65℃、最优选地30℃-65℃的范围内的温度,
637、其中步骤b)还涉及:
638、-操作步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的30%-80%并且最优选地初始量的50%-75%,
639、-任选地,通过添加过氧化氢酶来终止步骤b)的氧化,
640、c)使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤,该热处理步骤涉及加热到70℃-95℃的温度持续足以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质的持续时间,
641、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
642、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
643、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
644、代替干燥,从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤c)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
645、该方法的另外特别优选的实施方案包括:
646、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
647、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
648、具有:
649、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
650、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
651、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
652、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
653、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
654、并且其中:
655、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1-8:1并且最优选地1:1-3:1:
656、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
657、-游离硫醇基团的总量,
658、-氧化乳清蛋白溶液还:
659、i)具有在0℃-160℃、最优选地0℃-65℃的范围内的温度,
660、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
661、i)氧化乳清蛋白溶液具有在70℃-160℃、最优选地75℃-100℃的范围内的温度,
662、其中步骤b)还涉及:
663、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,
664、-优选地,其中步骤b)的持续时间为至多1小时并且最优选地至多10分钟,
665、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
666、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
667、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
668、代替干燥,从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
669、该方法的另一种特别优选的实施方案包括:
670、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
671、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
672、具有:
673、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
674、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
675、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
676、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
677、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
678、并且其中:
679、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1.5-8:1并且最优选地1:1.5-3:1:
680、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
681、-游离硫醇基团的总量,
682、-氧化乳清蛋白溶液还:
683、i)具有在0℃-160℃、最优选地0℃-65℃的范围内的温度,
684、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
685、i)氧化乳清蛋白溶液具有在70℃-160℃、最优选地75℃-100℃的范围内的温度,
686、其中步骤b)还涉及:
687、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,
688、-优选地,其中步骤b)的持续时间为至多1小时并且最优选地至多10分钟,
689、d)优选地,干燥液体进料,该液体进料至少包含衍生自步骤b)的氧化的乳清蛋白溶液的蛋白质,并且其中干燥涉及喷雾干燥。
690、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
691、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
692、代替干燥,从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物可以通过无菌填充和密封直接填充到容器、优选地无菌容器中。可选择地,如果从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物尚未灭菌,则可以如本文描述使它经历热灭菌。
693、该方法的甚至另外特别优选的实施方案包括:
694、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
695、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
696、具有:
697、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
698、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
699、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
700、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
701、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
702、并且其中:
703、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1-8:1并且最优选地1:1-3:1:
704、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
705、-游离硫醇基团的总量,
706、-氧化乳清蛋白溶液还:
707、i)具有在0℃-160℃、最优选地0℃-65℃的范围内的温度,
708、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
709、i)氧化乳清蛋白溶液具有在100℃-160℃、最优选地130℃-150℃的范围内的温度,
710、优选地持续足以提供无菌氧化的乳清蛋白溶液的持续时间,
711、其中步骤b)还涉及:
712、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,
713、-优选地,其中步骤b)的持续时间为至多1小时并且最优选地至多10分钟,
714、并且其中从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物通过无菌填充和密封被填充到容器、优选地无菌容器中,以提供无菌的包装的液体氧化的乳清蛋白溶液。
715、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
716、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
717、该方法的又特别优选的实施方案包括:
718、a)加工乳清蛋白源(其是wpi),以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
719、-能够氧化半胱氨酸的硫醇基团的氧化剂,所述氧化剂包含相对于能够氧化半胱氨酸的硫醇基团的氧化剂的总量的至少90%mol/mol的量的过氧化物、最优选地过氧化氢,并且
720、具有:
721、-在7.5-9.5、最优选地7.7-8.5的范围内的ph,
722、-相对于氧化乳清蛋白溶液的重量的2%w/w-9%w/w、最优选地3%w/w-8%w/w的总蛋白质含量,
723、-相对于总蛋白质的至少40%w/w、最优选地相对于总蛋白质的至少50%w/w的β-乳球蛋白(blg)含量,
724、-相对于总固体的至少86%w/w、最优选地至少90%w/w的蛋白质含量,
725、-相对于总固体的至多1%w/w、最优选地至多0.2%w/w的总脂肪含量,
726、并且其中:
727、-步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:1.5-10:1、甚至更优选地1:1.5-8:1并且最优选地1:1.5-3:1:
728、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
729、-游离硫醇基团的总量,
730、-氧化乳清蛋白溶液还:
731、i)具有在0℃-160℃、最优选地0℃-65℃的范围内的温度,
732、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,所述一种或更多种条件涉及:
733、i)氧化乳清蛋白溶液具有在100℃-160℃、最优选地130℃-150℃的范围内的温度,优选地持续足以提供无菌氧化的乳清蛋白溶液的持续时间,
734、其中步骤b)还涉及:
735、-操作步骤b)以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多10μmol/g蛋白质并且最优选地至多5μmol/g蛋白质,
736、-优选地,其中步骤b)的持续时间为至多1小时并且最优选地至多10分钟,
737、并且其中从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物通过无菌填充和密封被填充到容器、优选地无菌容器中,以提供无菌的包装的液体氧化的乳清蛋白溶液。
738、上文提及的特别优选的实施方案中的氧化乳清蛋白溶液的压力通常为0.5巴-99巴并且最优选地1巴-30巴。
739、本发明的氧化的乳清蛋白组合物优选地通过上文提及的特别优选的实施方案可获得。
740、本发明的又一个方面涉及一种氧化的乳清蛋白组合物,该氧化的乳清蛋白组合物具有:
741、-相对于总固体的至少30%w/w的蛋白质含量,
742、-优选地,相对于总固体的至多3%w/w的脂肪含量,
743、-至多15μmol游离硫醇基团/g蛋白质,
744、-优选地,相对于总蛋白质的至少0.7%w/w的色氨酸含量,
745、-优选地,相对于总蛋白质的至少0.3%w/w的甲硫氨酸含量,
746、-优选地,至多0.2微克/mg蛋白质的犬尿氨酸含量,
747、-优选地,在100-600μmol/g蛋白质的范围内的蛋白质结合的硫的含量,
748、-优选地,在150-400μmol/g蛋白质的范围内的形成二硫键的蛋白质结合的半胱氨酸残基的含量。
749、-优选地,在18kda和10000kda之间、更优选地50kda-8000kda之间并且最优选地80kda-5000kda之间的范围内的蛋白质的重均分子量,和
750、-优选地,至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在18kda和10000kda之间的分子量。
751、氧化的乳清蛋白组合物通常具有在5.5-9.5的范围内的ph。
752、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有在5.5-9.5、更优选地6.0-8.5、甚至更优选地6.2-8.0并且最优选地6.5-7.5的范围内的ph。
753、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有相对于氧化的乳清蛋白组合物的总固体的至少30%w/w、更优选地相对于氧化的乳清蛋白组合物的总固体的至少50%w/w、甚至更优选地相对于氧化的乳清蛋白组合物的总固体的至少75%w/w并且最优选地相对于氧化的乳清蛋白组合物的总固体的至少85%w/w的总蛋白质含量。
754、优选地,氧化的乳清蛋白组合物具有在相对于氧化的乳清蛋白组合物的总固体的30%w/w-99%w/w、更优选地相对于氧化的乳清蛋白组合物的总固体的50%w/w-97%w/w、甚至更优选地相对于氧化的乳清蛋白组合物的总固体的75%w/w-96%w/w并且最优选地相对于氧化的乳清蛋白组合物的总固体的至少85%w/w-95%w/w的范围内的总蛋白质含量。
755、优选地,氧化的乳清蛋白组合物具有相对于总固体的至多3%w/w的总脂肪含量。
756、甚至更低水平的脂肪通常是优选的,并且通常优选的是,氧化的乳清蛋白组合物具有相对于总固体的至多1%w/w、更优选地相对于总固体的至多0.5%w/w、甚至更优选地相对于总固体的至多0.2%w/w并且最优选地相对于总固体的至多0.1%w/w的总脂肪含量。
757、氧化的乳清蛋白组合物可以包含不同量的碳水化合物。
758、然而,通常优选的是,氧化的乳清蛋白组合物具有相对于总固体的至多65%w/w的碳水化合物含量。
759、甚至更低水平的碳水化合物通常是优选的,并且通常优选的是,氧化的乳清蛋白组合物具有相对于总固体的至多20%w/w、更优选地相对于总固体的至多8%w/w、甚至更优选地相对于总固体的至多2%w/w并且最优选地相对于总固体的至多0.2%w/w的碳水化合物含量。
760、氧化的乳清蛋白组合物优选地具有相对于总固体的至多8%w/w、更优选地至多6%w/w、甚至更优选地至多5%并且最优选地至多4.0%的灰分含量。
761、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有相对于总固体的0.4%w/w-8%w/w、更优选地相对于总固体的0.5%w/w-6%w/w、甚至更优选地相对于总固体的0.5%w/w-5%w/w并且最优选地相对于总固体的0.6%w/w-4.0%w/w的灰分含量。
762、氧化的乳清蛋白组合物优选地具有相对于总固体的至多1%w/w、更优选地至多0.7%w/w、甚至更优选地至多0.5%并且最优选地至多0.2%的镁和钙的组合含量。
763、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有相对于总固体的0.01%w/w-1%w/w、更优选地相对于总固体的至多0.001%w/w-0.7%w/w、甚至更优选地相对于总固体的0.01%w/w-0.5%w/w并且最优选地相对于总固体的0.01%w/w-0.2%w/w的镁和钙的组合含量。
764、本发明人已经看到以下迹象:在包含3%乳清蛋白的热处理的乳清蛋白饮料中,包含甚至高达15μmol游离硫醇基团/g蛋白质的氧化的乳清蛋白组合物相对于未氧化的乳清蛋白可以提供降低水平的令人不愉快的气味。
765、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物包含至多15μmol/g蛋白质、更优选地至多14μmol/g蛋白质、甚至更优选地至多13μmol/g蛋白质并且最优选地至多12μmol/g蛋白质的量的游离硫醇基团。
766、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物包含0.001-15μmol/g蛋白质、更优选地0.01-14μmol/g蛋白质、甚至更优选地0.01-13μmol/g蛋白质并且最优选地0.01-12μmol/g蛋白质的量的游离硫醇基团。
767、然而,通常优选的是,特别是当氧化的乳清蛋白组合物待用于热处理的高蛋白质饮料,例如包含6%或更高的乳清蛋白的热处理的高蛋白质饮料时,氧化的乳清蛋白组合物包含较低水平的游离硫醇基团。因此,在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物包含至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质的量的游离硫醇基团。
768、优选地,氧化的乳清蛋白组合物包含0.01-10μmol/g蛋白质、更优选地0.01-8μmol/g蛋白质、更优选地0.01-5μmol/g蛋白质、甚至更优选地0.01-3μmol/g蛋白质并且最优选地0.01-2μmol/g蛋白质的量的游离硫醇基团。
769、甚至更低水平的游离硫醇基团可以是期望的,并且在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物包含至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质的量的游离硫醇基团。
770、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有相对于总蛋白质的至少0.7%w/w、更优选地相对于总蛋白质的至少0.8%w/w、甚至更优选地相对于总蛋白质的至少0.9%w/w并且最优选地相对于总蛋白质的至少1.0%w/w的色氨酸含量。
771、优选地,氧化的乳清蛋白组合物具有相对于总蛋白质的0.7%w/w-3%w/w、更优选地相对于总蛋白质的0.8%w/w-2.6%w/w、甚至更优选地相对于总蛋白质的0.9%w/w-2.4%w/w并且最优选地相对于总蛋白质的1.0%w/w-2.2%w/w的色氨酸含量。
772、可选择地,但也是优选的,氧化的乳清蛋白组合物通常具有相对于总蛋白质的0.7%w/w-3%w/w、更优选地相对于总蛋白质的0.8%w/w-3%w/w、甚至更优选地相对于总蛋白质的0.9%w/w-3%w/w并且最优选地相对于总蛋白质的1.0%w/w-3%w/w的色氨酸含量。
773、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有相对于总蛋白质的至少0.3%w/w、更优选地相对于总蛋白质的至少0.4%w/w、甚至更优选地相对于总蛋白质的至少0.5%w/w并且最优选地相对于总蛋白质的至少0.6%w/w的甲硫氨酸含量。
774、优选地,氧化的乳清蛋白组合物具有相对于总蛋白质的0.3%w/w-3.3%w/w、更优选地相对于总蛋白质的0.4%w/w-3.2%w/w、甚至更优选地相对于总蛋白质的0.5%w/w-3.2%w/w并且最优选地相对于总蛋白质的0.6%w/w-3.2%w/w的甲硫氨酸含量。
775、甲硫氨酸的增加的下限通常是优选的,并且在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有相对于总蛋白质的1.0%w/w-3.3%w/w、更优选地相对于总蛋白质的1.3%w/w-3.2%w/w、甚至更优选地相对于总蛋白质的1.6%w/w-3.2%w/w并且最优选地相对于总蛋白质的1.8%w/w-3.2%w/w的甲硫氨酸含量。
776、优选地,氧化的乳清蛋白组合物具有至多0.2微克/mg蛋白质、更优选地至多0.05微克/mg蛋白质、甚至更优选地至多0.01微克/mg蛋白质并且最优选地至多0.001微克/mg蛋白质的犬尿氨酸含量。特别优选的是,氧化的乳清蛋白组合物不包含可检测的犬尿氨酸。
777、根据poojary等人;“selective and sensitive uhplc-esi-orbitrap ms methodto quantify protein oxidation markers”;talanta,第234卷,2021年11月1日(2021年7月可在线获取)来定量犬尿氨酸的含量。
778、犬尿氨酸是色氨酸氧化的有用标志物,本发明人认为犬尿氨酸是基于在已经经历过度氧化的蛋白质的热灭菌的乳清蛋白饮料中产生黄色的部分原因,并且此外,从健康角度来看,犬尿氨酸是不期望的。
779、优选地,氧化的乳清蛋白组合物具有在100-600μmol/g蛋白质的范围内、更优选地在200-500μmol/g蛋白质的范围内并且最优选地在250-500μmol/g蛋白质的范围内的蛋白质结合的硫的含量。
780、优选地,氧化的乳清蛋白组合物具有在150-400μmol/g蛋白质、更优选地160-350μmol/g蛋白质并且最优选地170-300μmol/g蛋白质的范围内的形成二硫键的蛋白质结合的半胱氨酸残基的含量。
781、本发明人已经发现,有利的是氧化的乳清蛋白组合物的蛋白质的粒度不大于10000kda,并且优选地更小,以避免在透明饮料应用中产生不透明,并且进一步避免在氧化的乳清蛋白的浓缩和干燥期间增加的粘度。
782、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物具有在18kda和10000kda之间、更优选地30-9000kda、甚至更优选地50-8000kda并且最优选地80-5000kda的范围内的蛋白质的重均分子量。
783、优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在18kda和10000kda之间的分子量。
784、更优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在50kda和8000kda之间的分子量。
785、甚至更优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在80kda和5000kda之间的分子量。
786、在本发明的其他优选的实施方案中,氧化的乳清蛋白组合物具有在18kda和200kda之间、更优选地30kda-150kda之间并且最优选地30kda-100kda之间的范围内的蛋白质重均分子量。
787、本发明人已经发现,蛋白质的重均分子量越小,在喷雾干燥之前例如通过超滤或纳滤的浓缩期间,越高的总蛋白质浓度是可行的。
788、优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在18kda和200kda之间的分子量。
789、更优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在18kda和150kda之间的分子量。
790、甚至更优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在18kda和100kda之间的分子量。
791、本发明人已经看到以下迹象:氧化的乳清蛋白组合物的重要蛋白质具有至少30kda的分子量可能是有益的,这可能是由于氧化的blg的二聚作用。
792、因此,优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在30kda和200kda之间的分子量。
793、更优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在30kda和150kda之间的分子量。
794、甚至更优选地,氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在30kda和100kda之间的分子量。
795、氧化的乳清蛋白组合物优选地通过涉及乳清蛋白源、优选地乳清蛋白源的水溶液的氧化的方法来制备。本文已经描述了乳清蛋白源的优选的实施方案。作为乳清蛋白分离物的乳清蛋白源是特别优选的。
796、在本发明的一些优选的实施方案中,本发明的氧化的乳清蛋白组合物通过本文描述的方法可获得。
797、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物呈液体的形式,并且优选地呈水性液体的形式。呈液体形式的氧化的乳清蛋白组合物优选地具有至多0.1%w/w-50%w/w、更优选地1%w/w-35%w/w、甚至更优选地5%w/w-30%w/w并且最优选地10%w/w-30%w/w的固体含量。
798、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物呈固体的形式,并且优选地呈粉末的形式,该粉末优选地已经通过喷雾干燥制备。呈粉末形式的氧化的乳清蛋白组合物优选地具有至少90%w/w、更优选地至少93%w/w、甚至更优选地至少94%w/w并且最优选地至少95%w/w的固体含量。
799、氧化的乳清蛋白组合物和氧化乳清蛋白溶液中对固体含量没有贡献的部分优选地是水。
800、氧化的乳清蛋白组合物中对固体含量没有贡献的部分优选地包含至少80%w/w、更优选地至少90%w/w、甚至更优选地95%w/w并且更优选地至少99%w/w的量的水。
801、在本发明的特别优选的实施方案中,氧化的乳清蛋白组合物具有:
802、-相对于总固体的至少86%w/w并且最优选地相对于总固体的至少90%的蛋白质含量,
803、-相对于总固体的至多1%w/w并且最优选地至多0.2%w/w的脂肪含量,
804、-至多10μmol游离硫醇基团/g蛋白质并且最优选地至多5μmol游离硫醇基团/g蛋白质,
805、-相对于总蛋白质的0.7%w/w-3%w/w并且最优选地相对于总蛋白质的1.0%w/w-3%w/w的色氨酸含量,
806、-相对于总蛋白质的0.3%w/w-3.3%w/w并且最优选地相对于总蛋白质的1.3%w/w-3.2%w/w的甲硫氨酸含量,
807、-至多0.2微克/mg蛋白质并且最优选地至多0.01微克/mg蛋白质的犬尿氨酸含量。
808、在本发明的上文提及的特别优选的实施方案中,氧化的乳清蛋白组合物优选地具有:
809、-在100-600μmol/g蛋白质的范围内的蛋白质结合的硫的含量,以及
810、-在150-400μmol/g蛋白质的范围内的形成二硫键的蛋白质结合的半胱氨酸残基的含量。
811、另外,在本发明的上文提及的特别优选的实施方案中,氧化的乳清蛋白组合物优选地具有:
812、-在100-600μmol/g蛋白质的范围内的蛋白质结合的硫的含量,以及
813、-在150-400μmol/g蛋白质的范围内的形成二硫键的蛋白质结合的半胱氨酸残基的含量。
814、此外,通常优选的是,上文提及的特别优选的实施方案的氧化的乳清蛋白组合物的至少60%w/w、更优选地至少80%w/w、甚至更优选地至少90%w/w并且最优选地至少99%w/w的蛋白质具有在30kda和9000kda之间的分子量。
815、氧化的乳清蛋白组合物的上文提及的特别优选的实施方案的ph优选地在6.2-8.0并且最优选地6.5-7.5的范围内。
816、在本发明的一些优选的实施方案中,氧化的乳清蛋白组合物是无菌的氧化的乳清蛋白组合物,并且优选地经包装的无菌氧化的乳清蛋白组合物。优选地呈无菌的液体的氧化的乳清蛋白组合物或无菌的粉末状的氧化的乳清蛋白组合物的形式。
817、本发明的又一个方面涉及一种生产食品产品的工艺,该工艺包括:
818、-加工本文描述的氧化的乳清蛋白组合物,和/或
819、-将所描述的氧化的乳清蛋白组合物和/或经加工的氧化的乳清蛋白组合物与一种或更多种另外的成分组合,并且任选地加工所述组合。
820、食品产品的优选的实例是具有5.5-8.5的ph的热处理的并且优选地热灭菌的饮料。
821、因此,本发明的更具体的方面涉及生产具有5.5-8.5、更优选地6.5-7.5的ph的热处理的并且优选地热灭菌的饮料的工艺,该工艺包括:
822、1)将如本文描述的氧化的乳清蛋白组合物与一种或更多种另外的成分组合,以获得液体混合物,该液体混合物具有5.5-8.5、更优选地6.5-7.5的ph,并且包含:
823、-足以贡献至少0.5%w/w蛋白质的量的氧化的乳清蛋白组合物,和
824、-水,
825、2)将液体混合物包装在容器、优选地无菌容器中,并且
826、其中液体混合物在包装之前和/或之后被热处理,并且优选地被热灭菌。
827、如本文描述的氧化的乳清蛋白组合物优选地是食品产品或热灭菌的饮料的唯一蛋白质来源,并且因此也是液体混合物的唯一蛋白质来源。
828、本发明人已经发现,有利的是,液体混合物的游离硫醇基团的含量在热处理之前保持为低,以防止形成类似于臭鸡蛋气味的令人不愉快的气味。
829、因此,在本发明的一些优选的实施方案中,在热灭菌之前,液体混合物包含至多60μmol游离硫醇基团/100g液体混合物、更优选地至多40μmol游离硫醇基团/100g液体混合物、甚至更优选地至多30μmol游离硫醇基团/100g液体混合物并且最优选地至多30μmol游离硫醇基团/100g液体混合物。
830、通常需要甚至更低含量的游离硫醇基团,并且在本发明的一些优选的实施方案中,在热灭菌之前,液体混合物包含至多20μmol游离硫醇基团/100g液体混合物、更优选地至多15μmol游离硫醇基团/100g液体混合物、甚至更优选地至多10μmol游离硫醇基团/100g液体混合物并且最优选地至多5μmol游离硫醇基团/100g液体混合物。
831、液体混合物优选地包含在相对于液体混合物的重量的0.5%w/w-15%w/w、更优选地相对于液体混合物的重量的1%w/w-10%w/w、甚至更优选地相对于液体混合物的重量的2%w/w-9%w/w并且最优选地相对于液体混合物的重量的3%w/w-8%w/w的范围内的蛋白质总量。
832、可选择地,但还是优选的,液体混合物可以包含在相对于液体混合物的重量的4%w/w-15%w/w、更优选地相对于液体混合物的重量的5%w/w-14%w/w、甚至更优选地相对于液体混合物的重量的6%w/w-13%w/w并且最优选地相对于液体混合物的重量的8%w/w-12%w/w的范围内的蛋白质总量。
833、本发明的氧化的乳清蛋白组合物优选地贡献液体混合物的总蛋白质的至少30%w/w、更优选地总蛋白质的至少50%w/w、甚至更优选地总蛋白质的至少70%w/w并且最优选地总蛋白质的至少80%w/w。
834、甚至更高的贡献通常是优选的,并且在本发明的一些优选的实施方案中,本发明的氧化的乳清蛋白组合物贡献液体混合物的总蛋白质的至少90%w/w、更优选地总蛋白质的至少95%w/w、甚至更优选地总蛋白质的至少99%w/w并且最优选地总蛋白质的100%w/w。
835、如果氧化的乳清蛋白组合物与其他蛋白质来源组合使用,则优选的是,使用具有相对低含量的硫醇基团的来源。
836、在本发明的一些优选的实施方案中,液体混合物包含相对于总固体的至少15%w/w、更优选地相对于总固体的至少20%w/w、并且最优选地相对于总固体的至少25%w/w并且最优选地相对于总固体的至少30%w/w的量的总蛋白质。
837、例如当饮料意图作为运动蛋白质饮料时,总蛋白质可以贡献总固体的甚至更大的部分。因此,在本发明的一些优选的实施方案中,液体混合物包含相对于总固体的至少80%w/w、更优选地相对于总固体的至少90%w/w、甚至更优选地相对于总固体的至少92%w/w并且最优选地相对于总固体的至少94%w/w的量的总蛋白质。
838、液体混合物通常具有0.5%w/w-50%w/w、更优选地1%w/w-35%w/w、甚至更优选地2%w/w-20%w/w并且最优选地3%w/w-10%w/w的固体含量。
839、液体混合物的不由固体组成的部分优选地包含水。液体混合物的不由固体组成的部分优选地包含至少80%w/w、更优选地至少90%w/w、甚至更优选地95%w/w并且更优选地至少99%w/w的量的水。
840、在本发明的一些优选的实施方案中,液体混合物具有至多100千卡/100g、更优选地至多80千卡/100g、甚至更优选地至多70千卡/100g并且最优选地至多60千卡/100g的卡路里含量。优选地,液体混合物可以具有2-100千卡/100g、更优选地4-80千卡/100g、甚至更优选地8-70千卡/100g并且最优选地12-60千卡/100g的卡路里含量。例如对于其中蛋白质来源是主要能量来源的运动应用,这些实施方案是优选的。
841、在本发明的其他优选的实施方案中,液体混合物具有大于100千卡/100g、更优选地至少120千卡/100g、甚至更优选地至少140千卡/100g并且最优选地至少150千卡/100g的卡路里含量。优选地,液体混合物可以具有101-300千卡/100g、更优选地120-280千卡/100g、甚至更优选地140-270千卡/100g并且最优选地150-260千卡/100g的卡路里含量。例如对于其中蛋白质来源伴随大量碳水化合物和脂肪的临床营养,这些实施方案是优选的。
842、在热处理的饮料的上下文中描述的组成特征和偏好同样适用于液体混合物。
843、液体混合物的ph可以从微酸性跨越到微碱性。
844、接近ph中性的液体混合物对于生产接近ph中性的饮料是特别优选的。在本发明的一些优选的实施方案中,液体混合物具有在5.5-8.0、更优选地6.0-7.5、甚至更优选地6.2-7.3并且最优选地6.3-7.2的范围内的ph。
845、在本发明的其他优选的实施方案中,液体混合物具有在6.0-7.5、更优选地6.2-7.5并且最优选地6.3-7.5的范围内的ph。
846、在本发明的另外优选的实施方案中,液体混合物具有在6.0-8.0、更优选地6.6-7.7、甚至更优选地6.7-7.6并且最优选地6.8-7.5的范围内的ph。
847、通常,可以使用任何合适的食品酸(food acid)或食品碱(food base)来调节液体混合物的ph。本领域技术人员将认识到用于调节ph的合适手段。合适的食品碱包括碳酸钠或碳酸钾、碳酸氢钠或碳酸氢钾、或氢氧化铵。可选择地,可以采用koh或naoh来调节ph。合适的食品酸包括例如柠檬酸、盐酸、苹果酸或酒石酸或磷酸。
848、在本发明的一些优选的实施方案中,液体混合物具有在20℃和在300s-1的剪切速率至多200cp、更优选地在20℃和在300s-1的剪切速率至多100cp、甚至更优选地在20℃和300s-1的剪切速率至多50cp并且最优选地在20℃和300s-1的剪切速率至多20cp的粘度。
849、液体混合物通常通过将适当的成分与氧化的乳清蛋白组合物混合来制备。如果使用粉末成分,则通常优选的是,在热处理之前允许这些成分水合,并且类似地,如果可以是优选的,则在热处理之前使液体混合物均质化。
850、在一些优选的实施方案中,氧化的乳清蛋白组合物以粉末的形式提供,并且优选地是混合的水或水性液体,并且允许在热处理之前水合。
851、在其他优选的实施方案中,氧化的乳清蛋白组合物以液体的形式提供,例如从步骤b)或从步骤c)获得的氧化的乳清蛋白溶液。在一些优选的实施方案中,氧化的乳清蛋白组合物是从步骤b)获得的氧化的乳清蛋白溶液,并且包含过氧化氢酶,该过氧化氢酶已经被用于消除残余的过氧化物氧化剂。从步骤b)获得的氧化的乳清蛋白溶液不经历步骤c),而是:
852、-与生产饮料所需的一种或更多种另外的成分混合,
853、-任选地经历均质化,
854、-通过将其加热到在140℃-150℃的范围内的温度持续1秒-10秒经历热灭菌,
855、-冷却热灭菌的饮料,以及
856、-将无菌的饮料无菌地填充到合适的无菌容器中,随后将其密封。
857、本发明人已经发现,在这样的饮料工艺中的热灭菌可以代替本文提及的方法的步骤c),并且既使过氧化氢酶失活又有助于游离硫醇基团的含量的额外降低。
858、步骤2)的包装可以是任何合适的包装技术,并且可以使用任何合适的容器来包装液体混合物。
859、然而,在本发明的优选的实施方案中,步骤2)的包装是无菌包装,即液体混合物在无菌条件下包装。例如,无菌包装可以通过使用无菌填充系统来进行,并且优选地涉及将液体混合物填充到一个或更多个无菌容器中。
860、如果液体混合物在填充之前已经是无菌的或在微生物中是非常低的,则无菌填充和密封是特别优选的。
861、有用的容器的实例是瓶子、硬纸盒(carton)、砖状物(brick)和/或袋子。
862、该工艺的热处理优选地使液体混合物经历至少70℃的温度。
863、在本发明的工艺的一些优选的实施方案中,使步骤1)的液体混合物经历至少包括巴氏灭菌的热处理,并且然后在步骤2)中包装。
864、在本发明的工艺的另一种实施方案中,使步骤2)的包装的液体混合物经历至少包括巴氏灭菌的热处理。
865、在一些优选的实施方案中,热处理涉及将液体混合物加热到在70℃-80℃的范围内的温度。
866、在本发明的一些优选的实施方案中,热处理的温度在70℃-80℃的范围内、优选地在70℃-79℃的范围内、更优选地在71℃-78℃的范围内、甚至更优选地在72℃-77℃的范围内并且最优选地在73℃-76℃的范围内,诸如大约75℃。
867、优选地,当在70℃-80℃的温度范围内进行时,热处理的持续时间为持续1秒至60分钟。最高暴露时间最适合于温度范围的最低温度,并且反之亦然。
868、在其他优选的实施方案中,热处理的温度处于70℃持续至少60分钟,或优选地处于75℃持续至少45分钟,或优选地处于80℃持续至少30分钟,或优选地处于85℃持续至少22分钟,或优选地处于90℃持续至少10分钟。
869、在本发明的特别优选的实施方案中,热处理提供70℃-78℃持续1秒至30分钟、更优选地71℃-77℃持续1分钟至25分钟并且甚至更优选地72℃-76℃持续2分钟至20分钟。
870、在本发明的一些优选的实施方案中,热处理的工艺涉及加热到85℃-95℃的温度持续1分钟至30分钟。
871、例如,热处理的温度可以是至少81℃、优选地至少91℃、优选地至少95℃、更优选地至少100℃、甚至更优选地至少120℃并且最优选地至少140℃。
872、在本发明的一些特别优选的实施方案中,热处理涉及将液体混合物加热到在100℃-160℃的范围内的温度,持续足以对液体混合物进行灭菌的持续时间。这优选地涉及将液体混合物加热到在120℃至155℃的范围内的温度,持续足以获得无菌性的持续时间,通常为0.1秒至10分钟,并且更优选地加热到在140℃至155℃的范围内的温度,持续足以获得无菌性的持续时间,通常持续0.1秒至30秒。使液体无菌的液体的热处理也被称为热灭菌。
873、另一种优选的热处理是灭菌uht型处理,其通常涉及在135℃-146℃的范围内的温度和持续足以获得无菌性的持续时间,通常为在1秒-10秒的范围内的持续时间。
874、可选择地,但还是优选的,热处理可以涉及在145℃-180℃的范围内的温度和持续足以获得无菌性的持续时间,通常为在0.01秒-2秒的范围内的持续时间,并且更优选地在150-180℃的范围内的温度和在0.01秒-0.3秒的范围内的持续时间。
875、热处理的实施可以涉及使用设备,诸如板式热交换器或管式热交换器、刮面式热交换器或干馏系统。可选择地,并且对于高于95℃的热处理特别优选的,可以采用基于蒸汽的直接加热,例如使用直接蒸汽注射、直接蒸汽输注或喷雾烹饪。另外,这样的基于蒸汽的直接加热优选地与闪蒸冷却(flash cooling)结合使用。实施喷雾烹饪的合适的实例在出于所有目的并入本文的wo2009113858a1中找到。实施直接蒸汽注射和直接蒸汽输注的合适的实例在出于所有目的并入本文的wo2009113858a1和wo2010/085957a3中找到。高温处理的一般方面例如在出于所有目的通过引用并入本文的"thermal technologies in foodprocessing"isbn 185573558 x中找到。
876、在本发明的一些优选的实施方案中,热处理涉及以下或者甚至由以下组成:干馏热处理,优选地在至少80℃的温度并且更优选地在至少95℃、甚至更优选地至少100℃并且最优选地至少120℃的温度干馏热处理,并且优选地持续足以使经处理的液体无菌的持续时间。
877、在本发明的其他优选的实施方案中,热处理涉及以下或者甚至由以下组成:蒸汽输注或喷雾烹饪,优选地在至少100℃的温度并且更优选地在至少120℃、甚至更优选地至少130℃并且最优选地至少140℃的温度蒸汽输注或喷雾烹饪,并且优选地持续足以使经处理的液体无菌的持续时间。
878、在本发明的一些优选的实施方案中,巴氏灭菌与物理微生物减少相结合。
879、物理微生物减少的有用的实例涉及细菌过滤、uv辐射、高压处理、脉冲电场处理和超声中的一种或更多种。
880、在本发明的一些优选的实施方案中,热处理是灭菌热处理,并且因此产生无菌液体混合物,并且因此产生无菌饮料。这样的灭菌可以例如通过将细菌过滤和巴氏灭菌结合或者通过在至少100℃进行热处理并持续足以获得灭菌的持续时间来获得。
881、在热处理之后使液体混合物经历冷却是有益的。根据本发明的工艺的优选的实施方案,在热处理之后,热处理的液体混合物被冷却到优选地0℃至70℃、优选地0℃至60℃、甚至更优选地0℃至30℃并且最优选地0℃-20℃。
882、如果热处理不对液体混合物进行灭菌,则在热处理之后,热处理的液体混合物优选地冷却到0℃至15℃、更优选地1℃至10℃并且最优选地1℃-5℃。
883、冷却可以在填充步骤之前或在填充步骤之后发生。
884、冷却通常涉及闪蒸冷却和/或常规的热交换器。
885、通过闪蒸冷却的至少部分冷却通常是优选的,特别是在热灭菌热处理之后。闪蒸冷却通常剥离冷却的液体中的一些挥发性化合物。具有在5.5-8.5的范围内的ph的乳清蛋白饮料在热处理期间特别容易产生令人不愉快的气味,并且这些令人不愉快的气味从热处理的液体中部分剥离,并在闪蒸冷却系统附近释放。这是一个缺点,因为它使操作热处理系统的人员暴露于令人恼火的气味,并且还可以与健康问题相关联。
886、本发明人已经发现,有利地,基于本发明的氧化的乳清蛋白组合物的热处理的饮料的闪蒸冷却释放少得多并且甚至有时不释放这样的令人不愉快的气味。
887、本发明的工艺可以被实施为分批工艺、半分批工艺和连续工艺。
888、本发明的另一个具体方面涉及一种生产热处理的并且优选地热灭菌的饮料的工艺,该工艺包括进行本文描述的方法的步骤a)、步骤b)和任选地步骤c),以获得氧化的乳清蛋白组合物,并且随后根据如本文描述的步骤2)包装氧化的乳清蛋白组合物。
889、如果氧化的乳清蛋白组合物要直接用作饮料,则优选的是步骤b)和/或步骤c)涉及热灭菌热处理,即使经处理的液体无菌的热处理。
890、如上文提及的,诸如热处理通常需要将待处理的液体加热到在100℃-160℃的范围内的温度,持续足以对液体进行灭菌的持续时间。本文描述了用于诸如热处理的合适的时间/温度组合。
891、本发明的又一个方面涉及一种食品产品,该食品产品包含本发明的氧化的乳清蛋白组合物,其优选地以贡献相对于食品产品的重量的至少0.5%w/w的量的蛋白质的量。食品产品优选地还包含至少一种非乳清组分。
892、术语“非乳清组分”意指既不存在于氧化的乳清蛋白组合物中也不存在于未氧化的乳清蛋白浓缩物中的组分。
893、本发明的更狭隘的方面涉及具有5.5-8.5的ph的热处理的并且优选地热灭菌的饮料,该饮料包含足以贡献至少0.5%w/w的蛋白质的量的如本文描述的氧化的乳清蛋白组合物。
894、本发明的热处理的饮料的益处是它具有比可比较的现有技术饮料更好的气味,并且本发明人已经观察到本发明的饮料具有令人惊讶的低h2s含量。
895、热处理的饮料优选地具有5.5-8.5、更优选地6.0-8.0、甚至更优选地6.3-7.5并且最优选地6.5-7.5的ph。
896、优选地,具有5.5-8.5的ph的热处理的并且优选地热灭菌的饮料具有至多5μmol/l、更优选地3μmol/l、甚至更优选地1.0μmol/l并且最优选地至多0.7μmol/l的h2s含量。
897、特别优选的是,具有5.5-8.5的ph的热处理的并且优选地热灭菌的饮料在生产之后1小时具有至多5μmol/l、更优选地3μmol/l、甚至更优选地1.0μmol/l并且最优选地至多0.7μmol/l的h2s含量。
898、此外,优选的是,具有5.5-8.5的ph的热处理的并且优选地热灭菌的饮料在生产之后7天具有至多5μmol/l、更优选地3μmol/l、甚至更优选地1.0μmol/l并且最优选地至多0.7μmol/l的h2s含量。
899、本发明人已经发现,相对于现有技术的可比较的热处理的、ph中性的含乳清蛋白的饮料,上文提及的热处理的饮料具有特别有利的气味。
900、特别优选的是,热处理的饮料是无菌的。
901、热处理的饮料优选地是包装的热处理的饮料,并且优选地包装在封闭的容器诸如例如瓶子中。这样的包装的热处理的饮料是消费者高度优选的,并且通常都具有在环境温度的长的保质期,并且可以运输和摄入到消费者希望的地方。
902、在本发明的一些优选的实施方案中,热处理的饮料具有至少6个月、更优选地至少1年并且甚至更优选地至少2年的在环境温度的保质期。
903、热处理的饮料优选地包含在相对于饮料的重量的0.5%w/w-15%w/w、更优选地相对于饮料的重量的1%w/w-10%w/w、甚至更优选地相对于饮料的重量的2%w/w-9%w/w并且最优选地相对于饮料的重量的3%w/w-8%w/w的范围内的蛋白质总量。
904、可选择地,但还是优选的,热处理的饮料可以包含在相对于热处理的饮料的重量的4%w/w-15%w/w、更优选地相对于热处理的饮料的重量的5%w/w-14%w/w、甚至更优选地相对于液体混合物的重量的6%w/w-13%w/w并且最优选地相对于热处理的饮料的重量的8%w/w-12%w/w的范围内的蛋白质总量。
905、本发明的氧化的乳清蛋白组合物优选地贡献热处理的饮料的总蛋白质的至少30%w/w、更优选地总蛋白质的至少50%w/w、甚至更优选地总蛋白质的至少70%w/w并且最优选地总蛋白质的至少80%w/w。
906、甚至更高的贡献通常是优选的,并且在本发明的一些优选的实施方案中,本发明的氧化的乳清蛋白组合物贡献热处理的饮料的总蛋白质的至少90%w/w、更优选地总蛋白质的至少95%w/w、甚至更优选地总蛋白质的至少99%w/w并且最优选地总蛋白质的100%w/w。
907、如果氧化的乳清蛋白组合物与其他蛋白质来源组合使用,则优选的是,使用具有相对低含量的硫醇基团的来源。
908、在本发明的一些优选的实施方案中,热处理的饮料优选地包含相对于总固体的至少15%w/w、更优选地相对于总固体的至少20%w/w、并且最优选地相对于总固体的至少25%w/w并且最优选地相对于总固体的至少30%w/w的量的总蛋白质。对于用于临床营养品的饮料,这些范围的低端是特别优选的,这些饮料除了蛋白质之外通常还包含大量的脂肪和碳水化合物。
909、例如当饮料意图作为运动蛋白质饮料时,总蛋白质可以贡献总固体的甚至更大的部分。因此,在本发明的一些优选的实施方案中,热处理的饮料包含相对于总固体的至少80%w/w、更优选地相对于总固体的至少90%w/w、甚至更优选地相对于总固体的至少92%w/w并且最优选地相对于总固体的至少94%w/w的量的总蛋白质。
910、热处理的饮料优选地具有0.5%w/w-50%w/w、更优选地1%w/w-35%w/w、甚至更优选地2%w/w-20%w/w并且最优选地3%w/w-10%w/w的固体含量。
911、热处理的饮料的不由固体组成的部分优选地包含水。热处理的饮料的不由固体组成的部分优选地包含至少80%w/w、更优选地至少90%w/w、甚至更优选地95%w/w并且更优选地至少99%w/w的量的水。
912、在本发明的一些优选的实施方案中,热处理的饮料具有至多100千卡/100g、更优选地至多80千卡/100g、甚至更优选地至多70千卡/100g并且最优选地至多60千卡/100g的卡路里含量。优选地,热处理的饮料可以具有2-100千卡/100g、更优选地4-80千卡/100g、甚至更优选地8-70千卡/100g并且最优选地12-60千卡/100g的卡路里含量。例如对于其中蛋白质来源是主要能量来源的运动应用,这些实施方案是优选的。
913、在本发明的其他优选的实施方案中,热处理的饮料具有大于100千卡/100g、更优选地至少120千卡/100g、甚至更优选地至少140千卡/100g并且最优选地至少150千卡/100g的卡路里含量。优选地,热处理的饮料可以具有101-300千卡/100g、更优选地120-280千卡/100g、甚至更优选地140-270千卡/100g并且最优选地150-260千卡/100g的卡路里含量。例如对于其中蛋白质来源伴随大量碳水化合物和脂肪的临床营养,这些实施方案是优选的。
914、本发明的热处理的饮料可以包含除蛋白质以外的其他常量营养素,诸如例如碳水化合物和/或脂质。
915、在本发明的一些实施方案中,热处理的饮料还包含碳水化合物。本发明的热处理的饮料中的总碳水化合物含量取决于热处理的饮料的预期用途。
916、经包装的热处理的饮料的碳水化合物优选地由一种或更多种碳水化合物来源提供。
917、有用的碳水化合物来源可以选自由以下项组成的组:蔗糖、麦芽糖、右旋糖、半乳糖、麦芽糊精、玉米糖浆固体、舒可慢、葡萄糖聚合物、玉米糖浆、改性淀粉、抗性淀粉、稻米来源的碳水化合物、异麦芽酮糖、白糖、葡萄糖、果糖、乳糖、高果糖玉米糖浆、蜂蜜、糖醇、低聚果糖、大豆纤维、玉米纤维、瓜尔胶、魔芋粉、聚右旋糖、善倍素及其组合。在本发明的一些实施方案中,经包装的热处理的饮料包含不易消化的糖如果聚糖,果聚糖包含菊粉或低聚果糖。
918、在本发明的一些优选的实施方案中,热处理的饮料包含在饮料的总能量含量的0%至95%之间、更优选地在饮料的总能量含量的10%至85%之间的范围内、甚至更优选地在饮料的总能量含量的20%至75%之间的范围内并且最优选地在饮料的总能量含量的30%至60%之间的范围内的碳水化合物。
919、营养产品中营养素的能量贡献的确定是技术人员熟知的,并且涉及计算每组营养素相对于总能量含量的能量贡献。例如,已知碳水化合物贡献4.0千卡/g碳水化合物,已知蛋白质贡献4.0千卡/g蛋白质,并且已知脂肪贡献9.0千卡/g脂肪。总能量含量通过在弹式热量计中燃烧所论述的组合物来确定。
920、甚至更低的碳水化合物含量通常是优选的,因此在本发明的一些优选的实施方案中,优选地在饮料的总能量含量的0%至30%之间的范围内、更优选地在饮料的总能量含量的0%至20%之间的范围内、甚至更优选地在饮料的总能量含量的0%至10%之间的范围内。
921、在本发明的一些优选的实施方案中,饮料作为运动饮料是特别有用的,并且例如包含饮料的总能量含量的至多75%(e%)、更优选地至多40e%、甚至更优选地至多10e%并且最优选地至多5e%的碳水化合物总量。
922、在本发明的一些优选的实施方案中,经包装的热处理的饮料作为营养不全面的营养补充剂是特别有用的,并且例如包含在饮料的总能量含量的70%-95%(e%)之间、优选地80e%-90e%之间的范围内的碳水化合物总量。
923、在本发明的一些优选的实施方案中,热处理的饮料包含在饮料的总能量含量的30%-60%之间并且最优选地35e%-50e%之间的范围内的碳水化合物总量。这样的饮料对于营养全面的饮料是特别有用的。
924、在本发明的一些实施方案中,热处理的饮料还包含至少一种选自由以下项组成的组的另外的成分:维生素、调味剂、矿物质、甜味剂、抗氧化剂、食品酸味剂、脂质、碳水化合物、益生元、益生菌及其组合。
925、另外的成分可以用于调节饮料的营养贡献以及口感和风味特性。
926、在本发明的一种实施方案中,饮料包含至少一种高强度甜味剂(his)。至少一种his优选地选自由以下项组成的组:阿斯巴甜、甜蜜素、三氯蔗糖、乙酰磺胺酸盐、纽甜、糖精、甜叶菊提取物、甜菊糖苷诸如例如甜菊双糖苷a,或其组合。
927、在本发明的一些实施方案中,特别优选的是,甜味剂包含一种或更多种高强度甜味剂或者甚至由一种或更多种高强度甜味剂组成。
928、his在天然甜味剂和人工甜味剂两者中都有发现,并且通常具有是蔗糖的甜味强度的至少10倍的甜味强度。
929、如果使用,则饮料的his的总量通常在0.001%w/w-2%w/w的范围内。优选地,his总量在0.005%w/w-1%w/w的范围内。最优选地,his的总量在0.01%w/w-0.5%w/w的范围内。
930、甜味剂的选择可以取决于待生产的饮料,例如高强度甜味剂(例如,阿斯巴甜、乙酰磺胺酸钾或三氯蔗糖)可以用于其中不需要来自甜味剂的能量贡献的饮料,而对于具有天然概况的饮料,可以使用天然甜味剂(例如,甜菊糖苷、山梨糖醇或蔗糖)。
931、此外,可以优选的是,甜味剂包含一种或更多种多元醇甜味剂或者甚至由一种或更多种多元醇甜味剂组成。有用的多元醇甜味剂的非限制性实例是麦芽糖醇、甘露糖醇、乳糖醇、山梨糖醇、肌醇、木糖醇、苏糖醇、半乳糖醇或其组合。如果使用,则饮料的多元醇甜味剂的总量通常在1%w/w-20%w/w的范围内。更优选地,饮料的多元醇甜味剂的总量在2%w/w-15%w/w的范围内。甚至更优选地,多元醇甜味剂的总量可以在4%w/w-10%w/w的范围内。
932、在本发明的一些优选的实施方案中,热处理的饮料包含:
933、-至多1%w/w、更优选地至多0.5%w/w并且最优选地至多0.1%w/w的碳水化合物总量,以及
934、-在0.001%w/w-2%w/w的范围内、更优选地在0.005%w/w-1%w/w的范围内并且最优选地在0.01%w/w-0.5%w/w的范围内的his总量。
935、在本发明的一些实施方案中,热处理的饮料还包含脂质。本发明的热处理的饮料中的总脂质含量取决于热处理的饮料的预期用途。
936、在本发明的一些优选的实施方案中,热处理的饮料具有在饮料的总能量含量的0%至50%之间、或优选地在饮料的总能量含量的0%至40%之间的范围内、或优选地在饮料的总能量含量的0%至30%之间的范围内、或优选地在饮料的总能量含量的0%至20%之间的范围内、或优选地在饮料的总能量含量的0%至10%之间的范围内、或优选地在饮料的总能量含量的0%至5%之间的范围内的脂质含量。
937、在本发明的一些优选的实施方案中,饮料包含至多10e%、更优选地至多5e%并且最优选地至多1e%的脂质总量。
938、在本发明的一些优选的实施方案中,热处理的饮料作为营养不全面的营养补充剂是特别有用的,并且例如包含饮料的总能量含量的至多10%、优选地至多1e%的脂质总量。
939、在本发明的一些优选的实施方案中,饮料包含至多10e%、更优选地至多5e%并且最优选地至多1e%的碳水化合物总量。
940、在本发明的一些优选的实施方案中,热处理的饮料具有在20℃和在300s-1的剪切速率至多200cp、更优选地在20℃和在300s-1的剪切速率至多100cp、甚至更优选地在20℃和在300s-1的剪切速率至多50cp并且最优选地在20℃和在300s-1的剪切速率至多20cp的粘度。
941、本发明人已经发现,本发明的氧化的乳清蛋白组合物可用于透明饮料,并且在本发明的一些优选的实施方案中,热处理的饮料具有至多400ntu、更优选地至多100ntu、甚至更优选地至多50ntu并且最优选地至多20ntu的浊度。
942、在本发明的一些优选的实施方案中,例如呈运动饮料的形式的饮料包含:
943、-在相对于饮料的重量的0.5%w/w-15%w/w、更优选地相对于饮料的重量的1%w/w-10%w/w、甚至更优选地相对于饮料的重量的2%w/w-9%w/w并且最优选地相对于饮料的重量的3%w/w-8%w/w的范围内的蛋白质总量,
944、-饮料的总能量含量的至多75%(e%)、更优选地至多40e%、甚至更优选地至多10e%并且最优选地至多5e%的碳水化合物总量,以及
945、-至多10e%、更优选地至多6e%、甚至更优选地至多3e%并且最优选地至多1e%的脂质总量。
946、在本发明的其他优选的实施方案中,例如呈低碳水化合物运动饮料的形式的饮料包含:
947、-在相对于饮料的重量的0.5%w/w-15%w/w、更优选地相对于饮料的重量的1%w/w-10%w/w、甚至更优选地相对于饮料的重量的2%w/w-9%w/w并且最优选地相对于饮料的重量的3%w/w-8%w/w的范围内的蛋白质总量,
948、-至多10e%、更优选地至多6e%、甚至更优选地至多3e%并且最优选地至多1e%的碳水化合物总量,
949、-至多5e%、更优选地至多4e%、甚至更优选地至多3e%并且最优选地至多1e%的脂质总量,以及
950、-在0.001%w/w-2%w/w的范围内、更优选地在0.005%w/w-1%w/w的范围内并且最优选地在0.01%w/w-0.5%w/w的范围内的his总量。
951、在本发明的其他优选的实施方案中,例如呈营养全面的饮料的形式的经包装的热处理的饮料包含:
952、-在相对于饮料的重量的0.5%w/w-15%w/w、更优选地相对于饮料的重量的1%w/w-10%w/w、甚至更优选地相对于饮料的重量的2%w/w-9%w/w并且最优选地相对于饮料的重量的3%w/w-8%w/w的范围内的蛋白质总量,
953、-在饮料的总能量含量的30%-60%之间的范围内并且最优选地在35e%-50e%之间的范围内的碳水化合物总量,以及
954、-在总能量含量的20%-50%的范围内、更优选地在25e%-45e%之间的范围内并且最优选地在30e%-40e%之间的范围内的脂质总量。
955、在本发明的一些优选的实施方案中,热处理的饮料具有在6.2-7.5、最优选地6.8-7.5的范围内的ph,并且包含:
956、-在相对于饮料的重量的0.5%w/w-15%w/w、更优选地相对于饮料的重量的1%w/w-10%w/w、甚至更优选地相对于饮料的重量的2%w/w-9%w/w并且最优选地相对于饮料的重量的3%w/w-8%w/w的范围内的蛋白质总量,
957、并且其中来自氧化的乳清蛋白组合物的蛋白质提供热处理的饮料的总蛋白质的至少50%w/w、更优选地热处理的饮料的总蛋白质的至少70%w/w、甚至更优选地热处理的饮料的总蛋白质的至少90%w/w并且最优选地热处理的饮料的总蛋白质的100%w/w。
958、在本发明的其他优选的实施方案中,热处理的饮料具有在6.2-7.5、最优选地6.8-7.5的范围内的ph,并且包含:
959、-在相对于饮料的重量的4%w/w-15%w/w、更优选地相对于饮料的重量的5%w/w-14%w/w、甚至更优选地相对于饮料的重量的6%w/w-13%w/w并且最优选地相对于饮料的重量的8%w/w-12%w/w的范围内的蛋白质总量,
960、并且其中来自氧化的乳清蛋白组合物的蛋白质提供热处理的饮料的总蛋白质的至少50%w/w、更优选地热处理的饮料的总蛋白质的至少70%w/w、甚至更优选地热处理的饮料的总蛋白质的至少90%w/w并且最优选地热处理的饮料的总蛋白质的100%w/w。
961、热处理的饮料的碳水化合物和脂肪的含量可以变化并且取决于应用。
962、在本发明的一些优选的实施方案中,例如呈运动饮料的形式的热处理的饮料包含:
963、-饮料的总能量含量的至多75%(e%)、更优选地至多40e%、甚至更优选地至多10e%、甚至更优选地至多5e%并且最优选地至多1e%的碳水化合物总量,以及
964、-至多10e%、更优选地至多6e%、甚至更优选地至多3e%并且最优选地至多1e%的脂质总量。
965、在本发明的其他优选的实施方案中,例如呈营养全面的饮料的形式的经包装的热处理的饮料包含:
966、-在饮料的总能量含量的30%-60%之间的范围内并且最优选地在35e%-50e%之间的范围内的碳水化合物总量,以及
967、-在总能量含量的20%-50%的范围内、更优选地在25e%-45e%之间的范围内并且最优选地在30e%-40e%之间的范围内的脂质总量。
968、食品产品,并且特别是热处理的饮料,优选地通过本发明的工艺可获得。
969、本发明的又一个方面涉及一种食品成分,该食品成分包含:
970、-本文描述的氧化的乳清蛋白组合物的固体,以及
971、-一种或更多种另外的成分,其优选地选自:
972、-乳品成分,优选地未氧化的乳品成分,
973、-基于植物的成分,
974、-非乳品碳水化合物来源,
975、-调味剂,和/或
976、-甜味剂(甜碳水化合物/多元醇/his)。
977、关于食品成分的另外的细节在下文找到的编号的实施方案中描述。
978、本发明的又一个方面涉及氧化的乳清蛋白组合物、优选地本发明的氧化的乳清蛋白组合物作为食品成分的用途,优选地用于改进气味和/或降低类似于热灭菌的饮料的臭鸡蛋气味的令人不愉快的气味水平,该热灭菌的饮料具有在5.5-8.5的范围内的ph,优选地具有至少3%w/w的乳清蛋白含量,并且优选地使用间接热处理进行热灭菌。
979、在以下编号的实施方案中描述了本发明的一些特别优选的实施方案。
980、编号的实施方案1.一种生产氧化的乳清蛋白组合物的方法,该方法包括
981、a)加工乳清蛋白源以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
982、-能够氧化半胱氨酸的硫醇基团的氧化剂,并且
983、具有:
984、-在6.5-9.5的范围内的ph,
985、-相对于氧化乳清蛋白溶液的重量的至少1%w/w的总蛋白质含量,
986、-相对于总蛋白质的至少10%w/w的β-乳球蛋白(blg)含量,
987、-优选地,相对于总固体的至少30%w/w的蛋白质含量,
988、-优选地,相对于总固体的至多3%w/w的总脂肪含量,
989、并且其中氧化乳清蛋白溶液还:
990、i)具有在0℃-160℃的范围内的温度,和/或
991、ii)被加压到在20巴-4000巴的范围内的压力,
992、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,优选地以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多15μmol/g蛋白质,所述一种或更多种条件涉及:
993、i)氧化乳清蛋白溶液具有在0℃-160℃的范围内的温度,和/或
994、ii)氧化乳清蛋白溶液被加压到在20巴-4000巴的范围内的压力,
995、c)任选地,但优选地,使从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物经历热处理步骤,该热处理步骤涉及加热到至少60℃的温度,
996、d)任选地,但优选地,干燥液体进料,该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
997、编号的实施方案1a.一种生产氧化的乳清蛋白组合物的方法,该方法包括
998、a)加工乳清蛋白源以提供氧化乳清蛋白溶液,该氧化乳清蛋白溶液包含:
999、-能够氧化半胱氨酸的硫醇基团的氧化剂,并且
1000、具有:
1001、-在6.5-9.5的范围内的ph,
1002、-相对于氧化乳清蛋白溶液的重量的至少1%w/w的总蛋白质含量,
1003、-相对于总蛋白质的至少10%w/w的β-乳球蛋白(blg)含量,
1004、-优选地,相对于总固体的至少30%w/w的蛋白质含量,
1005、-优选地,相对于总固体的至多3%w/w的总脂肪含量,
1006、并且其中氧化乳清蛋白溶液还:
1007、i)具有在0℃-65℃的范围内的温度,和/或
1008、ii)被加压到在100巴-4000巴的范围内的压力,
1009、b)在允许将氧化乳清蛋白溶液的blg分子中的至少一些blg分子的游离硫醇氧化的一种或更多种条件下孵育氧化乳清蛋白溶液,优选地以将氧化乳清蛋白溶液的游离硫醇基团的量减少到至多15μmol/g蛋白质,所述一种或更多种条件涉及:
1010、i)氧化乳清蛋白溶液具有在0℃-65℃的范围内的温度,和/或
1011、ii)氧化乳清蛋白溶液被加压到在100巴-4000巴的范围内的压力,
1012、c)任选地,但优选地,使从步骤b)获得的氧化的乳清蛋白溶液或其蛋白质浓缩物经历热处理步骤,该热处理步骤涉及加热到至少60℃的温度,
1013、d)任选地,但优选地,干燥液体进料,该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
1014、编号的实施方案2.根据编号的实施方案1所述的方法,其中能够氧化半胱氨酸的硫醇基团的氧化剂包含以下项或者甚至由以下项组成:过氧化物、臭氧、分子氧或其组合。
1015、编号的实施方案3.根据前述编号的实施方案中任一项所述的方法,其中能够氧化半胱氨酸的硫醇基团的氧化剂是选自由过氧化氢、过氧化苯甲酰及其混合物组成的组的过氧化物。
1016、编号的实施方案4.根据前述编号的实施方案中任一项所述的方法,其中氧化剂用电化学方法产生。
1017、编号的实施方案5.根据前述编号的实施方案中任一项所述的方法,其中氧化剂用酶促方法产生。
1018、编号的实施方案6.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为至少1:2、更优选地至少1:1、甚至更优选地至少2:1并且最优选地至少3:1:
1019、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
1020、-游离硫醇基团的总量。
1021、编号的实施方案7.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液的以下项之间的摩尔比为1:2-200:1、更优选地1:2-100:1、甚至更优选地1:1-30:1并且最优选地1:1-15:1:
1022、-能够氧化半胱氨酸的硫醇基团的氧化剂,和
1023、-游离硫醇基团的总量。
1024、编号的实施方案8.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在7.0-9.5、更优选地7.1-8.5、甚至更优选地7.2-8.5并且最优选地7.4-8.2的范围内的ph。
1025、编号的实施方案9.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在6.5-8.5、更优选地6.6-8.0、甚至更优选地6.7-7.5并且最优选地6.8-7.3的范围内的ph。
1026、编号的实施方案10.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的重量的至少2%w/w、更优选地至少3%w/w、甚至更优选地至少5%w/w并且最优选地至少6%w/w的总蛋白质含量。
1027、编号的实施方案11.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的重量的1%w/w-30%w/w、更优选地3%w/w-20%w/w、甚至更优选地4%w/w-15%w/w并且最优选地至少6%w/w-10%w/w的范围内的总蛋白质含量。
1028、编号的实施方案12.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的重量的1%w/w-12%w/w、更优选地3%w/w-11%w/w、甚至更优选地4%w/w-10%w/w并且最优选地5%w/w-9%w/w的范围内的总蛋白质含量。
1029、编号的实施方案13a.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的总固体的至少30%w/w、更优选地相对于氧化乳清蛋白溶液的总固体的至少50%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总固体的至少75%w/w并且最优选地相对于氧化乳清蛋白溶液的总固体的至少85%w/w的总蛋白质含量。
1030、编号的实施方案13b.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的总固体的30%w/w-99%w/w、更优选地相对于氧化乳清蛋白溶液的总固体的50%w/w-97%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总固体的75%w/w-96%w/w并且最优选地相对于氧化乳清蛋白溶液的总固体的至少85%w/w-95%w/w的范围内的总蛋白质含量。
1031、编号的实施方案14.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的总蛋白质的至少20%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少40%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少45%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的至少50%w/w的blg含量。
1032、编号的实施方案15.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有相对于氧化乳清蛋白溶液的总蛋白质的至少55%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少60%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的至少80%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的至少90%w/w的blg含量。
1033、编号的实施方案16.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的总蛋白质的10%w/w-99%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的45%w/w-98%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的80%w/w-96%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的90%w/w-95%w/w的范围内的blg含量。
1034、编号的实施方案17.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有在相对于氧化乳清蛋白溶液的总蛋白质的10%w/w-90%w/w、更优选地相对于氧化乳清蛋白溶液的总蛋白质的20%w/w-80%w/w、甚至更优选地相对于氧化乳清蛋白溶液的总蛋白质的30%w/w-75%w/w并且最优选地相对于氧化乳清蛋白溶液的总蛋白质的45%w/w-70%w/w的范围内的blg含量。
1035、编号的实施方案18.根据前述编号的实施方案中任一项所述的方法,其中步骤a)的氧化乳清蛋白溶液具有相对于总固体的至多1%w/w、更优选地相对于总固体的至多0.5%w/w、甚至更优选地相对于总固体的至多0.2%w/w并且最优选地相对于总固体的至多0.1%w/w的总脂肪含量。
1036、编号的实施方案19.根据前述编号的实施方案中任一项所述的方法,其中条件i)涉及步骤a)的氧化乳清蛋白溶液具有在5℃-65℃、更优选地10℃-65℃、甚至更优选地30℃-60℃并且最优选地40℃-55℃的范围内的温度。
1037、编号的实施方案19a.根据前述编号的实施方案中任一项所述的方法,其中条件i)涉及步骤a)的氧化乳清蛋白溶液具有在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内的温度。
1038、编号的实施方案20.根据前述编号的实施方案中任一项所述的方法,其中条件ii)涉及使步骤a)的氧化乳清蛋白溶液经历在100巴-4000巴、更优选地200巴-3500巴、甚至更优选地300巴-3000巴并且最优选地500巴-2500巴的范围内的压力。
1039、编号的实施方案20a.根据前述编号的实施方案中任一项所述的方法,其中条件ii)涉及使步骤a)的氧化乳清蛋白溶液经历在25巴-1000巴、更优选地30巴-500巴、甚至更优选地35巴-300巴并且最优选地40巴-200巴的范围内的压力。
1040、编号的实施方案21.根据前述编号的实施方案中任一项所述的方法,其中步骤a)包括条件i)。
1041、编号的实施方案22.根据前述编号的实施方案中任一项所述的方法,其中步骤a)包括条件ii)。
1042、编号的实施方案23.根据前述编号的实施方案中任一项所述的方法,其中步骤a)包括特征i)和特征ii)两者。
1043、编号的实施方案24.根据前述编号的实施方案中任一项所述的方法,其中步骤a)中乳清蛋白源的加工涉及:
1044、i)优选地通过组合或混合,使乳清蛋白源与至少能够氧化半胱氨酸的硫醇的氧化剂和任选地另外的成分接触,
1045、ii)如有需要,ph调节以获得在6.5-9.5的范围内的ph,
1046、iii)任选地,加压以获得在20巴-4000巴的范围内的压力,
1047、iv)任选地,将温度调节到在0℃-160℃的范围内的温度。
1048、编号的实施方案24a.根据前述编号的实施方案中任一项所述的方法,其中步骤a)中乳清蛋白源的加工涉及:
1049、i)优选地通过组合或混合,使乳清蛋白源与至少能够氧化半胱氨酸的硫醇的氧化剂和任选地另外的成分接触,
1050、ii)如有需要,ph调节以获得在6.5-9.5的范围内的ph,
1051、iii)任选地,加压以获得在100巴-4000巴的范围内的压力,
1052、iv)任选地,将温度调节到在0℃-65℃的范围内的温度。
1053、编号的实施方案25.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%。
1054、编号的实施方案26.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%。
1055、编号的实施方案27.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%。
1056、编号的实施方案28.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多10%、更优选地初始量的至多5%、甚至更优选地初始量的至多3%并且最优选地初始量的至多1%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多10%、更优选地初始量的至多5%、甚至更优选地初始量的至多3%并且最优选地初始量的至多1%。
1057、编号的实施方案29.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的0.01%-30%、更优选地初始量的0.02%-25%、甚至更优选地初始量的0.05%-20%并且最优选地初始量的0.1%-10%,或者进行步骤b)以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的0.01%-30%、更优选地初始量的0.02%-25%、甚至更优选地初始量的0.05%-20%并且最优选地初始量的0.1%-10%。
1058、编号的实施方案30.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质,或者进行步骤b)以将氧化乳清蛋白溶液的游离硫醇的量减少到至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质。
1059、编号的实施方案31.根据前述编号的实施方案中任一项所述的方法,其中步骤b)将氧化乳清蛋白溶液的游离硫醇的量减少到至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质,或者进行步骤b)以将氧化乳清蛋白溶液的游离硫醇的量减少到至多1μmol/g蛋白质、更优选地至多0.7μmol/g蛋白质、甚至更优选地至多0.5μmol/g蛋白质并且最优选地至多0.2μmol/g蛋白质。
1060、编号的实施方案32.根据前述编号的实施方案中任一项所述的方法,其中步骤b)涉及在氧化期间将ph调节至在6.5-9.5、更优选地7.0-8.5、甚至更优选地7.2-8.5并且最优选地7.5-8.5的范围内的ph。
1061、编号的实施方案33.根据前述编号的实施方案中任一项所述的方法,其中以下项之间的摩尔比为1:2-30:1、更优选地1:2-25:1、甚至更优选地1:1-20:1并且最优选地1:1-15:1:
1062、-在步骤b)期间消耗的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
1063、-步骤a)中游离硫醇基团的初始量。
1064、编号的实施方案34.根据前述编号的实施方案中任一项所述的方法,其中以下项之间的摩尔比为2:1-30:1、更优选地3:1-25:1、甚至更优选地4:1-20:1并且最优选地5:1-15:1:
1065、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
1066、-步骤a)中游离硫醇基团的初始量。
1067、编号的实施方案35.根据前述编号的实施方案中任一项所述的方法,其中以下项之间的摩尔比为1:4-15:1、更优选地1:3-10:1、甚至更优选地1:2-5:1并且最优选地1:2-2:1:
1068、-在步骤b)期间消耗的能够氧化半胱氨酸的硫醇基团的氧化剂的量,但不包括在步骤b)结束时去除的任何过量氧化剂,和
1069、-步骤a)中游离硫醇基团的初始量。
1070、编号的实施方案36.根据前述编号的实施方案中任一项所述的方法,本发明的方法不涉及亚硫酸盐的添加和/或不涉及亚硫酸化溶解。
1071、编号的实施方案37.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的一种或更多种条件涉及i)氧化乳清蛋白溶液具有在5℃-65℃、更优选地10℃-65℃、甚至更优选地30℃-60℃并且最优选地40℃-60℃的范围内的温度。
1072、编号的实施方案37a.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的一种或更多种条件涉及i)氧化乳清蛋白溶液具有在66℃-160℃、更优选地70℃-145℃、甚至更优选地75℃-120℃并且最优选地80℃-100℃的范围内的温度。
1073、编号的实施方案38.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%的持续时间。
1074、编号的实施方案39.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%的持续时间。
1075、编号的实施方案40.根据编号的实施方案38所述的方法,其中步骤b)的氧化乳清蛋白溶液的温度保持在期望的温度范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%的持续时间。
1076、编号的实施方案41.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的条件涉及ii)使氧化乳清蛋白溶液经历在100巴-4000巴、更优选地200巴-3500巴、甚至更优选地300巴-3000巴并且最优选地500巴-2500巴的范围内的压力。
1077、编号的实施方案41a.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的条件涉及ii)使氧化乳清蛋白溶液经历在25巴-1000巴、更优选地30巴-500巴、甚至更优选地35巴-300巴并且最优选地40巴-200巴的范围内的压力。
1078、编号的实施方案42.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多80%、更优选地初始量的至多76%、甚至更优选地初始量的至多73%并且最优选地初始量的至多70%的持续时间。
1079、编号的实施方案43.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的氧化乳清蛋白溶液的压力保持在期望的压力范围内,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的20%-80%、更优选地初始量的30%-80%、甚至更优选地初始量的50%-75%并且最优选地初始量的60%-75%的持续时间。
1080、编号的实施方案44.根据编号的实施方案42所述的方法,其中使步骤b)的氧化乳清蛋白溶液经历压力,持续足以将步骤a)的氧化乳清蛋白溶液的游离硫醇基团的初始量减少到初始量的至多30%、更优选地初始量的至多25%、甚至更优选地初始量的至多20%并且最优选地初始量的至多15%的持续时间。
1081、编号的实施方案45.根据前述编号的实施方案中任一项所述的方法,其中步骤b)涉及在步骤b)期间将氧化乳清蛋白溶液的温度以至多2℃每分钟、更优选地至多1℃每分钟、甚至更优选地至多0.3℃每分钟并且最优选地至多0.1℃每分钟的加热速率升高到最大氧化温度。
1082、编号的实施方案46.根据前述编号的实施方案中任一项所述的方法,其中步骤b)不涉及在步骤b)期间添加或产生另外的能够氧化半胱氨酸的硫醇基团的氧化剂。
1083、编号的实施方案47.根据前述编号的实施方案中任一项所述的方法,其中步骤b)涉及在步骤b)期间添加或产生另外的能够氧化半胱氨酸的硫醇基团的氧化剂。
1084、编号的实施方案48.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的持续时间为至多48小时、更优选地至多36小时、甚至更优选地至多30小时并且最优选地至多25小时。
1085、编号的实施方案49.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的持续时间为0.1小时-48小时、更优选地3小时-36小时、甚至更优选地5小时-30小时并且最优选地10小时-25小时。
1086、编号的实施方案50.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的持续时间为至多12小时、更优选地至多6小时、甚至更优选地至多3小时并且最优选地至多1小时。
1087、编号的实施方案50a.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的持续时间为至多10分钟、更优选地至多6分钟、甚至更优选地至多3分钟并且最优选地至多2分钟。
1088、编号的实施方案51.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的持续时间为0.1小时-12小时、更优选地0.1小时-6小时、甚至更优选地0.1小时-3小时并且最优选地0.1小时-1小时。
1089、编号的实施方案51a.根据前述编号的实施方案中任一项所述的方法,其中步骤b)的持续时间为0.1秒-10分钟、更优选地1秒-6分钟、甚至更优选地5秒-3分钟并且最优选地10秒-2分钟。
1090、编号的实施方案52.根据前述编号的实施方案中任一项所述的方法,其中步骤b)涉及允许氧化进行,直到大体上所有能够氧化半胱氨酸的硫醇基团的氧化剂已经被使用。
1091、编号的实施方案53.根据前述编号的实施方案中任一项所述的方法,其中步骤b)涉及通过使氧化乳清蛋白溶液与消除残余的能够氧化半胱氨酸的硫醇基团的氧化剂的组分、优选地过氧化氢酶接触来停止所述氧化。
1092、编号的实施方案54.根据前述编号的实施方案中任一项所述的方法,还包括涉及使从步骤b)获得的氧化的乳清蛋白溶液经历热处理步骤的c)。
1093、编号的实施方案55.根据前述编号的实施方案中任一项所述的方法,还包括干燥液体进料的步骤d),该液体进料至少包含衍生自从步骤b)获得的氧化的乳清蛋白溶液的蛋白质。
1094、编号的实施方案56.一种氧化的乳清蛋白组合物,具有:
1095、-相对于总固体的至少30%w/w的蛋白质含量,
1096、-优选地,相对于总固体的至多3%w/w的脂肪含量,
1097、-至多15μmol游离硫醇基团/g蛋白质,
1098、-优选地,相对于总蛋白质的至少0.7%w/w的色氨酸含量,
1099、-优选地,相对于总蛋白质的至少0.3%w/w的甲硫氨酸含量,
1100、-优选地,至多0.2微克/mg蛋白质的犬尿氨酸含量,
1101、-优选地,在100-600μmol/g蛋白质的范围内的蛋白质结合的硫的含量,以及
1102、-优选地,在150-400μmol/g蛋白质的范围内的形成二硫键的蛋白质结合的半胱氨酸残基的含量。
1103、编号的实施方案57.根据编号的实施方案56所述的氧化的乳清蛋白组合物,其通过如本文描述的乳清蛋白源的氧化可获得,优选地通过根据编号的实施方案1-49中一项或更多项所述的方法可获得。
1104、编号的实施方案58.根据编号的实施方案56-57中任一项所述的氧化的乳清蛋白组合物,呈液体或固体并且优选地粉末的形式。
1105、编号的实施方案59.一种生产食品产品的工艺,包括:
1106、-加工氧化的乳清蛋白组合物,和/或
1107、-将根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物或经加工的氧化的乳清蛋白组合物与一种或更多种另外的成分组合,并且任选地加工该组合。
1108、编号的实施方案60.一种生产热处理的并且优选地热灭菌的饮料的工艺,所述饮料具有5.5-8.5、更优选地6.5-7.5的ph,该工艺包括:
1109、1)将根据编号的实施方案50-52中一项或更多项所述的氧化的乳清蛋白组合物与一种或更多种另外的成分组合,以获得具有5.5-8.5的ph的液体混合物,并且该液体混合物包含:
1110、-足以贡献至少0.5%w/w蛋白质的量的氧化的乳清蛋白组合物,
1111、-优选地,甜味剂和/或调味剂,以及
1112、-水,
1113、2)将液体混合物包装在容器中,
1114、其中在包装之前和/或之后使液体混合物经历热灭菌。
1115、编号的实施方案61.根据编号的实施方案60所述的工艺,其中在热灭菌之前,液体混合物包含至多60μmol游离硫醇基团/100g液体混合物、更优选地至多40μmol游离硫醇基团/100g液体混合物、甚至更优选地至多30μmol游离硫醇基团/100g液体混合物并且最优选地至多30μmol游离硫醇基团/100g液体混合物。
1116、编号的实施方案62.根据编号的实施方案60或61所述的工艺,其中在热灭菌之前,液体混合物包含至多20μmol游离硫醇基团/100g液体混合物、更优选地至多15μmol游离硫醇基团/100g液体混合物、甚至更优选地至多10μmol游离硫醇基团/100g液体混合物并且最优选地至多5μmol游离硫醇基团/100g液体混合物。
1117、编号的实施方案63.一种食品产品,包含根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物,所述氧化的乳清蛋白组合物优选地以贡献相对于食品产品的重量的至少0.5%w/w的量的蛋白质的量。
1118、编号的实施方案64.一种热处理的、优选地热灭菌的饮料,具有5.5-8.5并且更优选地6.5-7.5的ph,该饮料包含足以贡献至少0.5%w/w蛋白质的量的根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物。
1119、编号的实施方案65.根据编号的实施方案64所述的热处理的、优选地热灭菌的饮料,具有至多5μmol/l、更优选地3μmol/l、甚至更优选地1.0μmol/l并且最优选地至多0.7μmol/l的h2s含量。
1120、编号的实施方案66.根据编号的实施方案64或65所述的热处理的、优选地热灭菌的饮料,在生产之后1小时具有至多5μmol/l、更优选地3μmol/l、甚至更优选地1.0μmol/l并且最优选地至多0.7μmol/l的h2s含量。
1121、编号的实施方案67.根据编号的实施方案64-66中任一项所述的热处理的、优选地热灭菌的饮料,在生产之后7天具有至多5μmol/l、更优选地3μmol/l、甚至更优选地1.0μmol/l并且最优选地至多0.7μmol/l的h2s含量。
1122、编号的实施方案68.根据编号的实施方案64-67中任一项所述的热处理的、优选地热灭菌的饮料,包含在相对于饮料的重量的0.5%w/w-15%w/w、更优选地相对于饮料的重量的1%w/w-10%w/w、甚至更优选地相对于饮料的重量的2%w/w-9%w/w并且最优选地相对于饮料的重量的3%w/w-8%w/w的范围内的蛋白质总量。
1123、编号的实施方案69.根据编号的实施方案64-68中任一项所述的热处理的、优选地热灭菌的饮料,包含这样的量的根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物,所述量足以贡献热处理的饮料的总蛋白质的至少30%w/w、更优选地总蛋白质的至少50%w/w、甚至更优选地总蛋白质的至少70%w/w并且最优选地总蛋白质的至少80%w/w。
1124、编号的实施方案70.根据编号的实施方案64-69中任一项所述的热处理的、优选地热灭菌的饮料,包含这样的量的根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物,所述量足以贡献热处理的饮料的总蛋白质的至少90%w/w、更优选地总蛋白质的至少95%w/w、甚至更优选地总蛋白质的至少99%w/w并且最优选地总蛋白质的100%w/w。
1125、编号的实施方案71.根据编号的实施方案64-70中任一项所述的热处理的、优选地热灭菌的饮料,包含相对于总固体的至少50%w/w、更优选地相对于总固体的至少60%w/w、甚至更优选地相对于总固体的至少70%w/w并且最优选地相对于总固体的至少80%w/w的量的总蛋白质。
1126、编号的实施方案72.根据编号的实施方案64-71中任一项所述的热处理的、优选地热灭菌的饮料,包含相对于总固体的至少80%w/w、更优选地相对于总固体的至少90%w/w、甚至更优选地相对于总固体的至少92%w/w并且最优选地相对于总固体的至少94%w/w的量的总蛋白质。
1127、编号的实施方案73.根据编号的实施方案64-72中任一项所述的热处理的、优选地热灭菌的饮料,具有0.5%w/w-50%w/w、更优选地1%w/w-35%w/w、甚至更优选地2%w/w-20%w/w并且最优选地3%w/w-10%w/w的固体含量。
1128、编号的实施方案74.根据编号的实施方案63-73中任一项所述的食品产品,其根据编号的实施方案60-62中一项或更多项所述的工艺可获得。
1129、编号的实施方案75.一种食品成分,包含:
1130、-根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物的固体,以及
1131、-一种或更多种另外的成分,其优选地选自:
1132、-乳品成分,优选地未氧化的乳品成分,
1133、-基于植物的成分,
1134、-非乳品碳水化合物来源,
1135、-调味剂,和/或
1136、-甜味剂(甜碳水化合物/多元醇/his)。
1137、编号的实施方案76.根据编号的实施方案75所述的食品成分,其中一种或更多种另外的成分包含乳品成分,该乳品成分包含胶束酪蛋白、未氧化的乳清蛋白、酪蛋白巨肽、乳或乳清的超滤渗透物、变性乳清蛋白及其组合中的一种或更多种。
1138、编号的实施方案77.根据编号的实施方案75或76所述的食品成分,其中一种或更多种另外的成分包含基于植物的成分,该基于植物的成分优选地包含大豆蛋白、豌豆蛋白、基于植物的膳食纤维及其组合中的一种或更多种。
1139、编号的实施方案78.根据编号的实施方案75-77中任一项所述的食品成分,其中一种或更多种另外的成分包含非乳品碳水化合物来源,该非乳品碳水化合物来源优选地包含蔗糖、麦芽糊精、非乳品低聚糖、非乳品多糖中的一种或更多种。
1140、编号的实施方案79.根据编号的实施方案75-78中任一项所述的食品成分,其中一种或更多种另外的成分包含甜味剂,该甜味剂优选地包含碳水化合物甜味剂、多元醇、高强度甜味剂及其组合中的一种或更多种。
1141、编号的实施方案80.根据编号的实施方案75-79中任一项所述的食品成分,其中根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物的固体贡献食品成分的重量的0.5%w/w-95%w/w、更优选地食品成分的重量的1%w/w-90%w/w、甚至更优选地食品成分的重量的5%w/w-85%w/w并且最优选地食品成分的重量的10%w/w-80%w/w。
1142、在本发明的上下文中,术语“氧化的乳清蛋白组合物的固体”涉及如果从氧化的乳清蛋白组合物中去除所有的水,则残留的固体物质(包括蛋白质、碳水化合物、脂质和矿物质)。“氧化的乳清蛋白组合物的固体”可以例如由呈粉末形式或呈液体形式的氧化的乳清蛋白组合物提供。
1143、编号的实施方案81.根据编号的实施方案75-80中任一项所述的食品成分,其中根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物的固体贡献食品成分的重量的0.5%w/w-60%w/w、更优选地食品成分的重量的1%w/w-50%w/w、甚至更优选地食品成分的重量的5%w/w-40%w/w并且最优选地食品成分的重量的10%w/w-30%w/w。
1144、编号的实施方案82.根据编号的实施方案75-81中任一项所述的食品成分,其中根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物的固体贡献食品成分的蛋白质的0.5%w/w-95%w/w、更优选地食品成分的蛋白质的1%w/w-90%w/w、甚至更优选地食品成分的蛋白质的5%w/w-85%w/w并且最优选地食品成分的蛋白质的10%w/w-80%w/w。
1145、编号的实施方案83.根据编号的实施方案75-82中任一项所述的食品成分,其中根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物的固体贡献食品成分的蛋白质的0.5%w/w-60%w/w、更优选地食品成分的蛋白质的1%w/w-50%w/w、甚至更优选地食品成分的蛋白质的5%w/w-40%w/w并且最优选地食品成分的蛋白质的10%w/w-30%w/w。
1146、编号的实施方案84.根据编号的实施方案75-83中任一项所述的食品成分,包含至多15μmol/g蛋白质、更优选地至多14μmol/g蛋白质、甚至更优选地至多13μmol/g蛋白质并且最优选地至多12μmol/g蛋白质的量的游离硫醇基团。
1147、编号的实施方案85.根据编号的实施方案75-84中任一项所述的食品成分,包含0.001-15μmol/g蛋白质、更优选地0.01-14μmol/g蛋白质、甚至更优选地0.01-13μmol/g蛋白质并且最优选地0.01-12μmol/g蛋白质的量的游离硫醇基团。
1148、编号的实施方案86.根据编号的实施方案75-85中任一项所述的食品成分,包含至多10μmol/g蛋白质、更优选地至多8μmol/g蛋白质、更优选地至多5μmol/g蛋白质、甚至更优选地至多3μmol/g蛋白质并且最优选地至多2μmol/g蛋白质的量的游离硫醇基团。
1149、编号的实施方案87.根据编号的实施方案75-86中任一项所述的食品成分,包含0.01-10μmol/g蛋白质、更优选地0.01-8μmol/g蛋白质、更优选地0.01-5μmol/g蛋白质、甚至更优选地0.01-3μmol/g蛋白质并且最优选地0.01-2μmol/g蛋白质的量的游离硫醇基团。
1150、编号的实施方案88.根据编号的实施方案75-87中任一项所述的食品成分,呈液体的形式,优选地使用水作为主要溶剂并且更优选地使用水作为唯一溶剂。
1151、编号的实施方案89.根据编号的实施方案75-87中任一项所述的食品成分,呈粉末的形式,优选地包含至多6%w/w的量的水。
1152、编号的实施方案90.根据编号的实施方案89所述的食品成分,其中所述粉末通过将呈粉末的形式的根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物与呈粉末形式的一种或更多种另外的成分干燥共混来制备。
1153、编号的实施方案91.根据编号的实施方案89所述的食品成分,其中所述粉末通过优选地通过喷雾干燥来干燥根据编号的实施方案88所述的液体来制备。
1154、编号的实施方案100.氧化的乳清蛋白组合物、优选地根据编号的实施方案56-58中一项或更多项所述的氧化的乳清蛋白组合物作为食品成分的用途,优选地用于改进气味和/或降低类似于热灭菌的饮料的臭鸡蛋气味的令人不愉快的气味,饮料具有在5.5-8.5的范围内的ph,优选地具有至少3%w/w的乳清蛋白含量,并且优选地使用间接热处理进行热灭菌。
1155、上文已经参考具体实施方案描述了本发明。然而,在本发明的范围内,除了上文描述的实施方案之外的其他实施方案同样是可能的。除非另外陈述,否则本发明的多种实施方案和方面的不同特征和步骤可以以除了本文描述的方式之外的其他方式组合。
1156、实施例
1157、分析方法
1158、分析a:总蛋白质
1159、样品的总蛋白质含量(真蛋白质)通过以下来确定:
1160、1)按照iso 8968-1/2|idf 020-1/2-乳-氮含量的测定-第1/2部分:使用凯氏定氮法测定氮含量(iso 8968-1/2|idf 020-1/2-milk-determination of nitrogen content-part 1/2:determination of nitrogen content using the kjeldahl method)来确定样品的总氮。
1161、2)根据iso 8968-4|idf 020-4-乳-氮含量的测定-第4部分:非蛋白氮含量的测定(iso 8968-4|idf 020-4-milk-determination of nitrogen content-part 4:determination of non-protein-nitrogen content)来确定样品的非蛋白氮。
1162、3)将蛋白质的总量计算为(m总氮-m非蛋白氮)*6.38。
1163、分析b:ph
1164、使用ph玻璃电极测量所有ph值,并相对于25℃被归一化。
1165、ph玻璃电极(具有温度补偿)在使用之前仔细冲洗并在使用之前校准。
1166、当样品呈液体形式时,则直接在液体溶液中测量ph,并相对于25℃被归一化。
1167、当样品是粉末时,在室温将10克的粉末溶解在90ml的脱矿质水中,同时剧烈地搅拌。然后测量溶液的ph,并相对于25℃被归一化。
1168、分析c:粘度
1169、粘度由gilson在22℃使用vischman进行估算,并在约300s-1的剪切速率进行报告。
1170、分析d:使用h2s传感器对h2s的定量
1171、h2s的水平通过微传感器(sulf-nplr,needle type,unisense a/s,denmark)来测量,该微传感器被连接到单通道放大器(monometter-9514,unisense a/s,denmark)。所获得的h2s信号显示为毫伏,该h2s信号可以用作样品中h2s水平的指标,并记录在由unisensea/s提供的软件“logger”中。在使用之前的每一天校准微传感器,并且使用由制造商(calkit-h2s,unisense a/s,denmark)提供的h2s校准试剂盒。根据手册(2020年11月版,unisense a/s)第7节,校准试剂盒中最高浓度的h2s被进一步稀释10倍。h2s的浓度可以通过软件以μm为单位自动转换。
1172、为了测量来自模拟的uht或中试规模的uht的样品,将样品在20℃平衡持续30分钟,并且将传感器针刺穿穿过硅密封件并进入样品的液相中。对每个样品进行一式三份。
1173、分析e:游离硫醇基团和总硫醇基团
1174、使用由kurz等人(2020)描述的方法,使用与作者使用的设备相同的设备,对乳清蛋白样品中游离硫醇基团和总硫醇基团的含量进行定量。样品中的游离硫醇(sh)含量通常以微摩尔每克蛋白质计报告,其中蛋白质含量通过分析a的总蛋白质方法测定。
1175、kurz,f.,hengst,c.,&kulozik,u.(2020).rp-hplc method for simultaneousquantification of free and total thiol groups in native and heat aggregatedwhey proteins.methodsx,101112。
1176、分析f1:氨基酸的定量
1177、氨基酸通过由以下描述的方法来定量:
1178、zainudin mam,poojary mm,jongberg s,lund mn.light exposure acceleratesoxidative protein polymerization in beef stored in high oxygenatmosphere.food chem.299(2019)125132。
1179、将所有材料在制备之后立即冷冻至-80℃,在干冰上运输,并再次保持在-80℃直到进行分析。
1180、0.5mg蛋白质在pico-tag水解小瓶中使用脱气的4m甲磺酸(具有0.2%w/v色胺)在真空中在110℃水解持续17h 30min。
1181、将中和的干水解产物与氨基己酸(内标)混合,并用邻苯二甲醛/3-巯基丙酸和芴基甲氧基羰基氯衍生化。使用配备有agilent advancebio aaa柱的uhplc-fld系统分析衍生化的氨基酸。每种氨基酸的定量(内标校准)基于使用真实标准构建的八点校准曲线进行。
1182、分析f2:氨基酸氧化的定量
1183、蛋白质氧化产物通过由以下描述的方法来确定:
1184、mahesha m.poojary,brijesh k.tiwari,marianne n.lund,selective andsensitive uhplc-esi-orbitrap ms method to quantify protein oxidation markers,talanta第234卷(2021),122700。
1185、通过分析分析的所有样品在制备之后立即冷冻至-80℃,在干冰上运输,并再次保持在-80℃直到进行分析。
1186、0.5mg蛋白质在pico tag水解小瓶中使用脱气的4m甲磺酸(具有0.2%w/v色胺)在真空中在110℃水解持续17h 30min。
1187、将中和的干水解产物与5-甲基色氨酸(内标)混合,并使用配备有waters aquityhss t3柱的uhplc-fld系统进行分析。
1188、每种氨基酸的定量(内标校准)基于使用真实标准构建的八点校准曲线进行。
1189、分析g:通过gpc分析来测定氧化后的分子量和特性粘度
1190、使用sec-mals-iv-ri hplc系统通过尺寸排阻色谱法来分析乳清蛋白样品中蛋白质物质的分子量,该系统基本上由thermo iso.3100sd泵、wps-3000tsl自动进样器和refractomax 521折射率检测器组成。该系统还配备有wyatt minidawn treos ii光散射检测器和wyatt viscostar在线粘度计。
1191、将所有样品在洗脱液(10mm磷酸盐、30mm nacl ph 7.0和0.1%proclin)中稀释至1%蛋白质,并且使用biosec-5以0.75ml/min在洗脱液中分离10μl。
1192、该仪器提供完全在ala标准、blg标准和bsa标准的10%内的结果。
1193、数据分析:重均分子量和重均特性粘度使用astra软件[v7.3.2.19]通过整合在空隙体积之前洗脱的所有信号,即单体、低聚物和较大聚集体物质来确定。
1194、分析h:残余的过氧化氢的测定
1195、根据制造商的说明(abcam ab102500过氧化氢测定试剂盒(比色/荧光;版本6最后更新于2019年1月8日)使用synergy mx微板读数器,使用定量比色测定法来测定残余的过氧化氢。
1196、相对于最初添加的h2o2量,将所有样品稀释在ph 7.0的10mm磷酸盐中,以确保50μl样品中的残余h2o2浓度在测定的线性范围内,即0-5nmol h2o2/孔;使用随测定测试剂盒提供的h2o2标准品。
1197、如由制造商所描述的,使用随测定试剂盒提供的h2o2标准品来建立包含0-5nmolh2o2/孔的校准曲线。
1198、样品中h2o2的浓度由校准曲线和样品稀释度确定。
1199、分析i:乳清蛋白样品中不可还原的羊毛硫氨酸(lanthionine)和赖氨酸丙氨酸(lysinoalanine)交联的定量
1200、wpi样品中羊毛硫氨酸的量如由以下所描述来确定:
1201、mahesha m.poojary等人,“liquid chromatography quadrupole-orbitrap massspectrometry for the simultaneous analysis of advanced glycation end productsand protein-derived cross-links in food and biological matrices,”journal ofchromatography a,第1615卷,2020,并且使用来自分析f2的柱和溶剂进行修改。
1202、将通过分析i分析的所有样品在制备之后立即冷冻至-80℃,在干冰上运输,并再次保持在-80℃直到进行分析。
1203、简言之,对应于0.5mg蛋白质的样品在pico tag水解小瓶中使用脱气的6m盐酸(具有巯基乙酸)在真空中在110℃水解持续22h。
1204、将干燥的水解产物与赖氨酸-d4(内标)混合,并使用配备有waters aquity hsst3柱的lc-ms系统进行分析。lal和lan的定量(内标校准)基于使用真实标准构建的八点校准曲线进行。
1205、分析j:热处理的样品中非h2s气味的测定
1206、使用动态顶空取样方法结合使用气相色谱法分离和使用质谱法鉴定来分析乳清蛋白饮料的非h2s气味。饮料中的非h2s气味都一式三份地测量。
1207、如实施例1中描述的,使样品经历uht处理,并根据分析d来测定h2s的含量。收集来自若干个热处理的小瓶的样品,以允许将5ml样品转移到100ml蓝帽烧瓶中。添加1.5μl的100ppm 2-己酮-5-甲基内标溶液以达到30ppb的最终浓度。
1208、将吸附剂捕集器(tenax ta/石墨化碳/carboxen 1000,restek corporation)附接到瓶子,并且将饮料放置在20℃的恒温控制的水浴中,并在搅拌的同时用100ml/min氮气吹扫持续1小时。
1209、使用50ml/min氢气流将吸附剂捕集器在300℃解吸持续15min(turbomatrix atd350,perkin elmer),进入填充有tenax ta60/80(sigma-aldrich)和carbopack x(sigmaaldrich)的冷捕集器(perkin elmer)中。将解吸的挥发物在4℃聚焦持续15min,并且然后通过将捕集器的温度升高到300℃使用3:1分离,通过传输管线注射到气相色谱柱上。气相色谱仪(agilent technologies,7890agc-ms)配备有db-wax柱(30m×250μm,膜厚度0.25μm,agilent technologies)。
1210、梯度程序包括在35℃持续10分钟的等温步骤,以8℃/min斜升至240℃,随后是5min的等温步骤。gc被连接到单四极杆质谱仪(5975c agilent technologies)。ms传输管线温度为250℃,并且离子源温度为200℃。质谱仪在20-400的质荷比(m/z)范围内扫描,并且使用70ev的分段电压(fragmentation voltage)获得光谱。
1211、ms数据库(nist ms search版本2.0)用于鉴定挥发性化合物。此外,所有化合物通过质谱数据和保留时间与真实参考化合物的比较来验证。使用内标2-己酮-5-甲基的浓度和峰面积,使用半定量方法来计算鉴定的挥发性化合物的量。
1212、分析k:uht处理的乳清蛋白分离物的感官评估
1213、uht处理的饮料的感官分析在奥尔胡斯大学食品科学系(department of foodscience at aarhus university)进行。
1214、在最后的品尝/嗅觉环节之前,制作属性列表。属性以15cm量表进行评级,其中0=低强度,并且15=高强度。
1215、气味评估:
1216、由于产品的气味化合物的挥发性,样品装在原装瓶中。小组成员必须自己打开瓶子,并评估气味。对于每个小组成员和每个不同的重复,使用新的瓶子。
1217、风味和口感评估:
1218、通过排除正鼻气味效应来评估饮料的风味。在这项工作中,样品保持打开持续一小时,以确保在评估期间存在尽可能少的挥发物。此外,将样品呈现在带吸管的小塑料杯中。这样,小组成员在品尝时就不会直接闻到样品的味道。此外,小组成员使用痰盂/吐杯对样品进行该风味评估。
1219、在‘panelcheck’软件中使用3因素anova检验对30多个重复进行统计学分析。样品被固定,并且小组被设置为随机。
1220、使用暗示最小显著差异值(与字母相关的组的成对比较)的邓肯测试(使用的软件:xlstat)来评估样品之间的显著差异。
1221、分析l:通过rp-hplc分析来定量天然blg/ala/cmp
1222、通过在mq水中稀释至2%蛋白质来制备蛋白质样品/蛋白质粉末。溶液通过0.22μm过滤器过滤以去除蛋白质团聚体。对于每个样品,将相同体积装载到带有uplc柱(蛋白质beh c4;1.7μm;150×2.1mm)的uplc系统(acquity uplc h-class,waters)上并在214nm处检测到。
1223、使用以下条件运行样品:
1224、缓冲液a:milli-q水,0.1%w/w tfa
1225、缓冲液b:hplc级乙腈,0.1%w/w tfa
1226、流量:0.4ml/min
1227、梯度:0-6.00分钟24-45%b;6.00-6.50分钟45-90%b;6.50-7.00分钟90%b;7.00-7.50分钟90-24%b和7.50-10.00分钟24%b。
1228、blg/ala/cmp峰的面积用于使用采用纯blg/ala/cmp蛋白标准(blg sigma l0130)制备的标准曲线来定量blg/ala/cmp蛋白的量。
1229、将样品进一步稀释,并且如果超出线性范围,则重新注射。
1230、分析m:总固体的定量
1231、溶液的总固体可以根据nmkl 110第2版,2005(重量法测定乳和乳制品中的总固体(水)(total solids(water)—gravimetric determination in milk and milkproducts))来测定。nmkl是"nordisk metodikkomite for”的缩写。
1232、溶液的水含量可以被计算为100%减去总固体的相对量(%w/w)。
1233、分析n:脂肪含量的定量
1234、脂质的量根据iso 1211:2010(脂肪含量测定-重量法(determination of fat content-gravimetric method))来测定。
1235、分析o:乳糖含量的定量
1236、乳糖的总量根据iso 5765-2:2002(idf 79-2:2002)“干奶、干冰混合物和加工干酪-乳糖含量的测定-第2部分:利用乳糖的半乳糖部分的酶法(dried milk,dried ice-mixes and processed cheese-determination of lactose content-part 2:enzymaticmethod utilizing the galactose moiety of the lactose)”来测定。
1237、分析p:矿物质组成的特征
1238、钙、镁、钠、钾和磷的总量使用一程序来测定,在该程序中,样品首先使用微波消解来分解,并且然后使用icp设备来测定矿物质的总量。
1239、设备
1240、微波炉来自anton paar,并且icp是来自perkinelmer inc.的optima 2000dv。
1241、材料:
1242、1m hno3
1243、在2% hno3中的钇
1244、用于5% hno3中的钙、镁、钠、钾和磷的合适的标准品
1245、预处理:
1246、称出0.2克的粉末样品或1g的液体样品,并将粉末转移到微波消解管中。添加5ml1m hno3。根据微波炉说明在微波炉中消解样品。将经消解的管放入通风柜中,取下盖子并使挥发性烟雾蒸发。
1247、测量程序:
1248、使用已知量的milli-q水将预处理的样品转移到digitube。向消解管中添加在2%hno3中钇的溶液(每50ml稀释样品约0.25ml),并使用milli-q水稀释至已知体积。使用由制造商描述的程序在icp上分析样品。
1249、通过使用milli-q水将10ml 1m hno3和0.5ml的在2% hno3中钇的溶液的混合物稀释至100ml的最终体积来制备盲样品。
1250、制备至少3个标准样品,其具有包含预期的样品浓度的浓度。
1251、液体样品中对于ca、na、k和磷的检测限为0.005g/100g样品,并且对于mg的检测限为0.0005g/100g样品。粉末样品中对于ca、na、k和磷的检测限为0.025g/100g样品,并且对于mg的检测限为0.0005g/100g样品。
1252、分析q:浊度的测定
1253、浑浊是由大量通常肉眼不可见的颗粒引起的流体的混浊或模糊,类似于空气中的烟雾。
1254、浊度以比浊法浊度单位(ntu)测量。
1255、将20ml饮料/样品添加到ntu玻璃中,并放置在3000ir浊度计中。在稳定之后测量ntu值并重复两次。
1256、实施例1:在ph 8.0和低温时的温和硫醇氧化
1257、在该实验中,本发明人记录了最初的发现,并证明了通过在ph 8.0时乳清蛋白的游离硫醇的温和、低温氧化来减少或去除类似于ph中性的uht处理的乳清蛋白饮料的臭鸡蛋气味的令人不愉快的气味的可行性。
1258、在本实施例和以下的实施例中,提到“令人不愉快的气味”意指类似于臭鸡蛋气味的令人不愉快的气味。
1259、材料与方法:
1260、分别包含基于粉末wpi-a(99.6%天然blg)和wpi-b(50% blg)的10%w/w蛋白质或6%w/w蛋白质的溶液通过将粉末与超纯水(18.2mohm)混合并随后允许混合物在约20℃在温和搅拌下水合持续1小时来制备,之后本发明人观察到没有剩余的粉末颗粒,并且溶液变得透明。研究中使用的粉末的特性在表1中描述。
1261、表1示例性乳清蛋白分离物的组成(blg=β-乳球蛋白;sh=游离硫醇;bdl=低于检测限;ts=总固体)
1262、
1263、
1264、在20℃,使用3m naoh和带有螺旋帽盖的20mlduran gl 18试剂玻璃杯中的15ml样品将乳清蛋白溶液的ph调节并测量至8.0,其中保留等分试样用于参考目的。将试剂玻璃杯中的wpi样品在水浴中热平衡至10℃、25℃、40℃、50℃或60℃。基于具有1.11g/ml的密度和34.01g/mol的分子量的30%w:w h2o2溶液的9.79m的摩尔浓度、和从分析l可获得的blg的摩尔浓度以及18.4kda的blg的分子量,将过氧化氢(h2o2)添加到如表2中描述的5:1或8:1摩尔比的h2o2:blg中。产生了调节至ph 6.5并在存在8:1 h2o2:blg的情况下在10℃和25℃孵育的类似的6%wpi-b样品组。
1265、blg通常构成乳清蛋白的蛋白质的约50%或更多,并且还是乳清蛋白的游离硫醇的主要来源(blg包含每个分子一个游离硫醇基团)。因此,乳清蛋白组合物中天然blg的摩尔浓度很好地近似于乳清蛋白组合物的游离硫醇基团的摩尔含量。因此,选择相对于乳清蛋白组合物的天然blg的含量的氧化剂的剂量是有意义的。
1266、表2提供了在孵育持续18小时开始时的反应条件的概述,之后获取样品用于分析残余的h2o2(根据分析h),随后添加过氧化氢酶(每150l液体产物3.65ml catazyme 25l),以通过h2o2的歧化来阻止wpi样品的进一步h2o2氧化。
1267、分别根据分析e和分析g,通过gpc-mals来分析蛋白质中残余的游离硫醇基团和由于处理而引起的氧化的乳清蛋白组合物的潜在聚集。
1268、uht-模拟:
1269、为了评估氧化处理对产生令人不愉快的气味的影响,使样品经历如下文描述的类似uht的处理:
1270、将样品的ph调节至7.0,并稀释至6%蛋白质。将1.0ml的氧化的乳清蛋白溶液转移到2ml gc小瓶(mikrolab no ml 33003vu)中,并使用铝盖(mikrolab ml 33032)和电子压接器(thermo scientific crma60180-ecrh11ki)压接密封。目视检查样品是否有模糊的迹象并进行监测,同时作为用于指示流动性质的第一探针进行倒置。
1271、将密封的小瓶(在室温)转移到mikrolab超高温系统(控制单元ml 306228和加热单元ml3062409,mikrolab a/s,denmark)的铝加热块,该铝加热块具有由制造商钻的孔以匹配2ml gc小瓶的小瓶尺寸。将该块预加热至160℃,并将样品保持在该块中持续160秒。温度在约40秒内达到100℃,在65秒内达到约120℃,并且在孵育100秒之后达到140℃,并且在160秒之后达到150℃。在加热块中孵育之后,将样品转移到冰水浴中,以快速猝灭导致产生令人不愉快的气味的反应。根据分析d,在密封的小瓶中直接测量h2s。
1272、本发明人已经示出通过将样品在铝块中在160℃孵育持续160秒的uht模拟,以接近地模拟了使用采用板式热交换器间接加热在143℃持续4秒的传统uht处理。本发明人还已经发现,在160℃持续160秒的铝块导致如通过h2s的含量所确定的与在143℃持续4秒的间接uht处理等量的令人不愉快的气味。
1273、本发明人通过在模拟的uht处理之后24小时对来自样品的感官评估来对令人不愉快的硫酸气味/腐烂气味的感知进行排序。在评估之前立即将小瓶去帽,并以从0-15的评分来评估“令人不愉快的硫酸气味”,其中0是水的低强度,并且15对应于根据分析d制备的10μm h2s标准品的高强度。
1274、表2改性的wpi的样品的详细工艺。
1275、 蛋白质来源 wpi-a wpi-b 总蛋白质浓度 10% 6% 孵育温度,℃ 10,25,40 10,25,40,50或60 在20℃时的ph 8.0 8.0 h2o2∶blg摩尔比 5∶1 8∶1 氧化的持续时间,小时 18小时 18小时
1276、结果:
1277、本发明人已经研究了在中性ph经历苛刻热处理(诸如在143℃处理持续2-16秒)的乳清蛋白分离物(wpi)中令人不愉快的气味的产生,并且通过使用h2s选择性电极令人惊讶地发现在这样的乳清蛋白分离物饮料组合物中产生的强烈的硫酸异味主要由硫化氢组成,硫化氢可能源自半胱氨酸到硫化氢和脱氢丙氨酸的β-消除。事实上,本发明人通过使用气相色谱法/质谱发和气相色谱法/火焰光度检测证实了令人不愉快的气味主要由h2s组成。
1278、如表3中示出的,本发明人令人惊讶地发现允许乳清蛋白分离物氧化的某些条件,并且他们发现在该过程中过氧化氢的消耗和残余硫醇的减少与所产生的类似于uht处理的样品中臭鸡蛋气味的令人不愉快的气味的产生的减少之间的直接关系。
1279、本发明人特别惊讶地发现,有必要将示例性的wpi样品(表2中的wpi-a和wpi-b)加热到高于环境温度诸如40℃,以允许游离硫醇和过氧化氢之间的反应进行,即使在8.0的升高的ph孵育持续长达至少18小时时。事实上,本发明人观察到在10℃或25℃、ph 6.5与8:1h2o2:blg一起孵育的6%wpi wpi-b样品的游离硫醇含量没有减少,并且在其中需要低温来阻止微生物生长的典型工业工艺条件下,硫醇的氧化因此不能预期有效地发生。
1280、在uht处理的未氧化的样品wpi-a1中检测到强烈的h2s气味,并且本发明人发现类似于臭鸡蛋的强烈感知的气味(感官评分为10)还与92mv的高测量电极电位相关联。
1281、相比之下,在40℃、ph 8.0用5:1 h2o2:blg经历处理的样品wpi-a4导致添加的h2o2的93%消耗,导致游离硫醇的81%减少。在uht模拟之后,氧化显著地将令人不愉快的气味降低到4的评分,发现这与未加热的6% wpi-a样品的水平相似。在uht模拟之后,样品wpi-a4还具有仅9mv的h2s电极电位,这证实了h2s的产生的显著减少,并且因此令人不愉快的气味的显著减少。对于在10℃-25℃处理的样品(分别为样品wpi-a2和wpi-a3),未测量或评估令人不愉快的气味。然而,基于h2o2的消耗和伴随的残余游离硫醇的减少,本发明人发现使用更高的温度是优选的以获得更有效的硫醇消除,并且从而在uht处理之后减少h2s。
1282、对于在10℃至60℃在8:1 h2o2:blg摩尔比的情况下暴露于氧化剂的wpi-b样品(分别为样品wpi-b2至wpi-b6),观察到相同的模式。未氧化的样品产生了类似于臭鸡蛋气味的强烈的令人不愉快的气味(感官评分为9),如还通过发现相当于10.4μm的浓度的214mv高电极电位所证明的。当孵育温度从10℃逐渐升高到60℃时(wpi-b2到wpi-b6,参见表3),所感知的令人不愉快的气味降低到4的评分,并且发现与样品wpi-b4到wpi-b5中未加热的6% wpi-b相当。同样地,这些样品具有较低水平的测量的h2s。与基于wpi-a的样品类似,从基于wpi-b的样品还观察到消耗的h2o2、残余硫醇和来自随后uht处理的令人不愉快的气味之间的关系。
1283、除了使用高温的要求之外,本发明人惊讶地发现,有效的氧化,诸如在样品wpi-b4到wpi-b6中观察到的氧化,还导致蛋白质的聚集,如通过重均分子量(mw)随着温度从40℃升高到60℃而从75kda增加到5590kda(对应于约从约4至约300blg分子的mw)所示出的,参见表3。通过在样品的转化期间的轻微雾度和粘稠行为,可目视检测到样品wpi-b6中蛋白质的高分子量。
1284、本发明人还观察到,在较低温度处理的样品wpi-b2(29.3kda)和wpi-b3(44.1kda)中没有聚集或很少明显的聚集,这清楚地支持对一定水平的蛋白质解折叠以允许氧化过程进行的需求。在完成充分的解折叠(诸如wpi-a4和wpi-b4)后,氧化可以以最小的聚集进行,而增加的解折叠导致增加的聚集或过度的聚集(例如wpi-b5和wpi-b6)。
1285、本发明人在此处已经证明,可以通过在宽范围的乳清蛋白分离物组合物中氧化wpi制品来减少和消除令人不愉快的气味,乳清蛋白分离物组合物具有在相对于总蛋白质的从约100%至约50%的范围内的blg含量,总蛋白质分别由样品wpi-a4、wpi-b4至wpi-b6所例示,参见表3。
1286、表3在用h2o2处理期间温度对游离硫醇氧化的影响以及在uht处理期间和之后令人不愉快的气味的产生。
1287、
1288、
1289、结论:
1290、本发明人已经发现,在允许游离硫醇显著减少的条件下对先前经历氧化的样品的uht处理示出类似于臭鸡蛋气味的降低的水平的令人不愉快的气味。
1291、在通过6%乳清蛋白饮料组合物中10μmol sh/g蛋白质的游离硫醇含量表征的样品中感知到显著降低的水平的令人不愉快的气味,并且通过感官测试,小于或等于5.0μmolh2s的令人不愉快的气味水平相对于未氧化的参考被感知为显著降低,并且通过感官测试几乎没有感知到或根本没有感知到低于2μmol h2s的令人不愉快的气味水平。
1292、本发明人已经证明,在乳清蛋白中并且特别是在blg中游离硫醇的氧化可以在受控条件下减少,该blg是乳清蛋白中游离硫醇基团的主要来源。
1293、本发明人还已经发现,特定ph范围和温度范围的组合对于乳清蛋白的游离硫醇的有效氧化是有益的。
1294、实施例2a:研究氧化剂的使用水平的影响
1295、在这些实施例中描述的实验中,本发明人研究了在40℃的孵育温度和20小时的孵育期的持续时间使用的氧化剂的量的影响。
1296、方法:
1297、如实施例1中概述的,由wpi-b制备包含43.2g/l blg(约2.35mm)的8.6% wpi溶液ph 8.0(20℃),除了通过添加30% h2o2随后混合将施用的h2o2从0:1摩尔比变化到178:1摩尔比(h2o2:blg)。将所有溶液在40℃孵育持续20小时
1298、在孵育之后,根据分析h来测量残余的h2o2。
1299、为了进一步分析并避免后续加工步骤中的过度氧化,向样品中添加过氧化氢酶(每150l液体乳清蛋白产物3.65ml catazyme 25l)以消除残余的h2o2。根据分析e来测量残余的游离硫醇。
1300、测量由氧化引起的单独的氨基酸的损失,并根据分析f1和分析f2来评估氧化的乳清蛋白样品中氨基酸的存在。
1301、在如实施例1中描述的热处理(使用160℃的铝块持续160秒)之后,评估h2s相关气味的产生。在h2s分析之前,所有样品在室温储存持续24h。
1302、在氧化的样品的uht处理和使用配备有去帽钳口的电子压接器(thermoscientific crma60180-ecrh11ki)对小瓶去帽之后,通过分析i来评估由经由β-消除将半胱氨酸转化为脱氢丙氨酸并与赖氨酸残基或半胱氨酸残基进一步反应引起的非天然交联水平。
1303、如实施例1中所描述的,对令人不愉快的气味的感知进行评估。
1304、结果
1305、如表4中看到的,本发明人发现残余的h2o2的量随着增加的剂量而增加,并且相对于最初添加的量的残余过氧化物的分数在高于10:1的化学计量(样品wpi-b16)时急剧增加,其中在40℃的恒温和17:1至178:1的摩尔比(样品wpi-b18至wpi-b21)孵育持续20小时之后,最初添加的h2o2的多达29%-49%剩余。
1306、还发现游离硫醇基本上经由氧化步骤被耗尽,如通过在8:1的h2o2:blg摩尔比(样品wpi-b15)及以上(样品wpi-b16至wpi-b21)时大约2.2μmol sh/g蛋白质或更少所证明的,表明有效消除了导致产生类似臭鸡蛋气味的令人不愉快的气味的残余物。
1307、然而,本发明人发现,即使降低到7.5μmol sh/g蛋白质(其被发现在模拟的uht处理之后在样品wpi-b12中导致1.35μm h2s)被认为类似于6%未加热的、未氧化的wpi-b参考,其中在从0-15的评分内评分为4。对产生高水平的h2s的未氧化的6% wpi-b9样品进行排序,其中评分为9。
1308、值得注意的是,样品wpi-b12至wpi-b21证明,至多10μmol/g蛋白质的游离硫醇基团的含量在模拟的uht之后导致至多约5μm h2s,这导致令人不愉快的气味水平,该令人不愉快的气味水平相对于热处理的参考wpi-b9显著降低,但水平类似于6%未加热的、未氧化的wpi-b参考。
1309、表4确定在40℃的恒定低温孵育期间氧化剂的最小足够量。<lod=低于检测水平;n.d.=未确定
1310、
1311、
1312、结论:
1313、本发明人已经发现,在乳清蛋白饮料的uht处理期间和之后,需要一定水平的氧化来充分消除游离硫醇,以获得类似于臭鸡蛋气味的令人不愉快的气味的产生和感知的显著减少。本发明人发现,通过分析和如所感知的气味两者评估的降低的水平的令人不愉快的气味始终与约10μmol sh/g蛋白质或更少的残余游离硫醇含量相关联,导致约5μm或更少的h2s。
1314、实施例2b.研究氧化损坏
1315、本发明人已经观察到,在现有技术(参见us2016/0235082a1)中用于饮料生产的乳清蛋白氧化工艺导致饮料的差的视觉品质,特别是导致混浊和/或黄色的产生。
1316、本发明人推测,这些不期望的特征是在存在高浓度的氧化剂的情况下苛刻热处理诸如uht的结果。
1317、方法:
1318、通过将wpi-b粉末与milliq水混合来制备13.5%w/w wpi溶液,使用5% hcl将ph调节至6.5,随后在mq水中稀释以达到13%w/w的最终蛋白质浓度。根据分析l来测量65g/l(大约3.54mm)的blg含量。保留13% wpi-b ph 6.5样品的等分试样用于参考目的。
1319、将30%过氧化氢(h2o2)以对应于0:1-174:1 h2o2:blg的摩尔比(参见表5)的变化量混合到wpi溶液中。
1320、使13% wpi样品的1.0ml等分试样经历如实施例1中描述的uht模拟(使用铝块在160℃持续160秒)。在冷却之后,目视检查小瓶,去帽,并使用分析h来测定残余的未反应的h2o2。使用分析e来测量残余硫醇。测定工艺中单独的氨基酸的损失,并分别根据分析f1和分析f2来评估氨基酸氧化产物的存在。在氧化的样品的uht处理之后,根据分析i来评估由经由β-消除将半胱氨酸转化为脱氢丙氨酸并与半胱氨酸残基进一步反应引起的非天然羊毛硫氨酸交联的水平。
1321、结果:
1322、实验的结果总结在表5中,并且样品wpi-b22至wpi-b30的照片还在图1中示出。
1323、本发明人在大多数样品中观察到不透明的产生,并且还注意到在用高水平的h2o2经历uht处理的样品中,特别是样品wpi-b26、wpi-b27、wpi-b29和wpi-b30中黄色的产生。这表明过量的h2o2剂量与uht处理组合导致不期望的和过量的氨基酸氧化,导致例如这样的颜色变化。
1324、另外,本发明人发现,在13% wpi-b(wpi-b29)的uht处理期间85:1 h2o2:blg的存在引起色氨酸残基的显著和不期望的损失,并且进一步引起来自酪氨酸残基和色氨酸残基两者的氧化产物的产生,参见表7。本发明人已经看到黄色是由检测到的色氨酸氧化产物二氧吲哚基丙氨酸(dioia)和犬尿氨酸(kyn)引起的迹象。
1325、此外,将酪氨酸氧化成氧化的酪氨酸(o-tyr)和二酪氨酸(di-tyr)被认为是过度氧化的指标。
1326、与样品wpi-b29相比,表7示出了在40℃以8:1摩尔比(h2o2:blg)进行更温和的氧化步骤以及随后通过过氧化氢酶歧化过量氧化剂之后,wpi-b15(实施例2a)的酪氨酸残基或色氨酸残基没有显著变化。在样品wpi-b22(未加工的wpi-b)或wpi-b9(未添加h2o2)中未观察到酪氨酸(例如di-tyr和o-tyr)或色氨酸(例如犬尿氨酸和dioia-2)的氧化产物。
1327、与wpi-b9(未氧化)和wpi-b29(在存在h2o2的情况下的uht)两者相比,wpi-b15在uht处理之后还示出显著较低水平的羊毛硫氨酸。这些值令人惊讶地接近未改性的、未加热的wpi-b的水平(表7)。这清楚地表明,氧化过程减少了蛋白质降解产物的形成,否则导致非天然羊毛硫氨酸交联的形成。
1328、有趣的是,样品wpi-b20(40℃/20小时,89:1)没有示出酪氨酸和色氨酸的降解,这最有可能是在uht处理之前添加过氧化氢酶的结果,清楚地表明在高温时高水平的h2o2是不期望的。然而,检测到犬尿氨酸(一种色氨酸降解产物)的不期望的形成,并强调对受控的h2o2剂量的需求。
1329、表5在存在过氧化氢的情况下样品的uht处理(160℃/160秒)。
1330、
1331、表6在具有/不具有氧化步骤和uht处理的情况下来自本实施例的示例性wpi样品的概述。
1332、
1333、
1334、表7在氧化过程之后wpi样品的特性。lloq=最低定量水平。发现样品的tyr含量没有统计学上的显著差异,但是wpi-b29具有比其他氧化的wpi样品显著更高水平的tyr降解产物。
1335、
1336、结论:
1337、本发明人已经观察到,涉及在存在高水平的h2o2的情况下对wpi溶液的直接uht处理,随后装瓶的加工导致氨基酸诸如色氨酸的不期望的氧化,并且导致降解产物诸如犬尿氨酸和dioia的形成。另外,本发明人观察到在这样的溶液中不透明或黄色的形成,并且已经看到颜色形成可能与氨基酸降解产物的形成有关的迹象。
1338、相比之下并且如实施例2a中所证明的,仔细选择合适的ph和温度范围以允许blg中游离硫醇的暴露和选择性氧化,使得生产改性的乳清蛋白组合物和包含它们的饮料产品是可行的,该改性的乳清蛋白组合物和饮料产品具有减少的游离硫醇基团含量和低得多的氧化损坏水平。
1339、实施例3:ph在使得能够实现硫醇氧化中的影响
1340、在该实验中,本发明人研究了ph在使得能够实现乳清蛋白的游离硫醇的氧化中的影响。
1341、材料与方法:
1342、如实施例1中描述的,通过将粉末与软化水混合来制备溶解的wpi-b的水性样品(包含足够的wpi-b粉末以提供8.4%w/w的蛋白质含量)。分别使用10% hcl或3m naoh将样品的ph分别调节至ph 6.5、7.0、7.5、8.0和8.5。除非另外陈述,否则在添加h2o2至8:1h2o2:blg摩尔比之后,将ph调节的wpi-b样品在40℃至55℃孵育持续20小时(参见表8)。在孵育之后,使用分析h来测量残余h2o2。
1343、添加过氧化氢酶(每150l液体产物33.65ml catazyme 25l),并允许去除残余h2o2。
1344、根据分析g,通过凝胶渗透色谱法(gpc)分析样品,以估计所得到的产物的平均分子量和特性粘度。根据分析e来测量残余游离硫醇。
1345、使子样品经历实施例1中描述的类似uht的热处理(使用温度为160℃的铝块持续160秒),并根据分析d来测定h2s的含量。
1346、如实施例1中所描述的,评估所感知的令人不愉快的气味。
1347、结果:
1348、表8证明了对特定的温度/ph组合来使得能够实现游离硫醇的氧化的需求。
1349、在40℃在ph 8.0在没有添加的h2o2的情况下孵育的未经处理的wpi-b31和wpi-b32在uht处理之后示出21.6μmol sh/蛋白质和21.5μmol sh/蛋白质的高水平游离sh至高水平的令人不愉快的气味,如针对wpi-b31所示出的。
1350、然而,本发明人发现,提高温度逐渐增加h2o2的消耗,并且因此游离硫醇减少,并在ph 8.0时达到2.2μmol sh/g蛋白质。在uht处理期间产生的h2s水平相应降低。
1351、虽然该反应在40℃需要约8.0的ph,但本发明人还观察到,如果同时提高温度以促进蛋白质的部分解折叠,则该反应可以在低于8.0的ph值时进行,这意味着特定的ph水平需要特定的温度。
1352、事实上,发现在ph 7.0有效消除令人不愉快的气味需要至少约50℃的孵育温度,如通过样品wpi-b38所示出的,并且在ph 6.5需要至少约55℃的温度。
1353、如通过样品wpi-b35至wpi-b39所证明的,本发明人还注意到,有效氧化和消除令人不愉快的气味的结果是与对于未经处理的wpi-b原材料的22.4kda相比,改性的wpi产物的重均分子量从51kda(wpi-b35)增加到1142kda(wpi-b39)。
1354、本发明人还注意到,尽管发现由以处于或低于7.4μmol sh/g蛋白质的游离硫醇含量为特征的样品的uht处理产生的令人不愉快的气味的测量水平高于1μm-2μm h2s的测定的感官阈值,但是wpi-b35的令人不愉快的气味已经在第二天(在环境温度24小时)降低到发现与未加热的、未氧化的6% wpi-b样品相当的水平。在样品wpi-b36至wpi-b39中没有检测到令人不愉快的气味。
1355、表8 ph对游离硫醇的可及性、h2o2的消耗以及在uht处理之后所产生的异味发展的影响。
1356、
1357、结论:
1358、本发明人观察到增加的ph导致乳清蛋白的游离硫醇的增加的减少。从表8中,还明显的是,从ph 6.5到ph 7.0并且再次从ph 7.0到ph 7.5,每消耗的h2o2的量的“每g蛋白质的sh基团”的减少显著增加。在不受理论束缚的情况下,本发明人推测,增加的ph使blg的分子结构松动,并且从而使氧化剂容易接近blg的游离硫醇,并且因此增加氧化反应的特异性。
1359、本发明的方法还可以在ph 6.5实施,但将需要更长的孵育时间,优选地更高的温度(例如50℃),以通过允许氧化剂更容易接近游离硫醇的蛋白质的部分解折叠来加速该过程。
1360、本发明人还已经观察到,当在热处理期间的温度升高时,平均分子量增加的趋势。对于氧化的乳清蛋白的粉末的生产,本发明人已经发现保持聚集体尺寸尽可能低是有利的,因为这使得可以处理更高蛋白质浓度的液体流而没有粘度增加的问题。
1361、实施例4:用于运动营养品的ph中性、uht处理的乳清蛋白饮料的生产
1362、在该实施例中,本发明人证明了将该工艺放大到中试规模以用于制备即饮饮料产品的可行性,该即饮饮料产品包含在中性ph uht处理之后具有令人惊讶的低水平的令人不愉快的气味的氧化的乳清蛋白分离物。
1363、材料与方法:
1364、使用wpi-b或wpi-c类型的粉末作为原材料,在中试工厂生产在中性ph uht处理之后具有低水平的令人不愉快的气味的即饮饮料。wpi-b的粉末组成在实施例1中示出,并且wpi-c的粉末组成在表9中示出。
1365、表9示例性的乳清蛋白分离物的组成(blg=β-乳球蛋白;sh=硫醇;ala=α-乳清蛋白;cmp=酪蛋白巨肽;ts=总固体)
1366、
1367、对于中试加工,制备12kg具有6%w/w蛋白质(wpi-b或wpi-c)的溶液,随后进行30min再水合。在20℃,使用10% naoh将ph调节至8.0。随后将溶液转移到scanima混合器(spm-100v,scanima a/s,denmark),其中在温和混合的情况下将溶液的温度升高到40℃。此后,向溶液中添加35% h2o2,以获得h2o2和wpi-b或wpi-c的blg之间的8:1摩尔比。如实施例1中所描述的,将溶液保持在40℃持续18h,并在18小时孵育结束时添加过氧化氢酶以去除进入的h2o2。将溶液在室温放置持续60min,并在uht之前使用1m hcl将ph调节至7.0。使用板式热交换器(phe)(ht320-20,omve,netherlands)进行uht热处理,该板式热交换器以80l/h的厂用水(service water)流量、20l/h的产品流量操作,预加热至70℃,随后在143℃加热持续4秒。将热处理的饮料在出口处冷却到10℃,并装入100ml无菌塑料瓶中,并立即密封用于进一步分析。此外,用于h2s水平分析的样品在uht的出口处填充,其中将1ml的样品填充到2ml玻璃小瓶中,并立即用盖子卷曲密封(对于每个样品,一式三份),如实施例1中描述的。
1368、进行了若干项分析以评估该饮料。在氧化持续18h之后,根据分析e来测量样品的残余游离硫醇。在生产之后2h内分析饮料的h2s水平(分析d)。在h2s测量之前,将所有样品在室温储存。浊度通过分析q来分析。
1369、在饮料生产的同一天进行感官评估,并将100ml塑料瓶在打开之前在室温储存。打开瓶子,并由3至5人直接评估,每人两瓶。使用了0至15的评分。
1370、结果:
1371、结果清楚地示出,与未经处理的样品相比,在h2o2和blg的8:1摩尔比时氧化wpi-b或wpi-c显著减少了游离硫醇的量,如表10中所示的。此外,wpi-b37和wpi-c1两者在没有添加h2o2的情况下,uht处理导致饮料中h2s的高水平。然而,随着h2o2(样品wpi-b38和wpi-c2)的添加,在室温储存24h之后,令人不愉快的气味达到低于确定的感官阈值的水平。
1372、针对6%wpi-b饮料所观察到的低浊度和低水平的令人不愉快的气味清楚地表明,使用预处理的wpi产品以用于可口的透明的乳清蛋白饮料。
1373、表10从用过氧化氢处理的乳清蛋白分离物制备透明的uht处理的乳清蛋白分离物饮料揭示了在uht处理后游离硫醇的显著减少和h2s的产生。
1374、
1375、
1376、结论
1377、本发明人已经证明了在中试规模中成功使用氧化过程来生产透明的ph中性、uht处理的乳清蛋白饮料,而没有类似于臭鸡蛋气味的所感知的令人不愉快的气味。这样的饮料被认为对运动营养品特别有吸引力。
1378、实施例5:用于运动营养品的ph中性uht处理的乳清蛋白粉的生产
1379、在该实施例中,本发明人证明了使用实施例4中描述的条件以用于制备粉末产品工艺的可行性,该工艺包括浓缩和喷雾干燥以生产改性的乳清蛋白分离物,该改性的乳清蛋白分离物在中性ph再水合和uht处理之后产生令人惊讶的低水平的令人不愉快的气味。
1380、特别有利的是去除水:
1381、·当这样的产品待经长距离运输时(避免水的运输)
1382、·以降低在储存期间微生物生长的风险
1383、材料与方法:
1384、通过将wpi-c在水中水合持续30分钟来制备150kg的wpi-c(具有实施例4中描述的特性,表9)在10.3%或7.9%蛋白质的溶液。在将溶液加热至40℃之前,将溶液的ph调节至8(20℃)。在添加h2o2之前,使用7.5:1或13:1的摩尔h2o2:blg化学计量将加热的溶液中的ph调节至ph 7.7(在40℃测量)。
1385、在40℃孵育20小时之后,每g蛋白质添加96u过氧化氢酶(sigmac9322)以使残余h2o2失活。然后,在配备有2片koch hfk328(3838/31)膜的中试规模mms nf/ro单元上将氧化的wpi浓缩至12%蛋白质,并在10℃在平均0.9巴压差的情况下以uf模式操作。然后在spx脱水中试规模喷雾干燥器(185℃入口/85℃出口温度)上干燥uf渗余物。
1386、将产生的氧化的wpi粉末与软化水混合以提供包含5.9%蛋白质的乳清蛋白饮料(wpi-c4和wpi-c5)。使用3% hcl将溶液的ph调节至ph 7.0(20℃)。如实施例4中描述的,使wpi-c4溶液在配备有phe的omve ht320-20上在143℃经历uht持续4秒。以相同的方式由wpi-c粉末制备参考饮料(没有任何氧化预处理,wpi-c3)。
1387、wpi-c5溶液通过使用管式热交换器(the)使用uht apv/spx 5010026系统进行热处理,该uht apv/spx 5010026系统以100l/h操作并被配置用于在80℃并且然后在100℃的两个预加热步骤,随后在143℃加热持续10秒(高温、短时间(htst))。然后将饮料组合物分三步冷却到78℃、冷却到40℃并且然后冷却到10℃,并装入00ml无菌瓶中,然后立即密封。
1388、通过分析e来分析uht处理的饮料的游离硫醇基团的含量,通过分析d来分析h2s,通过分析q来分析浊度,通过分析c来分析粘度,并且通过分析k来分析感官。
1389、结果:
1390、wpi-c4饮料和wpi-c5饮料中每克蛋白质的游离硫醇水平分别降低到2.0μmol/g蛋白质和0.3μmol/g蛋白质。如表11中看到的,当与wpi-c3(未氧化的参考)相比时,wpi-c4和wpi-c5中硫醇的氧化产生具有相当粘度、略低浊度并且重要地显著降低的h2s水平的uht处理的饮料。通过感官小组,氧化的wpi-c5饮料与参考饮料(wpi-c3)相比产生减少的硫酸气味/腐烂气味,如表12中示出的。从0(低强度)到15(高强度)的评分对属性进行评级(分析k)。wpi-c5饮料的感官评分接近未加热的乳清蛋白溶液的感官评分,具有1.7的评分。
1391、表11 wpi-c4饮料和wpi-c5饮料与未氧化的参考wpi-c3饮料相比的特性。
1392、
1393、表12饮料wpi-c3和饮料wpi-c5的感官分析(分析k)。属性的不同字母(组)表明样品有显著差异。
1394、
1395、结论:
1396、证明了可以通过游离硫醇基团的特异性氧化、过量氧化剂的失活、随后通过超滤浓缩和喷雾干燥来生产粉末状的氧化的wpi-c4/wpi-c5产品。呈粉末形式的氧化的wpi-c4/wpi-c5的提供改进了产品的物流和保质期。此外,所产生的氧化的wpi-c4/wpi-c5粉末被示出在包含6% wpi-c4/wpi-c5蛋白质的uht处理的饮料中没有强烈感知的硫酸气味/腐烂气味,其甚至接近未加热的乳清蛋白溶液的感官评分。
1397、与基于未氧化的wpi的可比较uht处理的参考饮料相比,该饮料具有低粘度和更低的浊度。
1398、实施例6:在氧化期间保持ph恒定的益处
1399、在先前的研究中,本发明人注意到在氧化过程期间ph降低了多达0.5ph单位或更多。
1400、在该实施例中,本发明人证明了通过使用ph-stat来保持ph恒定以允许缩短氧化步骤期间所需的工艺时间可能是特别有利的。
1401、第1部分.通过在氧化期间重新调节ph来改进反应动力学的潜力。
1402、材料与方法:
1403、如实施例5中描述的,将150kg的wpi-c(具有实施例4中描述的特性,表9)在9%蛋白质的溶液水合、ph调节并加热,但以h2o2与blg的10:1摩尔比进行氧化。在添加h2o2之后20分钟,将两个100ml样品倒入带盖的烧杯中,并在搅拌的情况下放置在40℃的水浴中。两个样品中的一个样品在氧化期间保持ph未调节(wpi-c8),另一个样品在3小时之后将ph重新调节至ph 7.7(在40℃测量)(wpi-c7)。通过每20分钟重新调节持续5小时,将剩余的150kg溶液在ph 7.7的静态ph的情况下保持在40℃,之后随着继续氧化持续总共22小时,允许ph降低(wpi-c6)。在h2o2添加之后3小时(3h)、5小时(5h)和7小时(7h)的时间点,从每个烧杯以及从保持在静态ph的大体积中获取样品。在添加5u过氧化氢酶/ml以歧化残余h2o2之前,根据分析h来测量样品中的残余h2o2。然后根据分析e来分析所有样品的游离硫醇。
1404、结果:
1405、观察到在氧化期间ph 7.7的静态ph显著改进了反应动力学,并使其可以在仅7小时之后达到2.0μmol/g蛋白质的游离硫醇含量,而wpi-c7和wpi-c8都没有在24小时内达到该水平。在wpi-c7中3小时氧化之后ph的单次重新调节还改进了动力学。这些结果强调了ph在促进硫醇氧化中的影响。
1406、
1407、第2部分.在静态ph在氧化期间h2o2与blg比的影响
1408、材料与方法:
1409、制备wpi-c的10%蛋白质溶液,并且将ph调节至ph 8.0(20℃),并将400g的溶液分配到bioxplorer 400(hel)设备的四个反应器中的每个反应器中,该设备配有温度控制器、机械搅拌器、ph传感器和用于碱添加(7% naoh)的液体定量供应系统,并经由winbio软件控制系统进行控制。该系统被编程为将溶液加热至40℃,然后将ph调节至ph 7.7,并通过添加7% naoh溶液将ph恒定保持在ph 7.7并在40℃持续14小时。当ph和温度稳定时,根据下文方案将h2o2手动添加到反应器中。在氧化期间,以1-1.5小时的间隔获取6ml样品。根据分析h来测量样品中的残余h2o2,并且剩余部分被添加10u过氧化氢酶每ml样品。将样品调节至ph 7(20℃)并稀释至6%蛋白质。根据分析e来分析所有样品的游离硫醇。使1ml的每个样品经历实施例1中描述的类似uht的热处理(使用具有160℃的温度的铝块,持续160秒),并根据分析d来分析h2s。根据分析c来测量粘度。
1410、结果:
1411、表13实施例6的第2部分的结果的总结。在h2o2处理之前游离硫醇基团的含量为28.7μmol/g蛋白质。
1412、
1413、
1414、观察到,增加添加的h2o2的剂量减少了硫醇氧化所需的时间,并且在18:1摩尔比的剂量,如果施加静态ph,则令人不愉快的气味可以在前5小时内消除,相比之下,如果使用9:1摩尔比的h2o2:blg,则需要约8小时。
1415、结论:
1416、实验证明,将ph维持在有利的设定点允许更快的反应动力学(当与wpi-c7和wpi-c8相比时)。这可能是维持由温度/ph组合决定的部分解折叠状态的结果。
1417、实验还证明,使用更高的剂量允许更短的反应时间,并且工艺时间可以通过结合使用ph-stat和更高的h2o2:blg剂量被显著减少。例如,来自uht处理的令人不愉快的气味的产生可以通过在ph 8.0(20℃)以18:1的h2o2:blg比氧化预处理持续3小时或以9:1的h2o2:blg比氧化预处理持续5小时来消除。
1418、实施例7:乳清蛋白来源的脂肪含量的影响
1419、该实施例中描述的实验探索了脂肪含量对从挥发性有机化合物产生不期望的气味(除了上文令人不愉快的气味之外)的影响。
1420、材料与方法:
1421、表14.wpc粉末的组成。
1422、
1423、
1424、通过在室温在温和搅拌下将粉末水合持续1小时,分别由wpi-b和wpc来制备8%蛋白质溶液。将ph调节至8.0(20℃)。在添加30%过氧化氢以达到8:1摩尔化学计量之后,将两个样品在ph8.0在40℃孵育持续20小时。
1425、如实施例1中所描述使样品经历uht处理,并根据分析d来测定h2s的含量。收集来自若干个热处理的小瓶的样品,以允许将5ml样品转移到100ml蓝帽烧瓶中。添加1.5μl的100ppm 2-己酮-5-甲基内标溶液以达到30ppb的最终浓度。根据分析j对样品进行挥发性有机化合物的分析。
1426、结果:
1427、使用动态顶空气相色谱法使用质谱法来分析已经在ph 8.0和40℃用8:1 h2o2处理持续20小时的wpc饮料和wpi饮料的挥发性有机化合物的含量以用于鉴定。分析揭示,在wpc饮料的顶空中,所有检测到的有机化合物的存在要大得多。特别地,醛诸如己醛、庚醛、2-4壬二烯醛(e,e)、壬醛和苯甲醛以与wpi相比大得多的量存在。醛源自脂质的氧化,并且由于wpc包含比wpi多得多的脂质,醛也以更大的速率从wpc产生。为了避免醛挥发物的形成,优选的是使用具有尽可能低的量的脂肪的蛋白质来源。此外,wpc还包含较大量的酮2-丁酮和有机酸乙酸、甲酸和苯甲酸。
1428、在wpc饮料的顶空中所有挥发性有机化合物的增加的存在的综合效应是与wpi相比强烈得多的不合意的气味,这通过简短的感官评估来证实,该感官评估揭示了wpc样品与wpi相比强烈得多和复杂得多的气味,这可能是由于检测到的挥发性有机化合物的形成。
1429、
1430、结论:
1431、本发明人已经发现,包含尽可能低的量的脂肪的乳清蛋白源优选用于制备氧化的乳清蛋白产品及其可口的产品。
1432、实施例8:热梯度的使用
1433、本发明人已经发现,游离硫醇的消除可以在应用不同的温度概况以达到蛋白质的部分解折叠时特别有效,以允许游离硫醇氧化成亚磺酸,随后是第二温度步骤,允许通过亚磺酸和暴露的硫醇的反应在蛋白质之间形成二硫键。
1434、方法
1435、通过将粉末在10mm磷酸盐缓冲液ph 7.0中在室温在温和搅拌下水合持续1小时,由wpi-a(参见实施例1)来制备1%w/w、2%w/w、3%w/w、4%w/w、5%w/w和6%w/w的蛋白质溶液。
1436、将30%过氧化氢在miliq水中稀释至0.3%,并添加到蛋白质溶液中以达到2:1摩尔化学计量。此后,在pcr机(esco healthcare swiftmax pro)中通过使用温度/时间步长梯度(以5℃间隔从25℃至99℃和10.5min的保持时间(总时间176min))对样品进行热处理。在分析之前将样品冷却到25℃。
1437、通过gpc-hplc(分析g)来分析所有样品的游离硫醇(分析e)和粒度。
1438、结果:
1439、令人惊讶的是,发现在从1%至6%的蛋白质浓度,通过仅使用2:1摩尔化学计量可以将游离硫醇的含量减少95%。所测得的游离硫醇在表15中示出。
1440、表15.在1%至6% wpi-a蛋白质溶液中以2:1氧化之后的游离硫醇和mw。
1441、
1442、如表15中示出的,聚集在较高的蛋白质浓度增加,但令人惊讶的是,它可以在高蛋白质浓度用有限的蛋白质聚集来实现。
1443、结论:
1444、游离硫醇的消除可以在非常低的h2o2:blg比通过仔细设计热概况来实现,该热概况允许(1)在由本领域技术人员选择的低温度范围暴露游离硫醇并氧化成亚磺酸状态,以导致最小聚集,以及(2)随后允许在较高温度在亚磺酸和未氧化的游离硫醇残余物之间的反应。
1445、本发明人已经看到本实施例的发明的实施增加了半胱氨酸氧化的选择性并且从而减少例如甲硫氨酸氧化的迹象。
1446、实施例9:低剂量氧化剂的使用与氧化之后的热处理相结合
1447、本发明人证明了热处理和通过使用低剂量氧化剂的组合可以导致游离硫醇水平的降低,甚至降低到期望的范围,其中h2s浓度可以达到低于感官阈值的水平。
1448、通过使用低水平的氧化剂和短的孵育时间(例如1h)的轻度氧化可以允许部分解折叠的蛋白质分子氧化并形成亚磺酸。亚磺酸是半胱氨酸残基与过氧化物反应期间的瞬时中间体,并且可以在存在期望水平的过氧化物和/或长的反应时间(例如在实施例1和实施例2中的8:1和18h)的情况下被进一步氧化以形成亚磺酸或磺酸。另一方面,亚磺酸还可以在存在游离硫醇的情况下被消耗以形成二硫键。在目前的实施例中,本发明人使用低水平的氧化剂例如2:1、短的反应时间例如1h,这有利于一部分游离硫醇氧化以形成亚磺酸,并在二次加热或uht处理期间进一步与其余游离硫醇形成二硫键。
1449、材料与方法:
1450、在20℃将6%(w/w,在蛋白质中)的wpi-c溶液(wpi-c粉末的细节在实施例4中示出)的ph调节至8.0(分析b),并放置在40℃水浴中。当蛋白质溶液的温度达到40℃时,在搅拌的情况下缓慢添加2:1(h2o2和blg之间的摩尔比)的30% h2o2。随后在40℃孵育持续1h。此后,从水浴中取出氧化的蛋白质溶液,添加有过氧化氢酶以去处进入的h2o2,并在室温放置持续15min。向填充在10ml细玻璃管中的6ml溶液的样品应用具有在从60℃至81℃的范围内的温度和从2.5min直至30min的不同持续时间的热处理,以确保有效加热。加热的样品立即在10℃水浴中冷却持续5min。
1451、在uht模拟之前,对样品进行游离硫醇的分析(分析e)和gpc的分析(分析g)。如实施例1中描述的,在样品已经经历uht模拟之后测量h2s水平(分析d)。
1452、结果
1453、来自表16的结果清楚地示出,当使用低剂量的h2o2(2:1)时,在40℃的短孵育时间例如1h是优选的。在孵育之后,游离硫醇的水平从31.7μmol/g蛋白质(wpi-c11)降低至5.4mol/g蛋白质(wpi-c12)。在没有第二次热处理的情况下,wpi-c12直接经历uht处理,其中硫醇水平进一步降低至1.9μmol/g蛋白质。在uht处理期间的这种进一步的硫醇减少可能是由于二硫键的形成。因此,导致蛋白质聚集体的形成(增加的分子量)和非常低水平的h2s。
1454、另一方面,当样品(wpi-c13至wpi-c17)在孵育之后经历热处理时,当在81℃加热持续5min时获得最低的硫醇和h2s水平(wpi-c17)。
1455、有趣的是注意到,在较低温度但较长加热时间例如60℃和30分钟的热处理(wpi-c13)的情况下,也可以减少游离硫醇的量,并且因此获得与未氧化的样品(wpi-c11)相比更低水平的h2s。然而,这种温度和时间组合与在81℃持续5min相比效率低得多。
1456、本发明人还证明,在2:1剂量的h2o2,延长的加热时间例如在40℃时7h不是优选的(wpi-c18)。此外,当将h2o2的剂量增加到8:1时,1h的孵育时间是不足够的(wpi-c19)。在这种情况下,如实施例1中所示的,需要较长的孵育时间,例如18h。
1457、样品wpi-c13至wpi-c19在uht之前的分子量和特性粘度都示出与wpi-c11相比增加。这表明聚集体的形成,这是由于蛋白质分子之间二硫键的形成。蛋白质溶液仍然是透明的,具有14ntu的低浊度(仅针对样品wpi-c17测量)。
1458、表16
1459、
1460、
1461、*)5.4的游离硫醇水平在uht之前,并且1.9在uht处理之后。
1462、结论:
1463、当使用低剂量的氧化剂时可以降低6%乳清溶液的游离硫醇和h2s水平,并且在40℃的短孵育时间是优选的。当蛋白质溶液在孵育之后直接经历uht时,加热步骤是不必要的,并且uht处理的液体可以作为没有令人不愉快的气味的饮料消费。然而,当孵育的蛋白质溶液待转化为粉末时,需要热处理步骤来使过氧化氢酶失活,并且在81℃热处理持续5分钟提供了氧化的乳清蛋白组合物,该氧化的乳清蛋白组合物在随后的uht处理中不会产生令人不愉快的气味。
1464、本发明人已经看到本实施例的发明的实施增加了半胱氨酸氧化的选择性,并且从而减少例如甲硫氨酸氧化的迹象。
1465、实施例10:氧化剂的原位生成的使用
1466、本发明人证明,游离硫醇的消除,因此令人不愉快的气味的减少,可以通过在ph8.0和40℃经过8h孵育逐步添加低剂量的氧化剂,随后进行一个或两个加热步骤来实现。
1467、氧化剂通过使用通过将1摩尔乳糖转化为乳糖酸而产生1摩尔氧化剂(h2o2)的酶来提供。酶的活性可以通过在溶液中存在相对高水平的h2o2来抑制。因此,h2o2的原位生成被设计成随着时间逐步添加底物和酶,以避免在反应开始时高浓度的h2o2。
1468、材料与方法:
1469、在20℃将6%(w/w,在蛋白质中)的wpi-c溶液(wpi-c粉末的细节在实施例4中示出)的ph调节至8.0(分析b),并在40℃孵育持续470分钟。将乳糖(α-乳糖一水合物,sigma-aldrich,usa)和乳糖氧化酶(chr.hansen a/s,denmark)逐步添加到wpi-c溶液中,如下文描述的:
1470、在时间0min时,添加0.75:1(blg和乳糖之间的摩尔比)的乳糖和1ml/l乳糖氧化酶。
1471、·在时间180min时,添加0.25:1(blg和乳糖之间的摩尔比)的乳糖。
1472、·在时间280min和400min时,添加0.25:1(blg和乳糖之间的摩尔比)的乳糖和0.5ml/l乳糖氧化酶。
1473、因此,在整个反应持续时间期间,添加相当于1.5:1(blg和乳糖之间的摩尔比)的乳糖总量和2ml/l的乳糖氧化酶。
1474、在时间470min时,将样品在水浴中加热至81℃持续2.5min以用于使乳糖氧化酶失活,并立即在冰中冷却持续2min。
1475、添加过氧化氢酶,并允许在室温反应持续30min。
1476、将样品再次加热至81℃持续2.5min以用于过氧化氢酶的失活,并立即在冰中冷却持续2min。
1477、此后,将样品用于不同的分析,同时包括未氧化的未加热的wpi-c20样品作为参考。uht之前样品的游离硫醇、分子量和特性粘度分别根据分析e和分析g进行。对于h2s检测,使用分析d。
1478、结果:
1479、在40℃孵育470min之后,游离硫醇的水平成功地从25.6μmol/g蛋白质降低至5.5μmol/g蛋白质。因此,h2s水平非常低,为0.5μm,其低于感官阈值。与wpi-c20样品相比,wpi-c21样品的分子量和特性粘度均增加。这指示聚集体的形成,类似于实施例9。
1480、表17
1481、
1482、结论:
1483、氧化剂组成的原位生成可以是直接添加h2o2的替代方式。在第一步孵育期间原位氧化剂的低剂量和逐步生成允许游离硫醇的氧化以形成亚磺酸,随后在进一步加热步骤期间形成二硫键,类似于实施例9。
1484、本发明人已经看到本实施例的发明的实施增加了半胱氨酸氧化的选择性,并且从而减少例如甲硫氨酸氧化的迹象。
1485、实施例11:通过乳糖和乳糖氧化酶的一步添加来原位生成氧化剂的研究
1486、基于实施例10,本发明人还探索了乳糖和乳糖氧化酶的一步添加用于生成氧化剂(h2o2)以消除蛋白质溶液中的游离硫醇的可能性。
1487、材料与方法:
1488、通过将wpi-c(wpi-c粉末的细节在实施例4中示出)与软化水混合来制备乳清蛋白溶液,以获得6%w/w的蛋白质,并在20℃将其ph调节至8.0(分析b)。本实施例的ph调节总是使用最低所需量的酸/碱,并且仅引起蛋白质浓度的不显著变化。将乳清蛋白溶液孵育持续15分钟,以达到40℃的温度。此后,将全剂量的乳糖(α-乳糖一水合物,sigma-aldrich,usa)和乳糖氧化酶(chr.hansen a/s,denmark;lactoyield材料编号191306和17.2的纤维二糖氧化酶活性(loxu/g))一起添加到wpi-c溶液中。添加的乳糖的量对应于1.5:1的乳糖和blg之间的摩尔比,并且因此所产生的h2o2和blg之间的理论摩尔比为1.5:1。使用2ml/l的量的乳糖氧化酶。然后将溶液保持在40℃持续360分钟,以允许h2o2的形成和游离硫醇的氧化。
1489、在孵育结束时,将6ml样品放入细玻璃管中,并在83℃加热持续2.5min,并立即在冰中冷却持续2min(样品wpi-c23)。
1490、参考样品wpi-c22是wpi-c(6%w/w的量的蛋白质)的未氧化的溶液,并调节至ph8.0。wpi-c22未被加热到83℃持续2.5min。
1491、随后,使wpi-c22和wpi-c23经历不同的分析。uht之前样品的游离硫醇、分子量和特性粘度分别根据分析e和分析g进行。在uht模拟之后一小时内(根据实施例1),使用分析d进行h2s的检测。如实施例1所描述进行感官测试。
1492、结果:
1493、在40℃孵育470min之后,在氧化的样品(wpi-c23)中游离硫醇的水平成功地从29.8μmol/g蛋白质(wpi-c22)降低至7.3μmol/g蛋白质。wpi-c23的模拟uht处理揭示1μm的低水平h2s,并且h2s的气味在室温储存24h之后无法感知到。相比之下,wpi-c22的模拟的uht处理产生强烈的鸡蛋的令人不愉快的味,这种气味很容易被感官测试感知到。
1494、与wpi-c22参考样品相比,wpi-c23样品中的分子量增加。这指示作为热处理的结果的聚集体的形成,类似于实施例9和实施例10。
1495、表17通过uht处理来原位生成氧化剂以降低游离硫醇水平和所产生的令人不愉快的气味
1496、
1497、参考样品wpi-c22没有经历83℃持续2.5分钟的热处理,并且因此没有观察到与wpi-c22相关的聚集(并且因此摩尔重量mw增加)。
1498、结论:
1499、本实施例证明,通过乳糖和乳糖氧化酶的一步添加以乳糖(并且因此h2o2)和blg之间的低摩尔比原位生成氧化剂是减少游离硫醇的可行方法,并且在uht处理时仅导致低水平的令人不愉快的气味生成。
1500、实施例12:使用低剂量的氧化剂来产生氧化的乳清蛋白粉
1501、在该实施例中报告的实验中,本发明人证明了使用实施例9中描述的氧化条件制备氧化的乳清蛋白粉末并进一步浓缩和喷雾干燥所得到的氧化的乳清蛋白流的可行性。在中性ph再水合和uht处理之后,所得到的改性的乳清蛋白粉产生令人惊讶的低水平的令人不愉快的气味。
1502、特别有利的是,当这样的产品待经长距离运输时通过例如喷雾干燥来去除水以节省能量(避免水的运输),并降低在储存期间微生物生长的风险。
1503、 wpi-c26 总固体 [%] 96.0 蛋白质(nx6.38) [%] 87.8 蛋白质/总固体 [%] 91.5 脂肪 [%] <0.1 乳糖 [%] <0.1 灰分 [%] 5.08 钙 [%] 0.056 钠 [%] 0.699 钾 [%] 1.62 镁 [%] 0.008 磷 [%] 0.197 氯化物 [%] 0.38 ph [-] 7.25
1504、材料与方法:
1505、通过在室温在温和搅拌的情况下将wpi-c在水中水合持续30分钟,制备包含7.6%w/w蛋白质的250kg的wpi-c溶液(具有实施例4中描述的特性,表9)(wpi-c24)。此后,将溶液加热至40℃,并通过添加koh(4.5%)和naoh(2.3%)的碱液混合物将溶液的ph调节至7.8(40℃)。添加足以获得h2o2和blg之间的1.9:1的摩尔比(相当于约150mg h2o2/l)的量的h2o2,并将溶液在40℃在温和混合的情况下孵育持续60min。在孵育结束时,经由板式热交换器将蛋白质溶液加热至85℃,其中保持时间为2分钟。并且随后冷却到<10℃。
1506、然后使用0.3m hcl将氧化的wpi的ph调节至7.1(20℃),并搅拌持续30min。在该时间点,通过分析e的游离硫醇基团、根据实施例1的uht模拟、通过分析d的h2s、通过分析q的浊度、通过分析c的粘度和如实施例1中描述的感官,取200ml的样品(wpi-c25)。氨基酸和氧化的氨基酸分别通过分析f1和分析f2来定量。
1507、在配备有2片alfa laval ro98pht 3838/65膜的中试规模mms nf/ro单元上,将剩余的氧化的wpi溶液浓缩至brix 14,相当于10.5%w/w的蛋白质含量,并以在10℃和30巴的ro模式操作,其中每个元件的最大压差为1.1巴。然后在spx脱水中试规模喷雾干燥器(185℃入口/85℃出口温度)上干燥ro渗余物以产生粉末(wpi-c26)。
1508、将wpi-c26(具有如上表中示出的组成)在室温在温和搅拌下再水合,以产生包含6%w/w的量的蛋白质的wpi-c26溶液,该溶液通过分析e来表征游离硫醇基团,根据实施例1经历uht模拟,通过分析d经历h2s测定,并如实施例1所描述经历感官。根据分析h来测量残余h2o2。
1509、将wpi-c26粉末的单独的样品再水合以提供包含7.6%w/w的量的蛋白质的溶液,并且分别通过分析f1和分析f2来定量氨基酸和氧化的氨基酸。
1510、样品wpi-d24、wpi-d25和wpi-d26的氨基酸概况由eurofins vitamin testingdenmark dj041-1基于eu 152/2009方法参考进行测定。
1511、组合的半胱氨酸+胱氨酸水平源自eurofins分析,并且通过将数据与分析e的数据组合(通过乘以l-半胱氨酸的分子量转换为重量-浓度)并重新计算为单位g/100g来计算二硫键(胱氨酸)中的半胱氨酸残基的量:
1512、二硫键中的cys=(1-(以g/100g蛋白质计的游离sh)/(以g/100g蛋白质计的cys+胱氨酸))*100%
1513、结果:
1514、如表18中示出的,通过低剂量的h2o2在40℃孵育60min的情况下的氧化导致起始材料(wpi-c24)中的游离硫醇从29.6μmol sh/g减少到1.7μmol sh/g蛋白质(wpi-c25),其在实验室uht处理之后产生非常少量的h2s,这不能通过感官评估检测到。表征样品wpi-c26的1.8μmol sh/g蛋白质产生0.4μm h2s,并且在感官评估中无法感知。
1515、本发明人已经发现,低浊度和粘度与样品wpi-c25的494kda的观察到的mw非常一致。
1516、在实施例12的工艺的加热步骤期间,通过游离硫醇和亚磺酸形成二硫键导致分子量从19kda增加到494kda。本发明人发现,对于wpi-c26,分子量通过浓缩和干燥步骤略微增加至717kda。
1517、表18氧化的乳清蛋白粉的生产
1518、
1519、氨基酸分析的结果在图2中示出,并且证明了本发明能够实现的游离硫醇的选择性氧化。氧化的乳清蛋白样品wpi-c25和wpi-c26具有与未氧化的参考样品wpi-c24大体上相同的氨基酸概况。
1520、如表19中示出的,对样品wpi-c24至wpi-c26中色氨酸和甲硫氨酸的分析示出,在氧化(wpi-c25)和干燥(wpi-c26)之后,这些氨基酸的水平没有显著变化,因此清楚地证明了温和且选择性氧化过程。
1521、表19还证明了在氧化和干燥之后没有形成犬尿氨酸。本发明人还发现在样品wpi-c24至wpi-c26中没有o-tyr、dityr或dioia的痕迹。
1522、通过结合总半胱氨酸(cys+胱氨酸)的氨基酸分析,本发明人发现本实施例的游离硫醇的减少主要是由于二硫键的形成,如由二硫键结合的半胱氨酸在氧化的样品(wpi-d25)中从82.9%(wpi-d24)增加到99.1%和在干燥样品(wpi-d26)中从82.9%(wpi-d24)增加到97.4%所证明的;参见表19。本发明人期望wpi-d25和wpi-d26之间的微小差异在分析误差内。此外,本发明人发现wpi-d26中的聚集体完全可还原至wpi-d24的状态,证实聚集体通过二硫键稳定(通过在还原条件和非还原条件下样品的sds-page分析证实)。
1523、最后,对残余过氧化物的分析揭示,wpi-d25和wpi-d26没有任何任何先前添加的过氧化物的存在。
1524、表19样品特性(bdl=低于检测限)
1525、
1526、结论:
1527、通过使用低剂量的氧化剂和短的反应时间,可以生产氧化的wpi粉末,该氧化的wpi粉末在uht处理期间不会产生不合意的气味。这种组合产生了液体产品和粉末两者,其特征在于可还原的二硫键中的高含量cys,作为游离硫醇的低半胱氨酸水平,并且因此当经历uht处理时产生低水平的h2s。
1528、在wpi-d25和wpi-d26的制造中使用的低剂量的氧化剂产生了与原材料(wpi-d24)的氨基酸概况相当的氨基酸概况,并且特别明显的是总半胱氨酸或甲硫氨酸残基没有显著损失,并且可以检测到氧化产物。
1529、在wpi-d25和wpi-d26中没有检测到添加的过氧化物残余物的存在,这指示过氧化物可以在本发明的方法中用作氧化剂,并且在不需要添加过氧化氢酶的情况下被完全消耗。
1530、实施例13:低剂量和高温的使用
1531、本发明人已经证明,低剂量的氧化剂的使用可以有效地与直接蒸汽注射uht处理结合使用,以成功地减少乳清蛋白组合物中的游离硫醇,并且因此导致在随后的热处理中具有低水平的令人不愉快的气味的乳清蛋白饮料。
1532、材料与方法:
1533、通过将wpi-c粉末溶解在软化水中来制备225kg的wpi-c溶液(6%w/w的量的蛋白质)。
1534、在保持罐中在搅拌的情况下使用加热罩将wpi-c溶液加热至40℃。将ph调节至ph7.8,在40℃测量,以产生wpi-c27。
1535、使20kg的wpi-c27在143℃通过直接蒸汽注射(dsi)直接经历uht处理持续4秒(wpi-c28),并且随后通过闪蒸冷却被冷却到70℃,并且然后被冷却到10℃。收集来自wpi-c28的闪蒸冷却的闪蒸水(lash water)作为样品flash1。
1536、将剩余的wpi-c27在40℃用1.9:1 h2o2:blg氧化持续60min,并且然后通过在143℃保持时间为4秒的直接蒸汽注射进行uht处理,并随后通过闪蒸冷却冷却到70℃,并且然后冷却到10℃,以产生氧化的wpi-c29样品。收集来自wpi-c29的闪蒸冷却的闪蒸水作为样品flash 2,以研究将低剂量的h2o2与高温处理(此处为dsi)相结合的生产工艺在生产在后续应用中产生低h2s水平的产品中的可行性。
1537、在收集之后立即将1.0ml的flash1和flash2的样品转移到2ml gc小瓶(mikrolab编号ml 33003vu)中,并使用铝盖(mikrolab ml 33032)和电子压接器(thermo scientificcrma60180-ecrh11ki)进行压接密封。根据分析d来分析样品flash1和样品flash2中的h2s含量。
1538、使wpi-c27和wpi-c29进一步经历模拟uht处理,以证明氧化的wpi-c29样品即使在经历苛刻的热处理时也产生低水平的令人不愉快的气味。分别根据分析e和分析g来分析样品wpi-c27、wpi-c28和wpi-c29的游离硫醇含量和分子量。
1539、结果:
1540、在本研究中,本发明人采用低h2o2剂量(1.9:1 h2o2:blg)与4秒的在143℃的直接蒸汽注射相结合作为加热步骤的,以证明游离硫醇含量的有效降低,如表20中示出的。
1541、表20表明,wpi-c27原材料的游离硫醇含量在没有h2o2的情况下通过直接蒸汽注射生产wpi-c28而略微降低。然而,用1.9:1 h2o2:blg摩尔比的氧化与直接蒸汽注射生产wpi-c29相结合将游离硫醇含量显著降低至5.9μmol sh/g蛋白质。
1542、还证明了在wpi-c28和wpi-c29的热处理中产生的蛋白质聚集体的分子量基本上是不可区分的,这表明在wpi-c29的加工中低h2o2剂量的存在不影响wpi-c聚集的总体倾向。
1543、在wpi-c28的加工期间,本发明人令人惊讶地从闪蒸水(flash1)中感知到鸡蛋香味,该闪蒸水(flash1)是在直接蒸汽注射以加热样品和在143℃保持时间为4秒之后的热处理的蒸发/冷凝步骤期间产生的。事实上,在收集的闪蒸水(flash1)中展示出4.3μm h2s的浓度,并且操作者可以容易地感知到。
1544、相比之下,本发明人在wpi-c29样品的加工期间没有观察到鸡蛋香味,并且h2s测量证实在收集的闪蒸水(flash2)中0.1μm h2s的非常低的水平。因此,本发明人令人惊讶地发现,低h2o2剂量的使用本身可能因此有益于减少操作者暴露于由在制造过程中的热处理产生的h2s水平。
1545、经历模拟的uht处理的wpi-c27样品和wpi-c29样品的h2s含量分别示出样品中的5.7μm h2s和0.3μm h2s。该水平清楚地表明,在加工期间用低剂量的h2o2的氧化与使用高温相结合允许在饮料的最终制备中制造不具有/具有低h2s水平的饮料组合物。
1546、表20实施例13中制备的样品。
1547、
1548、结论:
1549、本发明人已经证明,使用例如11.9:1 h2o2:blg的摩尔比氧化乳清蛋白可以与uht类型的热处理结合使用,以减少乳清蛋白组合物的游离硫醇的含量。
1550、在乳清的加工中使用低h2o2剂量可以显著减少uht设备的操作者对h2s的暴露。
1551、由于wpi-c29的游离硫醇基团的低含量,如果经历第二次uht处理,则它将不会产生不合意的气味。
1552、实施例14:使用低剂量的h2o2以生产适合于慢性肾脏疾病患者的氧化的乳清蛋白饮料
1553、慢性肾脏疾病患者由于肾脏功能不全而在非常良好地去除在许多富含蛋白质的食物(肉类、家禽、乳制品)中常见的有机磷方面是效率低的,并且因此它对提供低磷的乳清蛋白组合物可以是特别有益的。本实施例表明,blg分离物可以经历选择性的、低剂量的h2o2氧化,以产生具有低水平的令人不愉快的气味(或者甚至根本没有令人不愉快的气味)的营养ph中性饮料。这样的饮料可以在具有添加的脂质或不具有添加的脂质两者的情况下生产。
1554、材料与方法:
1555、使用具有如表21中描述的特性的wpi-d来制备本实施例的饮料组合物。
1556、表21 wpi-d特性
1557、 wpi-d 蛋白质/ts,% 97 相对于总蛋白质的blg,% 99.6 相对于总蛋白质的ala,% <1 相对于总蛋白质的cgmp,% <1 na,占ts的% 0.34 k,占ts的% 0.83 mg,占ts的% <0.003 ca,占ts的% <0.025 磷,占ts的% 0.03 c1,占ts的% 0.07 6%溶液的ph 7.0 乳糖% ≤0.1 脂肪% ≤0.1
1558、通过在温和搅拌的情况下将粉末溶解在软化水中持续30分钟来制备3升wpi-d蛋白质溶液(6%蛋白质w/w)。使用3m naoh在20℃将ph调节至ph 8.0,并将溶液分成更小的等分试样并平衡至40℃。添加3%过氧化氢至在h2o2和blg之间2∶1的最终含量摩尔比,并将氧化蛋白溶液在40℃孵育持续1小时。使用omve ht122台式uht系统将氧化溶液热处理至83℃,其中保持时间为2.5分钟,并且随后冷却到20℃。
1559、通过使用配备有5kda超滤膜的200ml amicon搅拌池在3巴tmp使用n2气体将氧化的蛋白质溶液浓缩至7.8%,以提供样品wpi-d5。蛋白质含量通过使用pal-α手持式折射仪(atago)来估计,并通过分析a来确认。
1560、通过在温和搅拌的情况下将wpi-d溶解在软化水中持续30分钟而没有进一步处理来制备包含7.8%蛋白质w/w的参考溶液(wpi-d6)。
1561、根据分析e来测定wpi-d5和wpi-d6溶液的游离硫醇含量。
1562、通过将表22中描述的成分混合来制备具有和不具有脂质的示例性饮料组合物(bev-d1、bev-d2、bev-d3和bev-d4)。将蛋白质和脂质成分在水浴中单独地预平衡至40℃,并将乳化剂添加到脂质相中。
1563、然后将预平衡的蛋白质溶液与脂质相或软化水混合,并使用ultra-turrax短暂混合,并且最后使用gea panda均质器在200巴均质化,以产生表22中的具有6%w/w的蛋白质含量的饮料组合物。根据实施例1使饮料组合物经历模拟的uht处理,并在uht模拟之后的第二天使用分析d来测量h2s。
1564、表22示例性的饮料组合物的配方。
1565、
1566、结果:
1567、本实施例证明了通过使用低h2o2剂量结合在83℃对以低含量的磷为特征的wpi-d进行热处理来生产氧化的wpi-d5,使其特别适合作为需要具有最低磷含量的蛋白质来源的慢性肾脏疾病患者的营养饮料的可行性。
1568、发现氧化过程将游离硫醇的量从来自wpi-d6的54.2μmol sh/g蛋白质减少到在wpi-d5中氧化之后的9.2μmol sh/g蛋白质,如表23中所示的。
1569、当使具有或不具有脂质的营养饮料组合物经历模拟的uht处理时,发现包含未氧化的wpi-d6蛋白的bev-d1样品和bev-d3样品产生超过约10μm h2s的h2s水平,这显著超过感官阈值。相比之下,包含wpi-d5蛋白的bev-d2饮料组合物和bev-d4饮料组合物产生<0.7μm h2s且低于通过感官测试所感知的水平。
1570、表23在模拟的uht处理之后的饮料特性
1571、
1572、
1573、结论:
1574、通过用2:1 h2o2:blg氧化,证明了使用wpi-d来生产包含10%w:w脂质的6%乳清蛋白饮料。wpi-d的低磷水平使得这样的饮料对患有慢性肾脏疾病的患者特别有用。
1575、实施例15:使用高压以用于暴露游离硫醇
1576、在该实施例中,本发明人旨在通过在中等压力下使蛋白质组合物经历氧化条件来氧化wpi-d中的游离硫醇,中等压力本身不足以诱导主要含硫醇的乳清蛋白(blg)的显著变性/聚集,如在减压之后所确定的。
1577、本发明人建议,blg中游离硫醇的部分氧化允许在氧化成亚磺酸的游离硫醇和剩余的未氧化的游离硫醇之间形成二硫键,前提是存在实现新二硫键的形成的构象自由度。在本实施例中,在加压下将游离硫醇暴露于h2o2之后,通过在85℃将溶液加热持续5分钟来实现这种构象自由度。
1578、方法和材料
1579、在室温在温和搅拌下将wpi-d再水合至6%,随后在20℃使用2m naoh将ph调节至8.0(wpi-d7至wpi-d13)。
1580、将h2o2添加到样品wpi-d8至wpi-d10以及wpi-d12和wpi-d13中,以达到2:1的h2o2:blg摩尔比。不向wpi-d7和wpi-d11中添加h2o2。
1581、除了wpi-d13之外,将32ml的每种样品转移到nalgene hdpe塑料瓶中,并用帽密封。将瓶浸没在包含流体静力学的流体介质的压力容器中,并使用qfk-6高压单元(avuretechnoliges ab,sweden)在20℃-25℃如表24中所描述地加压到50巴或100巴持续30分钟或60分钟。
1582、直接从高压处理中取出样品wpi-d8至wpi-d13(不包括wpi-d9),并且将15ml样品转移到带有螺旋帽盖的20mlduran gl 18试剂杯中,并浸没到86℃水浴中持续5分钟。在加热之后,将样品在冰水浴中冷却。
1583、根据分析e来测量所有样品的游离硫醇含量,根据实施例1使选择的样品经历模拟的uht处理和感官评估,并且根据实施例d来测量h2s。
1584、结果:
1585、对使用中等压力以使得能够获得blg中的游离硫醇进行了评估。
1586、采用在没有h2o2(wpi-d7)的情况下以85℃/5min加热的在ph 8.0的高压处理在模拟的uht之后导致高水平的令人不愉快的气味,并且还被发明人认为是‘鸡蛋味’。
1587、在存在h2o2(wpi-d12)的情况下在ph 8.0的高压处理导致游离硫醇水平降低至~23μmol sh/g蛋白质或略低于起始材料的一半(理论上为54μmol sh/g蛋白质)。当与在85℃/5min的热处理结合时,所得到的游离硫醇水平在wpi-d13中被降低至6.8μmol sh/g蛋白质,在wpi-d8中被降低至5.9μmol sh/g蛋白质,并且在wpi-d10中被降低至3.9μmol sh/g蛋白质。在对样品wpi-d8和wpi-d13进行模拟的uht处理之后,对令人不愉快的气味的测量证实了先前的观察结果,即硫醇减少导致0.5μm和0.4μm h2s的低水平的令人不愉快的气味,并且感知低于5。样品wpi-d9在没有压力处理的情况下在存在2:1 h2o2:blg的情况下在85℃持续5min的热处理也降低了游离硫醇水平,但效率略低,其中鉴定的游离硫醇水平为9μmol sh/g蛋白质。
1588、表24 wpi-d中游离硫醇的高压氧化
1589、
1590、结论:
1591、本实施例表明,可以采用解折叠蛋白质的替代手段来暴露游离硫醇并允许氧化。此处,中等高压、低2:1 h2o2:blg氧化剂剂量和随后的热处理的组合足以将游离硫醇水平降低到一定程度,所述程度当经历uht处理时导致令人不愉快的气味的非常低的感知的水平和测量的水平。
1592、实施例16:使用低剂量和短孵育时间
1593、在该实施例中,本发明人示出,通过热氧化以非常短的孵育时间生产氧化的wpi令人惊讶地是可能的。
1594、材料与方法:
1595、在40℃将6%蛋白质(w/w)wpi溶液(wpi-c)调节至ph 7.8,并冷却到约10℃。此后,将h2o2添加到wpi溶液中,以达到1.9:1 h2o2:blg摩尔比,并混合持续1min。紧接着,经由板式热交换器将wpi溶液加热至85℃,其中保持时间为2分钟,以进行热氧化,并且随后冷却到<10℃(wpi-c30)。
1596、饮料由wpi-c30(液体氧化的wpi溶液)生产。在uht之前,用1% hcl将6%氧化的wpi溶液的ph调节至ph 7.0(22℃)。使用板式热交换器(phe)(ht320-20,omve,netherlands)进行uht热处理,该板式热交换器以80l/h的厂用水流量、20l/h的产品流量操作,预加热至70℃,随后在143℃加热持续20秒。将热处理的饮料在出口处冷却到10℃,并装入100ml无菌塑料瓶中,并立即密封以用于进一步分析。此外,在uht的出口处获取用于h2s水平分析(分析d)的样品,其中将1ml的样品填充到2ml玻璃小瓶中,并立即用盖子卷曲密封,如实施例1中描述的。
1597、结果:
1598、本实验表明,可以通过在10℃添加h2o2(1.9:1)将游离硫醇含量降低93%,并在85℃/2min的短孵育时间内进行热氧化。因此,在透明(9.2ntu)uht饮料中发现非常低水平的h2s(0.2μm)。
1599、
1600、结论:
1601、本发明人发现,可以通过在超过65℃的温度将蛋白质与低水平的h2o2一起孵育持续短时间来减少加工时间和能量使用。所获得的氧化的乳清蛋白组合物可以直接用作饮料,并且可以例如在热氧化之后立即装瓶,或者可选择地其本身可以被干燥或浓缩并随后干燥,优选地通过喷雾干燥。
本文地址:https://www.jishuxx.com/zhuanli/20240614/99208.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
上一篇
改善食品风味的方法与流程
下一篇
返回列表