植物性饮食品的制造方法以及糖类降低用酶剂与流程
- 国知局
- 2024-07-12 12:33:40
本发明涉及一种植物性饮食品的制造方法。更具体地,本发明涉及一种使用麦芽三糖生成酶降低植物性饮食品中的糖类的技术。
背景技术:
1、近年来,由于健康志向的日益提高,植物性饮食品受到关注。例如,通过在水性介质中悬浮燕麦材料并使用一个以上的淀粉酶分解燕麦材料的淀粉来制备燕麦饮料。此时使用的淀粉酶是β-淀粉酶,或者是α-淀粉酶和β-淀粉酶的混合物。利用该方法制备的燕麦饮料由于麦芽糖在β-淀粉酶的作用下生成,从而呈现足够好的甜味(专利文献1)。
2、在此,对本技术中使用的酶进行说明。麦芽三糖生成酶是催化以麦芽三糖单位对淀粉中所含的低聚糖进行水解的反应的酶。已知麦芽三糖生成酶用于麦芽三糖糖浆的制造(专利文献2)。
3、糖质氧化酶是具有氧化糖质的性质的酶。已知糖质氧化酶用于生成以麦芽糖酸为代表的糖酸(专利文献3)。
4、现有技术文献
5、专利文献
6、专利文献1:日本特开2018-075029号公报
7、专利文献2:日本特开平03-251173号公报
8、专利文献3:国际公开第2014/042237号
技术实现思路
1、发明想要解决的课题
2、如上所述,近年来,由于健康志向的提高,植物性饮食品受到关注。但是,在例如使用所述专利文献1所示的技术,除α-淀粉酶以外还用β-淀粉酶进行处理而获得的燕麦饮料等植物性饮食品中包含大量以葡萄糖、麦芽糖为代表的糖类。因此,不满足降低糖类的要求。
3、因此,本技术中,其主要目的在于提供一种降低植物性饮食品中的糖类的技术。
4、用于解决课题的手段
5、本技术发明人对降低植物性饮食品中的糖类的技术进行了深入研究,结果发现通过使麦芽三糖生成酶作用于植物性饮食品的植物性原料,可以降低植物性饮食品中的糖类,从而完成了本技术。
6、即,本技术中,提供一种植物性饮食品的制造方法,包括使麦芽三糖生成酶作用于植物性原料的工序。
7、作为本技术中使用的所述植物性原料,可以使用经过α-淀粉酶处理的原料。
8、本技术所涉及的制造方法中,可以进一步进行使糖质氧化酶作用于植物性原料的工序。
9、本技术所涉及的制造方法中,作为植物性饮食品可以制造燕麦奶。
10、本技术中,还提供包含麦芽三糖生成酶的糖类降低用酶剂。
11、本技术所涉及的糖类降低用酶剂中可以进一步包含糖质氧化酶。
12、本技术中,进一步提供一种植物性饮食品的糖类降低方法,包括使麦芽三糖生成酶作用于植物性原料的工序。
13、在本技术中,“糖类”是单糖类及二糖类的总称。
14、发明效果
15、根据本技术,可以降低植物性饮食品中的糖类。
16、实施发明的方式
17、以下,将说明用于实施本技术的优选方式。而且,以下说明的实施方式示出本技术的代表性实施方式的一个例子,不应由此狭义解释本技术的范围。
18、<1.植物性饮食品的制造方法、植物性饮食品的糖类降低方法>
19、本技术所涉及的植物性饮食品的制造方法、以及植物性饮食品的糖类降低方法是至少进行使麦芽三糖生成酶作用于植物性原料的工序(以下也称为“麦芽三糖生成酶作用工序”)的方法。另外,还可以进一步进行使糖质氧化酶作用于植物性原料的工序(以下也称为“糖质氧化酶作用工序”)、使α-淀粉酶作用于植物性原料的工序(以下也称为“α-淀粉酶作用工序”)。除此之外,根据植物性饮食品的种类等,在不损害本技术的效果的范围内,也可以在各工序的之前之后或与各工序同时进行一般的食品制造工序。另外,本技术所涉及的植物性饮食品的制造方法、以及植物性饮食品的糖类降低方法中,也可以进一步实施回收工序,回收所制造的植物性饮食品、或糖类降低的植物性饮食品。以下,将详细说明各个工序。
20、(1)植物性原料
21、只要不损害本技术的效果,植物性原料的起源、种类等没有特别限定,可以根据目标植物性饮食品自由选择本技术中可以使用的植物性原料。可列举例如大豆(soy beans)、豌豆(green peas)、扁豆(lent i ls)、鹰嘴豆(chickpeas)、黑豆(black beans)、蚕豆、绿豆、羽扇豆、芸豆等豆类;小麦、大麦、燕麦(oat)、大米、黑麦、荞麦、稗子、粟、苔麸等谷类;杏仁、椰子、花生、腰果、榛子、美洲山核桃、澳洲坚果、开心果、胡桃、巴西坚果、霹雳果、栗子、芝麻、松子等坚果类;大麻种子(产业用大麻)、奇亚籽(chia)、奎奴亚藜(quinoa)、苋属(amaranthus)、加那利籽(canary seed)、亚麻籽等。本技术中,这些可以单独使用,也可以组合使用两种以上。这些原料之中,优选列举谷类,更优选列举燕麦(oat)。
22、在本技术中,只要不损害本技术的效果,在供给给各种酶处理时的植物性原料的形状也没有特别限定,但优选列举夜状、浆状、糊状。
23、在本技术中,进行利用后述的麦芽三糖生成酶和/或糖质氧化酶的处理时的植物性原料优选使用经过α-淀粉酶处理的植物性原料。通过对植物性原料进行α-淀粉酶处理,可以降低原料的粘度。
24、在使用经过α-淀粉酶处理的植物性原料的情况下,还可以使用已经经过α-淀粉酶处理的植物性原料,也可以进行后述的α-淀粉酶作用工序。
25、(2)麦芽三糖生成酶
26、可用于本技术的麦芽三糖生成酶是作用于淀粉且主要具有生成麦芽三糖的活性的酶。作为可用于本技术的麦芽三糖生成酶,只要具有生成麦芽三糖的活性,可以是还具有其他作用的酶。
27、本技术中,通过使麦芽三糖生成酶作用于植物性原料,可以使所制造的植物性饮食品中的糖类(单糖类及二糖类)降低。另外,可以通过使麦芽三糖生成酶作用于植物性原料来增加所制造的植物性饮食品中的三糖类的量,以赋予适度的甜味。
28、可用于本技术的麦芽三糖生成酶的来源没有特别限定,可列举例如来源于链霉菌(streptomyces)属、芽孢杆菌(baci l lus)属、微杆菌(microbacterium)属、纤维微杆菌(cel lulos imicrobium)属生物的麦芽三糖生成酶。这些麦芽三糖生成酶可以单独使用一种,也可以组合使用多种。在这些麦芽三糖生成酶之中,优选列举来源于微杆菌属生物或者来源于纤维微杆菌属生物的麦芽三糖生成酶,更优选列举来源于微杆菌属(microbacterium sp.)的麦芽三糖生成酶。具体地,可以使用显示作用于直链淀粉、支链淀粉、糖原以及淀粉的底物特异性的酶。
29、这里的“来源于微杆菌属的麦芽三糖生成酶”是指分类为微杆菌属的微生物(可以是野生株,也可以是变异株)生产的麦芽三糖生成酶、或利用麦芽三糖生成酶基因通过基因工程的方法获得的麦芽三糖生成酶。因此,由宿主微生物生产的重组体也相当于“来源于微杆菌属的麦芽三糖生成酶”,该宿主微生物是导入了由微杆菌属获得的麦芽三糖生成酶基因(后者改变了该基因的基因)的宿主微生物。
30、用于本技术的麦芽三糖生成酶可以从成为麦芽三糖生成酶的来源本身的微生物的培养液制备。作为具体的制备方法,列举从上述微生物的培养液或者菌体中回收麦芽三糖生成酶的方法。例如,在使用麦芽三糖生成酶分泌型微生物的情况下,根据需要预先通过过滤、离心处理等来从培养液回收菌体后,可以对酶进行分离和/或纯化。另外,在使用麦芽三糖生成酶非分泌型微生物的情况下,根据需要预先从培养液回收菌体后,通过加压处理、超声波处理等粉碎菌体以使酶暴露,然后可以对酶进行分离和/或纯化。作为酶的分离和/或纯化法,可以没有特别限定地使用公知的蛋白质分离和/或纯化法,可列举例如离心分离法、uf浓缩法、盐析法、使用离子交换树脂等的各种色谱法等。分离和/或纯化后的酶可以通过冷冻干燥、减压干燥等干燥法粉末化,另外,可以在该干燥法中使用适当的赋形剂和/或干燥助剂来进行粉末化。另外,分离和/或纯化后的酶也可以通过加入合适的添加剂进行过滤灭菌来进行液状化。
31、本技术中,作为麦芽三糖生成酶还可以使用市售品,作为优选的市售品的例子,列举天野酶制品株式会社制的amt1.2l。
32、麦芽三糖生成酶作用工序的各种条件可以自由设定,只要不损害本技术的效果即可。例如,可以根据使用的麦芽三糖生成酶的最适ph、稳定ph范围、最适温度、温度稳定性等理化性质设定ph、温度、作用时间等。ph例如可以设定为ph5.0~8.0,优选ph5.5~7.5,更优选ph6.0~7.0。温度例如可以设定为30℃~70℃,优选35℃~65℃,更优选40℃~60℃。作用时间例如可以设定为10分钟~12小时,优选30分钟~6小时,更优选1小时~3小时。而且,最佳的反应条件可以通过初步实验确定。
33、麦芽三糖生成酶作用工序中的麦芽三糖生成酶的添加量可以自由设定,只要不损害本技术的效果即可。作为每1g植物性原料的用量,可列举例如0.1u以上。从进一步提高糖类降低效果以及甜味增强效果的观点出发,作为麦芽三糖生成酶的每1g植物性原料的用量,可以优选设定为0.5u以上,更优选设定为1u以上,还优选设定为5u以上,进一步优选设定为10u以上。作为麦芽三糖生成酶的每1g植物性原料的用量范围的上限没有特别限定,例如可以设定为1500u以下、300u以下、150u以下、100u以下、50u以下、20u以下、或者15u以下。
34、而且,在本技术中,麦芽三糖生成酶的活性是通过后述的实施例中记载的淀粉糖化力活性测定法测定的值。
35、(3)糖质氧化酶
36、作为可用于本技术的糖质氧化酶,只要是可以氧化糖质的酶,则没有特别限定,优选为氧化二糖以上的低聚糖的酶。具体地,列举后述的具有理化性质的蛋白质。
37、本技术中,通过使糖质氧化酶作用于植物性原料,可以进一步降低所制造的植物性饮食品中的糖类(单糖类以及二糖类)。
38、(a)作用
39、在氧存在下,可用于本技术的糖质氧化酶氧化后述的糖而生成糖酸。更详细地,在氧存在下,当使可用于本技术的糖质氧化酶作用于后述的糖时,生成糖酸和过氧化氢。
40、(b)底物特异性
41、作为可用于本技术的糖质氧化酶,可以使用对选自葡萄糖、麦芽三糖、麦芽糖、半乳糖、麦芽四糖、乳糖、纤维二糖以及糊精的一个以上的糖质显示活性的蛋白质。在将相对于葡萄糖的活性设为100%的情况下,相对于各底物的相对活性是麦芽三糖:约92%、麦芽糖:约86%、半乳糖:约79%、麦芽四糖:约60%、乳糖:约58%、纤维二糖:约53%、麦芽糊精:约24%。
42、而且,在本技术中,如果在将葡萄糖作为底物的情况下的活性为基准(100%)时的相对活性为50%以上,则判断为“是本酶良好地发挥作用的底物”。
43、如此,如果使用不仅对如葡萄糖那样的单糖类、对二糖类以上的广范围的糖质也显示活性的糖质氧化酶,可以使糖质氧化作用在用现有葡萄糖氧化酶或低聚糖氧化酶无法应对的广范围的领域中发挥功能。
44、(c)km值
45、在本技术中,蛋白质的km值(米氏常数)的具体计算方法没有特别限定,可以自由选择公知的方法进行计算。作为蛋白质的km值的计算方法,可列举例如lineweaver-burk绘图、eadie-hofstee绘图、hanes-woolf绘图等,优选列举hanes-woolf绘图。可用于本技术的糖质氧化酶的km值没有特别限定,优选为[葡萄糖的km值]/[麦芽糖的km值]≤1,更优选为0.4≤[葡萄糖的km值]/[麦芽糖的km值]≤1。
46、(d)分子质量
47、作为可用于本技术的糖质氧化酶,可以使用根据sds-page法的分子质量约为63kda的糖质氧化酶。
48、(e)最适ph
49、作为可用于本技术的糖质氧化酶,可以使用如下糖质氧化酶:在37℃、5分钟的反应条件下,在ph5.0~9.0附近糖质氧化酶的活性最高。
50、(f)稳定ph范围
51、作为可用于本技术的糖质氧化酶,可以使用如下糖质氧化酶:在37℃、15分钟的处理条件下,在ph5.0~10.5附近稳定。
52、(g)最适温度
53、作为可用于本技术的糖质氧化酶,可以使用如下糖质氧化酶:在ph7.0、5分钟的反应条件下,在20℃~55℃附近糖质氧化酶的活性最高。
54、(h)温度稳定性
55、作为可用于本技术的糖质氧化酶,可以使用如下糖质氧化酶:在ph7.0、15分钟的处理条件下,即使在高达45℃的温度条件下处理,也可以维持80%以上的活性。
56、(i)关于来源
57、以上说明的可用于本技术的糖质氧化酶的来源没有特别限定,可列举例如来源于属于枝顶孢(acremonium)属的微生物的糖质氧化酶。在这样的情况下,作为属于枝顶孢属的微生物,列举顶头孢霉(acremonium chrysogenum)。
58、这里的“来源于顶头孢霉的糖质氧化酶”是指分类为顶头孢霉的微生物(可以是野生株,也可以是变异株)生产的糖质氧化酶,或者利用糖质氧化酶基因通过基因工程手法获得的糖质氧化酶。因此,由导入了从顶头孢霉获得的糖质氧化酶基因(或者改变了该基因的基因)的宿主微生物生产的重组体也相当于“来源于顶头孢霉的糖质氧化酶”。
59、作为可用于本技术的糖质氧化酶成为其来源的顶头孢霉的例子,可以列举acremonium chrysogenum nbrc30055(nite,日本)、atcc15006(atcc,美国)、dsm880(dsmz,德国)。
60、(j)氨基酸序列
61、对可用于本技术的糖质氧化酶的氨基酸结构没有限定,但若列举一个例子,可以由以下氨基酸序列特定。
62、具体地,可用于本技术的糖质氧化酶可以通过用序列号1表示的氨基酸序列特定。
63、在此,一般在对某个蛋白质的氨基酸序列的一部分实施了改变的情况下,有时改变后的蛋白质可以具有与改变前的蛋白质同等的功能。即,氨基酸序列的改变对蛋白质的功能没有实质性的影响,在改变前和改变后维持蛋白质的功能。因此,作为其他方案,本发明提供由氨基酸序列构成且具有糖质氧化酶活性的蛋白质,其中所述氨基酸序列是在由序列号1表示的氨基酸序列中缺失、取代和/或添加了一个至数个氨基酸的序列。“构成氨基酸序列的一个至数个氨基酸的缺失、取代和/或添加”通常是指氨基酸序列的一部分差异。
64、这里的氨基酸序列的差异是被允许的,只要可以保持糖质氧化酶活性即可(活性可以有一些变化)。只要满足该条件,氨基酸序列不同的位置没有特别限定,另外,也可以在多个位置产生不同。这里的多个是指例如与比总氨基酸序列的约30%小相应的数量,优选与比约20%小相应的数量,更优选与比约10%小相应的数量,进一步优选与比约5%小相应的数量,最优选与比约1%小相应的数量。
65、即,是指与序列号1的氨基酸序列具有例如约70%以上、优选约80%以上、更优选约90%以上、进一步优选约95%以上、最优选约99%以上的同一性。
66、另外,优选通过在糖质氧化酶活性不是必需的氨基酸残基中产生保守氨基酸取代来获得蛋白质的方法。这里的“保守氨基酸取代”是指将某个氨基酸残基取代为具有同样性质的侧链的氨基酸残基。氨基酸残基通过其侧链被分类为几个家族,如碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、β分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)、芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。保守氨基酸优选为同一家族内的氨基酸残基之间的取代。
67、然而,两个氨基酸序列或者两个核酸(以下,作为包含这些的术语使用“两个序列”)的同一性(%)例如可以通过以下顺序来确定。首先,排列两个序列,以便可以进行最佳的比较。此时,例如,可以向第一序列中导入间隙来优化与第二序列的对准。当第一序列的特定位置的分子(氨基酸残基或核苷酸)与第二序列中相应位置的分子相同时,可以说该位置的分子是相同的。两个序列的同一性是该两个序列共同的同一位置的数量的函数(即,同一性(%)=同一位置的数量/位置的总数×100),优选地还考虑优化对准所需的间隙的数量以及尺寸。
68、另外,两个序列的比较以及同一性的确定可以使用数学算法来实现。作为可利用于序列的比较的数学算法的具体例,有在karl in及altschul(1990)proc.natl.acad.sci.usa 87:2264-68中记载并在karl in及altschul(1993)proc.natl.acad.sci.usa 90:5873-77中修改的算法,但不限于此。这样的算法被编入在altschul等(1990)j.mol.biol.215:403-10中记载的nblast程序以及xblast程序(版本2.0)。为了获得与本发明的核酸分子等价的核苷酸序列,例如用nblast程序,设score=100、wordlength=12,进行blast核苷酸检索即可。
69、为了获得与本发明的多肽分子等价的氨基酸序列,例如用xblast程序,设score=50、wordlength=3,进行blast多肽检索即可。为了获得用于比较的间隙对准,可以利用在altschul等(1997)amino acids research25(17):3389-3402中记载的gapped blast。在利用blast以及gapped blast的情况下,可以使用相应程序(例如,xblast以及nblast)的默认参数。详见http://www.ncbi.nlm.nih.gov。
70、作为可用于序列比较的其他数学算法的例子,有在myers以及mi l ler(1998)comput appl biosci.4:11-17中记载的算法。这样的算法被编入例如可在genestream网络服务器(igh montpel l ier,法国)或者isrec服务器中利用的align程序。在使用align程序比较氨基酸序列的情况下,例如,可以利用pam120剩余底物量表,设定为间隙长度罚分=12、间隙罚分=4。
71、可用于本技术的糖质氧化酶可以是更大的蛋白质(例如融合蛋白质)的一部分。作为在融合蛋白质中所添加的序列,可列举例如多重组氨酸残基那样的有助于纯化的序列、确保重组生产时的稳定性的添加序列等。
72、可以通过基因工程的手法容易地制备具有上述氨基酸序列的蛋白质。例如,可以通过用编码本蛋白质的dna转化合适的宿主细胞(例如大肠杆菌、酵母、丝状菌)并回收在转化体中表达的蛋白质来制备。回收到的蛋白质根据目的适当地制备。如果以这种方式得到作为重组蛋白质的本蛋白质,则可以进行各种修饰。例如,如果将编码本蛋白质的dna和其他合适的dna插入同一载体,并使用该载体生产重组蛋白质,则可以得到由连接了任意肽或蛋白质的重组蛋白质构成的本蛋白质。另外,可以实施如发生糖链和/或脂质的添加、或者n末端或c末端的加工那样的修饰。通过如上所述的修饰,可以进行重组蛋白质的提取、纯化的简化、或者生物学功能的添加等。
73、糖质氧化酶作用工序的各种条件可以自由设定,只要不损害本技术的效果即可。例如,根据使用的糖质氧化酶的最适ph、稳定ph范围、最适温度、温度稳定性等理化性质,可以设定ph、温度、作用时间等。ph例如可以设定为ph4.0~8.0,优选ph4.5~7.5,更优选ph5.0~7.0。温度例如可以设定为20℃~60℃,优选25℃~55℃,更优选30℃~50℃。作用时间例如可以设定为10分钟~12小时,优选30分钟~6小时,更优选1小时~3小时。而且,最佳的反应条件可以通过初步实验确定。
74、糖质氧化酶作用工序中的糖质氧化酶的添加量可以自由设定,只要不损害本技术的效果即可。作为每1g植物性原料的用量,可列举例如0.1u以上。从进一步提高效果的观点出发,作为糖质氧化酶的每1g植物性原料的用量,可列举优选1u以上,更优选5u以上,还优选10u以上,进一步优选20u以上。作为糖质氧化酶的每1g植物性原料的用量范围的上限没有特别限定,但可列举例如300u以下、200u以下、100u以下,优选50u以下,更优选30u以下,还优选25u以下。
75、而且,在本技术中,糖质氧化酶的活性是利用后述的实施例中记载的葡萄糖氧化酶活性测定法测定的值。
76、只要不损害本技术的效果,则不限定进行糖质氧化酶作用工序的顺序,但优选在麦芽三糖生成酶作用工序之后或者与麦芽三糖生成酶作用工序同时进行。另外,在各酶作用工序之后,也可以进行酶的失活工序。
77、(4)α-淀粉酶
78、可用于本技术的α-淀粉酶是作用于淀粉并主要水解α-1,4糖苷键的酶。
79、可用于本技术的α-淀粉酶的来源没有特别限定,可列举例如来源于曲霉(aspergil lus)属、芽孢杆菌(baci l lus)属生物的α-淀粉酶,优选来源于芽孢杆菌属生物的α-淀粉酶,更优选来源于枯草芽孢杆菌(baci l lus subt i l is)、解淀粉芽孢杆菌(baci llus amylol iquefaciens)、地衣芽孢杆菌(baci l lus l icheniformis)的α-淀粉酶,还优选来源于解淀粉芽孢杆菌的α-淀粉酶。
80、α-淀粉酶作用工序的各种条件可以自由设定,只要不损害本技术的效果即可。例如,可以根据使用的α-淀粉酶的最适ph、稳定ph范围、最适温度、温度稳定性等理化性质设定ph、温度、作用时间等。ph例如可以设定为ph5.0~8.0,优选ph5.5~7.5,更优选ph6.0~7.0。温度例如可以设定为30℃~80℃,优选40℃~75℃,更优选50℃~70℃。作用时间例如可以设定为10分钟~12小时,优选30分钟~6小时,更优选1小时~3小时。而且,最佳的反应条件可以通过初步实验确定。
81、进行α-淀粉酶作用工序的顺序没有限定,只要不损害本技术的效果即可,优选在麦芽三糖生成酶作用工序之前或者与麦芽三糖生成酶作用工序同时进行。另外,可以在各个酶作用工序之后进行酶的失活工序。
82、(5)回收工序
83、回收工序是回收植物饮食品的工序,该植物饮食品是经过麦芽三糖生成酶作用工序、另外根据需要经过糖质氧化酶作用工序、α-淀粉酶作用工序等制造的饮食品。具体的回收方法根据要制造的植物性饮食品的种类,可以自由地组合使用一种或两种以上的一般植物性饮食品的制造中的回收方法。
84、经过麦芽三糖生成酶作用工序、根据需要经过糖质氧化酶作用工序、α-淀粉酶作用工序等制造的植物性饮食品的特征在于糖类(单糖类以及二糖类)降低。具体地,例如,每1ml或1g植物性饮食品中,植物性饮食品中的糖类(单糖类以及二糖类)的含量为20mg以下,优选15mg以下,更优选10mg以下,其中,该植物性饮食品经过麦芽三糖生成酶作用工序、根据需要经过糖质氧化酶作用工序、α-淀粉酶作用工序等制造。即,本技术中,可以进行回收植物性饮食品的回收工序,所述植物性饮食品是每1ml或1g植物性饮食品中糖类(单糖类以及二糖类)的含量为20mg以下,优选15mg以下,更优选10mg以下的饮食品。
85、另外,经过麦芽三糖生成酶作用工序、根据需要经过糖质氧化酶作用工序、α-淀粉酶作用工序等制造的植物性饮食品中,除了糖类(单糖类以及二糖类)降低以外,三糖类的量也增加。具体地,例如,每1ml或1g植物性饮食品中,经过麦芽三糖生成酶作用工序、根据需要经过糖质氧化酶作用工序、α-淀粉酶作用工序等制造的植物性饮食品中的三糖类的含量为8mg以上,优选15mg以上,更优选20mg以上。即,本技术中,可以进行回收植物性饮食品的回收工序,所述植物性饮食品是每1ml或1g植物性饮食品中三糖类的含量为8mg以上,优选15mg以上,更优选20mg以上的饮食品。
86、本技术所涉及的植物性饮食品的制造方法、以及植物性饮食品的糖类降低方法的一个方案包括以下工序(1)~(2)。此外,可以包括(3)。而且,在工序(2)或者(3)后,可以追加(4)使酶失活的工序、和/或、(5)回收糖类(单糖类以及二糖类)降低了的和/或三糖类的量增加了的植物性饮食品的工序。
87、(1)准备含有植物性糖质的原料的工序
88、(2)用麦芽三糖生成酶对准备的原料进行处理的工序
89、(3)用糖质氧化酶对用麦芽三糖生成酶处理的原料进行处理的工序
90、本技术所涉及的植物性饮食品的制造方法、以及植物性饮食品的糖类降低方法的一个方案包括以下工序(1)~(3)。另外,可以包括(4)。此外,在工序(2)、(3)或者(4)后,可以追加(5)使酶失活的工序,又可以追加(6)回收糖类(单糖类以及二糖类)降低了的和/或三糖类的量增加了的植物性饮食品的工序。
91、(1)准备含有植物性糖质的原料的工序
92、(2)用α-淀粉酶对准备的原料进行处理的工序
93、(3)用麦芽三糖生成酶对用α-淀粉酶处理的原料进行处理的工序
94、(4)用糖质氧化酶处理的工序
95、<2.糖类降低用酶剂>
96、本技术所涉及的糖类降低用酶剂含有麦芽三糖生成酶作为有效成分。另外,根据需要也可以含有糖质氧化酶和/或α-淀粉酶。麦芽三糖生成酶、糖质氧化酶以及α-淀粉酶的细节与前述的可用于植物性饮食品的制造方法的酶相同,因此在此省略其说明。
97、糖类降低用酶剂只要含有前述麦芽三糖生成酶,则可以仅由前述麦芽三糖生成酶构成,只要不损害本技术的效果,也可以自由地选择含有一种或两种以上的其他成分。作为其他成分,可以使用例如通常制剂化中使用的赋形剂、ph调节剂、着色剂、矫味剂、崩解剂、润滑剂、稳定剂等成分。进而,也可以根据适当的目的并用具有公知的或者将来将发现的功能的成分。
98、<3.低糖类植物性饮食品>
99、本技术所涉及的低糖类植物性饮食品是使用前述制造方法制造的植物性饮食品。作为植物性饮料的具体例子,列举燕麦饮料,更具体地,列举燕麦奶(也称为“oats milk”)。作为植物性食品的具体例子,列举植物性酸奶。
100、本技术所涉及的低糖类植物性饮食品中所含的糖类(单糖类以及二糖类)的量没有特别限定。例如,作为植物性饮食品中所含的糖类的量,在每1ml或1g植物性饮食品中为20mg以下,优选为15mg以下,更优选为10mg以下。
101、本技术所涉及的低糖类植物性饮食品,可列举除了糖类(单糖类以及二糖类)降低以外,三糖类的量增加的饮食品。通过三糖类的增加,可以赋予适度的甜味。本技术所涉及的低糖类植物性饮食品中所含的三糖类的量也没有特别限定。例如,作为植物性饮食品中所含的三糖类的量,在每1ml或1g植物性饮食品中为8mg以上,优选为15mg以上,更优选为20mg以上。
102、另外,三糖类相对于糖类(单糖类+二糖类)的比率(三糖类/糖类(单糖类+二糖类))也没有特别限定,但是为了获得糖类降低效果和甜味增强效果的双方,例如为0.5以上,优选为0.8以上,更优选为1以上,进一步优选为2以上。
103、而且,本技术中,可以采用以下构成。
104、[1]一种植物性饮食品的制造方法,包括使麦芽三糖生成酶作用于植物性原料的工序。
105、[2]根据[1]所述的植物性饮食品的制造方法,其中,植物性原料是经α-淀粉酶处理的原料。
106、[3]根据[1]或者[2]所述的植物性饮食品的制造方法,其还包括使糖质氧化酶作用于植物性原料的工序。
107、[4]根据[1]至[3]中的任一项所述的植物性饮食品的制造方法,其中,植物性饮食品是燕麦奶。
108、[5]一种包含麦芽三糖生成酶的糖类降低用酶剂。
109、[6]根据[5]所述的糖类降低用酶剂,其还包含糖质氧化酶。
110、[7]一种植物性饮食品的糖类降低方法,包括使麦芽三糖生成酶作用于植物性原料的工序。
111、实施例
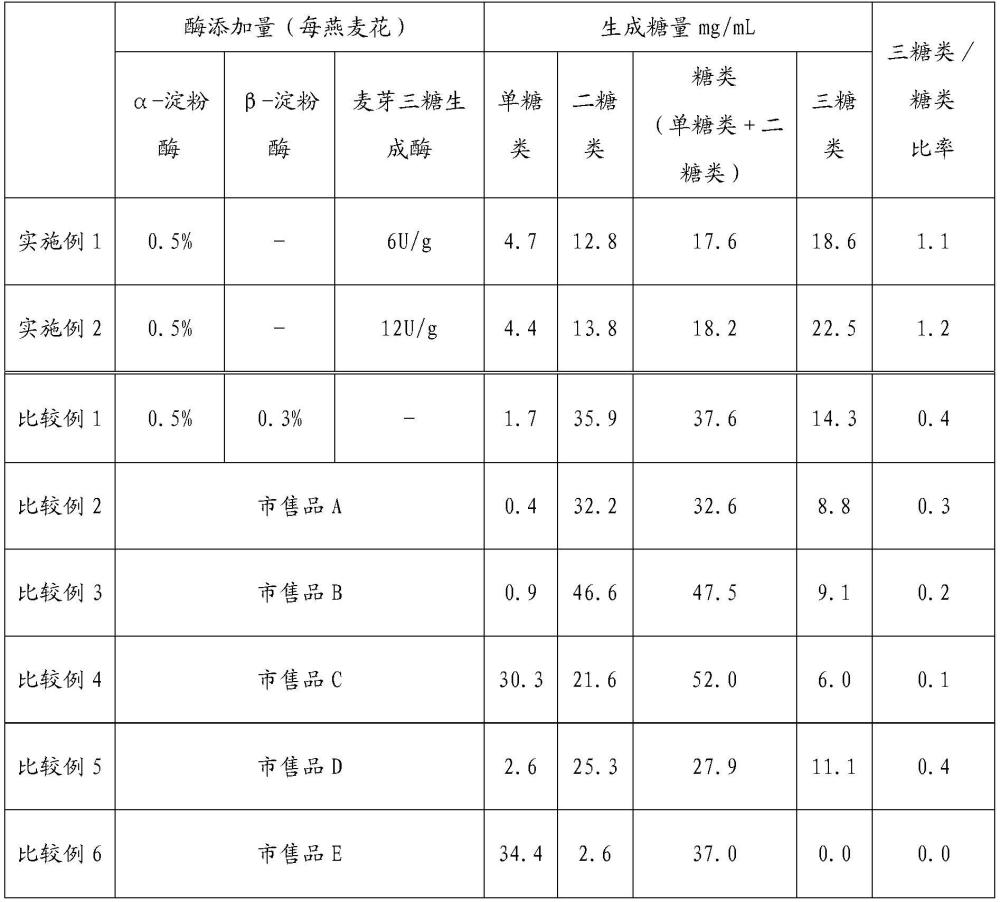
112、以下,基于实施例对本发明进行更详细地说明。而且,在下面说明的实施例示出本发明的代表性实施例的一个例子,不应由此狭义地解释本发明的范围。
113、1.使用的酶
114、(1)α-淀粉酶:“中温淀粉酶sd8(kleistase sd8)”(天野酶制品株式会社制,来源于baci l lus amylol iquefaciens的α-淀粉酶)
115、(2)β-淀粉酶:“β-淀粉酶f‘amano’”(天野酶制品株式会社制,来源于baci l lusflexus的β-淀粉酶)
116、(3)麦芽三糖生成酶:“amt1.2l”天野酶制品株式会社制,来源于microbacteriumsp.的麦芽三糖生成酶)
117、(4)糖质氧化酶:本实施例中,作为糖质氧化酶的一个例子,使用了通过wo2014/042237中记载的方法纯化的糖质氧化酶(来源于acremoniumchrysogenum)。
118、2.酶活性的测定方法
119、[淀粉糖化力活性定法:麦芽三糖生成酶的活性测定方法]
120、使酶作用于作为底物的可溶性淀粉,通过somogyi-nelson比色法对所生成的还原糖进行了比色定量。
121、取0.5ml的可溶性淀粉溶液以及0.4ml的0.1mol/l乙酸/乙酸钠缓冲液(ph6.0)(包含0.05mol/lcacl2)到50ml奈斯勒比色管,充分摇混,在40±0.5℃下放置10~15分钟后,加入试样溶液0.1ml,立即摇混。将该液体在40±0.5℃下精确放置15分钟后,加入1ml碱性铜试液,摇混,堵住,在沸水浴中精确加热20分钟,立即冷却。冷却后,加入1ml的nelson液体,充分摇混,直至氧化亚铜的红色沉淀完全溶解,在室温下放置20分钟,加入22ml的水,充分摇混。对于该液体,以水为对照测定了波长520nm下的吸光度。将一分钟内生成相当于1μmol葡萄糖的还原糖时作为一个单位。
122、[葡萄糖氧化酶活性测定法:糖质氧化酶的活性测定方法]
123、称取适量的酶,加入冷却后的ph7.0的磷酸钾/氢氧化钠缓冲液(0.1mol/l),溶解或分散均匀并制成50ml,将其作为试样液。取2.50g的d(+)-葡萄糖,加水溶解并制成25ml,将其作为底物溶液。将0.5ml的底物溶液、2ml的磷酸钾/氢氧化钠缓冲液(0.1mol/l、ph7.0、苯酚含有)、0.5ml的过氧化物酶试液(25单位/ml)以及0.1ml的4-氨基安替比林溶液(1→250)加入到石英池,在37℃下加热10分钟。在该液体中加入0.1ml的试样液,充分混合,在37℃下加温,获得试液。另外,代替试样液使用ph7.0的磷酸钾/氢氧化钠缓冲液(0.1mol/l)或者水来进行与试液的制备同样的操作,获得比较液。对于试液及比较液,测定了在添加试样液2分钟后以及5分钟后的500nm波长下的吸光度。从生成的醌亚胺色素的摩尔吸光系数定量氧化后的葡萄糖的量。在该条件下,将在1分钟内氧化1μmol的葡萄糖所需的酶量作为一个单位。
124、3.实验例
125、<实验例1>
126、实验例1中,研究了麦芽三糖生成酶带来的糖类降低效果。
127、(1)实验方法
128、称取12.5g燕麦花(慢食厨房ptemium oat flour)到烧杯,加水至液体量成为100ml。向其中加入0.5(w/w燕麦花)%的α-淀粉酶,每1g燕麦花加入12u麦芽三糖生成酶,放入60℃水浴中,在溶液的温度达到60℃后,静置了2小时。然后,放入沸水浴中静置10分钟,使酶失活,制备了燕麦花饮料。用β-淀粉酶0.3(w/w燕麦花)%置换麦芽三糖生成酶,并将其作为对照。
129、称取制备的燕麦花饮料1.5ml到样品管中,添加190μl的1mol/l三氯乙酸,在室温中静置10分钟。离心分离(10000rpm、10min),并回收1ml的上清到样品管中。向其中加入1ml乙醚(fujifilm试剂特级)并进行混合,通过离心分离回收1ml水层,重复该作业两次。
130、在回收的水槽中等量加入乙醇(99.5)(fujifilm试剂特级),并将其作为分析用样品。
131、使用mcl gel ck04s柱(三菱化学社制)对分析样品进行了由hplc生成的糖的分析。为了进行比较,也分析了市售的燕麦奶的糖量。
132、(2)结果
133、结果示于表1。
134、[表1]
135、
136、(3)考察
137、如表1所示,经过β-淀粉酶处理的燕麦花饮料以及市售的燕麦奶的糖类含量均在27mg/ml以上。另一方面,确认到通过使用麦芽三糖生成酶,可以使糖类的量为20mg/ml以下。
138、<实验例2>
139、实验例2中,确认到糖质氧化酶带来的糖类降低效果。
140、(1)实验方法
141、按照实施例1的方法,制备使用麦芽三糖生成酶的燕麦花饮料,称取200ml,放入500ml容量的三角烧瓶。以葡萄糖氧化酶的活性成为600单位的方式向其中添加来源于acremonium chrysogenum的糖质氧化酶,将三角烧瓶放入40℃水浴中,以2mm直径的管边送入适度的空气边搅拌,使其反应2小时。将酶反应后的燕麦花饮料放入沸水浴中,静置10分钟,使酶失活。对失活后的燕麦花饮料进行既定的处理,使用icsep ice-ion-300column(transgenomic inc.,new haven,ct,usa)分析由hplc生成的糖。
142、(2)结果
143、结果如表2所示。
144、[表2]
145、
146、(3)考察
147、如表2所示,确认到通过进一步使糖质氧化酶作用于麦芽三糖生成酶处理过的燕麦花饮料,可以进一步降低糖类。
148、<实验例3>
149、实验例3中,在麦芽三糖生成酶作用工序之前进行α-淀粉酶作用工序的情况下,进一步确认到在改变各种酶作用条件的情况下的效果。
150、(1)实验方法
151、称取12.5g燕麦花(慢食厨房ptemium oat flour)到烧杯并加水,使得液量为100ml。向其中加入0.5(w/w燕麦花)%的α-淀粉酶,放入60℃水浴中,溶液的温度达到60℃后,静置2小时。然后,放入煮沸水中静置10分钟,使酶失活,制备燕麦花饮料原料。向燕麦花饮料原料加入每1g燕麦花1.2~120u的麦芽三糖生成酶,放入到40℃或者50℃水浴中,溶液的温度达到60℃后,静置1~3小时。然后,放入沸水浴中,静置10分钟,使酶失活,制备燕麦花饮料。
152、称取制备的燕麦花饮料1.5ml到样品管中,添加190μl的1mol/l三氯乙酸,在室温中以室温静置10分钟。离心分离(10000rpm、10min),并回收1ml上清到样品管中。向其中添加1ml乙醚(fujifilm试剂特级)并混合,通过离心分离回收1ml水层,重复该作业两次。
153、在回收到的水槽中等量加入乙醇(99.5)(fujifilm试剂特级),将其作为分析用样品。
154、使用mcl gel ck04s柱(三菱化学社制)对分析样品进行了由hplc生成的糖的分析。为了进行比较,分析了市售的燕麦奶的糖量。
155、(2)结果
156、结果如表3以及表4所示。
157、[表3]
158、
159、[表4]
160、
161、(3)考察
162、如表3和表4所示,即使在α-淀粉酶处理后进行了麦芽三糖生成酶处理的情况下,也可以确认到糖类降低效果。另外,即使在改变麦芽三糖生成酶的添加量、处理温度、处理时间的情况下,也可以确认到糖类降低效果。
本文地址:https://www.jishuxx.com/zhuanli/20240614/99425.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表