一种轴手性联烯基黄酮类衍生物及制备方法
- 国知局
- 2024-06-20 10:29:39
本技术涉及一种轴手性联烯基黄酮类衍生物及制备方法,属于不对称催化合成。
背景技术:
1、众所周知,手性联烯在自然界中分布很广。据不完全统计,目前己经分离得到的含手性联烯骨架的天然产物多达150多种。手性联烯骨架广泛存在于天然产物和药物分子中,并且手性联烯化合物越来越多地被用作构建结构复杂的有机产物的基础原料。因此如何简单有效的合成联烯特别是手性的联稀化合物越来越受到有机化学家们的关注。目前研究较多的是轴手性联烯的合成,主要有三种方法:1)消旋联烯化合物的拆分;2)手性炔丙基化合物的转化;3)不对称催化。过渡金属催化的不对称联烯基化反应是快速构建轴手性联烯的一种方法,选择恰当的底物可以合成同时含有中心手性和联烯轴手性的环状化合物(参考文献一:(a)wang,g.;liu,x.;chen,y.;yang,j.;li,j.;lin,l.;feng,x.acs catal.2016,6,2482-2486.(b)xu,g.;wang,z.;shao,y.;sun,j.org.lett.2021,23,5175-5179.(c)zhang,j.;huo,x.;xiao,j.;zhao,l.;ma,s.;zhang,w.j.am.chem.soc.2021,143,12622-12632.(d)lin,x.;shen,b.;wang,z.;cheng,y.;chen,x.;li,p.org.lett.2022,24,4914-4918.)。
2、手性苯并二氢吡喃核心部分广泛分布在许多天然存在的化合物中,其中许多具有显着的生物学特性,包括抗癌,抗肿瘤,抗菌,抗微生物,抗氧化剂,雌激素和抗雌激素特性等。因此,含有手性苯并二氢吡喃核心部分骨架化合物的合成引起了广泛的关注,并发展了各种方案。(参考文献二:(a)reddy,k.a.;lohray,b.b.;bhushan,v.;reddy,a.s.;mamidi,n.v.s.r.;reddy,p.p.;saibaba,v.;reddy,n.j.;suryaprakash,a.;misra,p.;vikramadithyan,r.k.;rajagopalan,r.j.med.chem.1999,42,3265-3278.(b)nibbs,a.e.;scheidt,k.a.eur.j.org.chem.2012,449-462)。黄酮类化合物在碱性条件下易于通过逆氧杂迈克尔加成过程从环状结构转变为链性结构,这就导致立体中心快速消旋化。利用其结构发生逆氧-迈克尔加成过程同时消旋化两个立体中心,经过动态动力学拆分则可为一次构建含有多个手性中心的手性苯并二氢吡喃衍生物提供了另一种方便的途径。
技术实现思路
1、本技术的目的是提供一种通过动态动力学拆分合成含有轴手性联烯骨架的黄酮基类衍生物的方法,通过逆氧杂迈克尔加成过程结合不对称联烯烷基化反应实现2,3-二取代黄酮类化合物的动态动力学拆分,以及构建具有高光学纯度的含有多个手性中心(包括一个季碳手性中心以及轴手性中心)的黄酮类衍生物。
2、本技术在碱性条件下,通过逆氧-迈克尔加成过程,将2,3-二取代黄酮类化合物和联烯基碳酸酯类化合物发生不对称联烯烷基化反应,实现动态动力学拆分且以高对映和非对映选择性合成含有多个手性中心(包括一个季碳手性中心以及轴手性中心)的黄酮类衍生物。
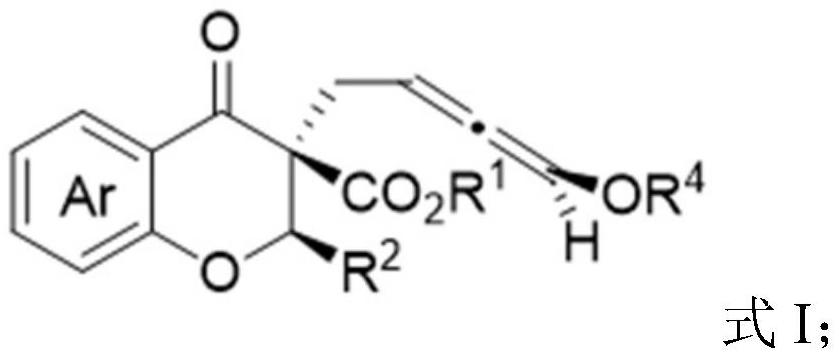
3、根据本技术的一个方面,提供了一种轴手性联烯基黄酮类衍生物,所述轴手性联烯基酮类衍生物选自具有式i所示结构中的至少一种:
4、
5、r1选自甲基、乙基、异丙基、叔丁基、环己基、苄基中的一种;
6、r2选自甲基、苯基、取代苯基中的一种;所述取代苯基的取代基选自甲基、甲氧基、氟、氯、溴中的至少一种;
7、r4选自甲基氧羰基、乙基氧羰基、异丙基氧羰基、苯基氧羰基、苄基氧羰基、乙酰基、二乙基膦酰基中的一种;
8、ar为苯环或取代芳环;所述取代芳环的取代基选自甲基、氯、硝基中的至少一种。
9、可选地,所述轴手性联烯基酮类衍生物选自3aa、3ba、3ca、3da、3ea、3fa、3bb、3bc、3bd、3be、3bf、3bg、3bh、3bi、3bj、3bk、3gd、3hd、3id、3jd、3kd、3ld、3md、3nd、3od、3pd、3qj所示结构中的任一种;
10、
11、根据本技术的另一个方面,提供一种上述所述的轴手性联烯基黄酮类衍生物的制备方法,
12、将含有2,3-二取代黄酮类化合物、联烯基碳酸酯类化合物、促进剂、催化剂的混合物,反应,得到轴手性联烯基黄酮类衍生物;
13、所述2,3-二取代黄酮类化合物选自式ii所示结构中的一种;
14、所述联烯基碳酸酯类化合物选自式iii所示结构中的一种;
15、
16、式ii中,r1选自甲基、乙基、异丙基、叔丁基、环己基、苄基中的一种;
17、r2选自甲基、苯基、取代苯基中的一种;
18、式iii中,r3选自甲基、萘基、噻吩基、苯基、取代苯基中的一种;
19、所述取代苯基的取代基选自甲基、甲氧基、氟、氯、溴中的至少一种;
20、r4为甲基氧羰基、乙基氧羰基、异丙基氧羰基、苯基氧羰基、苄基氧羰基、乙酰基、二乙基膦酰基中的一种;
21、ar为苯环或取代芳环;所述取代芳环的取代基选自甲基、氯、硝基中的至少一种。
22、可选地,所述促进剂包括有机碱和/或无机碱。
23、可选地,所述有机碱选自叔丁醇钾、1,5-二氮二环[5.4.0]-5-十一烯、1,5-二氮杂双环[4.3.0]壬-5-烯、四甲基胍中的至少一种。
24、可选地,所述无机碱选自碳酸铯和/或三乙胺。
25、可选地,促进剂选自叔丁醇钾、碳酸铯、1,5-二氮二环[5.4.0]-5-十一烯(dbu)、1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)、三乙胺、四甲基胍中的至少一种。
26、可选地,所述促进剂与所述2,3-二取代黄酮类化合物的摩尔比为0.2:1~1.5:1。
27、可选地,所述联烯基碳酸酯类化合物与所述2,3-二取代黄酮类化合物的摩尔比为1.2:1~1.5:1。
28、可选地,所述催化剂为钯的手性双磷配合物,所述钯的手性双磷配合物包括金属钯和手性双膦配体。
29、可选地,所述金属钯与2,3-二取代黄酮类化合物的摩尔比为0.05:1~0.15:1。
30、可选地,金属单体钯使用量和2,3-二取代黄酮类化合物的摩尔比为0.1:1
31、可选地,所述手性双膦配体与2,3-二取代黄酮类化合物的摩尔比为0.055:1~0.17:1。
32、可选地,所述金属钯的金属钯前体选自氯化烯丙基钯(ii)二聚物([pd(η3-c3h5)cl]2)、三(二亚苄基丙酮)二钯(pd2(dba)3)、双(二亚芐基丙酮)钯(pd(dba)2)、醋酸钯(pd(oac)2)、三氟乙酸钯中的至少一种。
33、可选地,所述手性双膦配体选自(r)-5,5'-双[二(3,5-二-t-丁基-4-甲氧基苯)磷]-4,4'-二-1,3-苯二恶唑[(r)-dtbm-segphos]、(s)-5,5'-双[二(3,5-二-t-丁基-4-甲氧基苯)磷]-4,4'-二-1,3-苯二恶唑[(s)-dtbm-segphos]、(r)-2,2'-双[双(3,5-二-叔-丁基苯基-4-甲氧基)膦基]-4,4',6,6'-四甲氧基联苯[(r)-dtbm-garphos]、(s)-2,2'-双[双(3,5-二-叔-丁基苯基-4-甲氧基)膦基]-4,4',6,6'-四甲氧基联苯[(s)-dtbm-garphos]、(r)-(6,6'-二甲氧基联苯-2,2'-二基)二[双(3,5-二-叔丁基-4-甲氧苯基)膦[(r)-dtbm-meo-biphep]、(s)-(6,6'-二甲氧基联苯-2,2'-二基)二[双(3,5-二-叔丁基-4-甲氧苯基)膦[(s)-dtbm-meo-biphep]、(r)-2,2'-双[二(3,5-二叔丁基苯基)磷]-6,6'-二甲氧基-1,1'-联苯[(r)-2,2'-bis[di(3,5-di-t-butylphenyl)phosphino]-6,6'-dimethoxy-1,1'-biphenyl]、(s)-2,2'-双[二(3,5-二叔丁基苯基)磷]-6,6'-二甲氧基-1,1'-联苯[(s)-2,2'-bis[di(3,5-di-t-butylphenyl)phosphino]-6,6'-dimethoxy-1,1'-biphenyl]中的至少一种。
34、可选地,所述催化剂的制备方法为:氮气保护下,将钯的金属前体和手性双膦配体在有机溶剂溶解,并室温搅拌30~60分钟。
35、可选地,所述混合物中还包括添加剂,所述添加剂为分子筛,所述分子筛为分子筛。
36、可选地,所述分子筛的质量与所述2,3-二取代黄酮类化合物的摩尔比为250mg:1mmol~500mg:1mmol。
37、可选地,所述混合物中还包括溶剂,所述溶剂选自1,2-二氯乙烷、乙酸乙酯、氯苯、四氢呋喃、1,4-二氧六环、乙二醇二甲醚、2-甲基四氢呋喃、甲苯、三氟甲苯、n,n-二甲基甲酰胺中的至少一种;
38、可选地,所述2,3-二取代硫代黄酮类化合物与所述溶剂的摩尔体积比为0.05mol/l~0.2mol/l。
39、可选地,所述有机溶剂用量为每0.1毫摩尔2,3-二取代黄酮类底物1毫升;所述有机溶剂分两次加入,制备催化剂过程中第一次加入有机溶剂,合成产物过程中第二次加入有机溶剂,第一次加入溶剂与第二次加入有机溶剂的体积比为1:1。
40、可选地,所述反应的温度为-20~30℃,反应的时间为24~120h。
41、可选地,所述反应的温度选自-20℃、-10℃、0℃、10℃、20℃、30℃中的任意值或上述任意两点间的范围值。
42、可选地,所述反应的时间选自24h、36h、48h、60h、72h、84h、96h、108h、120h中的任意值或上述任意两点间的范围值。
43、作为一个具体的实施方式,本技术通过下述技术方案实现:
44、本技术提供了一种通过动态动力学拆分合成含有轴手性联烯骨架的黄酮基类衍生物的方法,是2,3-二取代黄酮类化合物的动态动力学拆分过程,以及为合成具有高光学纯度的含有多个手性中心(包括一个季碳手性中心以及轴手性中心)的黄酮类衍生物提供了一个新途径,所述方法以钯的手性双磷配合物为催化剂,以2,3-二取代黄酮类化合物和联烯基碳酸酯类化合物为底物,碱为促进剂,通过碱促进的动态动力学拆分过程构建了具有高光学纯度的含有多个手性中心(包括一个季碳手性中心以及轴手性中心)的黄酮类衍生物的方法。所述方法的反应式如下:
45、
46、式中:
47、r1为甲基,乙基,异丙基,叔丁基,环己基或苄基;
48、r2为甲基,苯基或含取代基的苯基,苯环上取代基为甲基、甲氧基、氟、氯、溴中的一种;
49、r3为甲基,萘基,噻吩基,苯基或含取代基的苯基,苯环上取代基为甲基、甲氧基、氟、氯、溴中的一种;
50、r4为甲基氧羰基,乙基氧羰基,异丙基氧羰基,苯基氧羰基,苄基氧羰基、乙酰基或二乙基膦酰基中的一种;
51、ar为苯环或含有取代基的芳环,所述的取代基为甲基、氯或硝基中的一种;
52、碱为有机碱或无机碱;
53、所述催化剂为金属钯前体和双膦配体的配合物。
54、可选地,所述方法的具体反应步骤为:在氮气保护下,向schlenk管中加入金属钯前体和手性双膦配体,然后加入有机溶剂,于室温搅拌反应30~60min后,氮气下加入2,3-二取代黄酮类化合物、碱、添加剂、联烯基碳酸酯类化合物和有机溶剂(两次的有机溶剂的种类相同),于-20~30℃搅拌反应24~120h后,抽干溶剂,柱层析分离得到纯的手性黄酮类衍生物。
55、可选地,在氮气保护下,向schlenk管中加入金属钯前体(0.02mmol)和手性双膦配体(0.0022mmol),然后加入有机溶剂(1.0ml),于室温搅拌反应30min后,氮气下加入黄酮类化合物(0.2mmol)、碱(0.24mmol)、添加剂(50mg)、烯丙基碳酸酯类化合物(0.3mmol)和有机溶剂(1.0ml),于-20~30℃搅拌反应24~120h后,抽干溶剂,柱层析分离得到纯的手性黄酮类衍生物。
56、可选地,当r1为甲基,r2为苯基,r3为间甲基苯基,r4为乙氧羰基,所述的催化剂为二(二亚苄基丙酮)钯(pd(dba)2)和(r)-dtbm-garphos形成的配合物,有机溶剂为四氢呋喃,温度为-20℃,碱为1,5-二氮二环[5.4.0]-5-十一烯(dbu),添加剂为分子筛,反应时间72h,反应结果最佳。
57、在本技术中,术语“甲基氧羰基”、“乙基氧羰基”、“异丙基氧羰基”、“苯基氧羰基”、“苄基氧羰基”是指通过羰基与母体分子部分连接的甲基氧、乙基氧、异丙基氧、苯基氧、苄基氧。
58、在本技术中,术语“甲基”、“苯基”、“萘基”、“噻吩基”是指由甲烷、苯、萘、噻吩分子上失去任意一个氢原子所形成的基团。
59、本技术能产生的有益效果包括:
60、1)本技术方法可以实现黄酮类衍生物的联烯烷基化,以及高收率的得到具有光学纯度的含季碳以及联烯的黄酮类衍生物(对映体过量可达99%,非对映体比例可达24/1)。本发明具有高度的对映选择性和非对映选择性,操作简便实用,原料易得,催化剂商业可得,反应条件温和,能耗低,环境友好且产率好。
61、2)本技术明原料简单易得,操作简单,反应条件温和,环境友好绿色;反应活性高,原料转化完全,分离方便,能获得高纯度的产物;立体选择性好,能高对映选择性和非对映选择性获得光学纯的产物。
本文地址:https://www.jishuxx.com/zhuanli/20240619/120.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表