基于细菌裂解、等温扩增和CRISPR检测的一步法、可视化细菌检测方法及系统
- 国知局
- 2024-06-20 11:19:26
本发明涉及生物检测,特别涉及一种基于细菌裂解、等温扩增和crispr检测的一步法、可视化细菌检测方法及系统。
背景技术:
1、金黄色葡萄球菌是导致医院和社区获得性感染的重要病原体之一,可引起皮肤脓肿、心内膜炎和败血症等多种感染。其中,与甲氧西林敏感的金葡菌(mssa)相比,由耐甲氧西林金葡菌(mrsa)引起的感染更为复杂,死亡率更高。诊断的延误是耐甲氧西林金黄色葡萄球菌感染引起死亡的主要原因,尽快检测出耐甲氧西林金黄色葡萄球菌可以有效的阻止感染的进一步恶化,因此早期、快速、灵敏的检测手段尤为重要。因此,耐甲氧西林金黄色葡萄球菌的早期诊断作为阻断感染的必要条件,我们迫切需要找到更敏感、特异高且成本较低的耐甲氧西林金黄色葡萄球菌实验室检测手段,以期通过早发现、早诊断、进一步的针对性的规范化治疗,及早消除由耐甲氧西林金黄色葡萄球菌引发的细菌感染。
2、近年来,crispr技术不仅在识别和切割特定dna和rna序列方面表现出出色的基因编辑能力,而且在核酸检测领域也显示出巨大的潜力。其中,crispr/cas12a与crrna结合形成cas12a-crrna复合物,识别富含胸腺嘧啶(thymine,t)核苷酸的间隔区相邻基序(pam),促进dna双解绕,切割与crrna互补配对的双链dna(dsdna),激活cas12a对非特异性单链dna(ssdna)的反式切割活性。目前,crispr/cas12a已转化为多种生物分析检测平台,应用于病原菌、转基因作物、sars-cov-2和其他致病性病毒的检测,表现出优异的性能。然而,这些方法的读数主要基于荧光和电化学信号,严重依赖专业操作和精密仪器(如荧光读取器和电化学工作站),这给实际检测带来了不便,降低了其在基层监测中的性能。因此,迫切需要一些便携式信号输出方法来提高crispr/cas12a检测平台的便利性。
3、免疫层析试纸条携带方便,操作简单,不需要任何设备,在核酸检测中得到了广泛的应用。但基于核酸扩增的试纸条一般采用环介导等温扩增(loop-mediated isothermalamplification,lamp)或重组酶聚合酶扩增(recombinase polymerase amplification,rpa)获得的扩增子作为连接介质,容易受到非特异性扩增片段的影响,产生假阳性。基于crispr/cas12a的高特异性和敏感性,结合免疫层析试纸条的crispr/cas系统可以解决目前的局限性。
4、所以,现在有必要对现有技术进行改进,以提供更可靠的方案。
技术实现思路
1、本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种基于细菌裂解、等温扩增和crispr检测的一步法、可视化细菌检测方法及系统。本发明开发了一种适用于crispr检测系统的免疫层析试纸条,可以对细菌实现可视化检测。本发明将细菌裂解、核酸等温扩增、crispr-cas12a检测、试纸条信号输出相结合,建立了便捷的检测平台。在本发明的方法中,将细菌的裂解、特异性基因的恒温扩增和特异性基因的crispr-cas12a检测整合至同一反应体系内、同一温度下进行,并且通过免疫层析试纸条进行信号输出。本发明所开发的crispr-免疫层析试纸条检测平台具有特异性强、灵敏度高、效率高、便携性好等优点,在居家检测应用中具有很大的潜力。
2、为解决上述技术问题,本发明采用的技术方案是:一种基于细菌裂解、等温扩增和crispr检测的一步法、可视化细菌检测方法,该方法用于耐甲氧西林金葡菌的检测,该方法包括以下步骤:
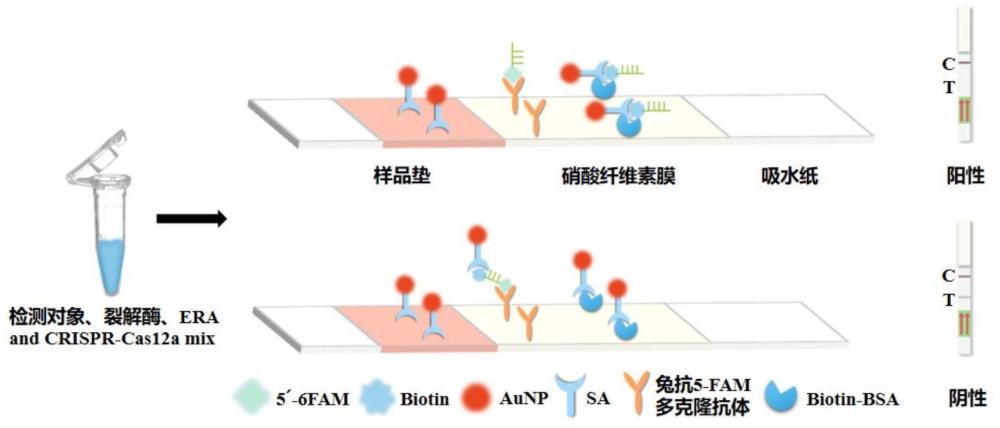
3、s1、提供免疫层析试纸条,其包括沿液体流动方向依次设置的样品垫、检测线和质控线,所述检测线上修饰有第一特异性捕获体并添加有链霉亲和素-胶体金标记物aunp-sa,所述质控线上修饰有第二特异性捕获体;
4、s2、提供检测反应体系,该检测反应体系包括裂解酶、等温扩增子体系和crispr-cas12a检测子体系;其中,crispr-cas12a检测子体系中的ssdna的两端分别修饰有能被第一特异性捕获体捕获的第一标志物和能被第二特异性捕获体捕获的第二标志物,所述第二标志物能够与aunp-sa结合;
5、s3、将待测样品加入检测反应体系中进行等温扩增,反应结束后将产物溶液滴加到免疫层析试纸条的样品垫上,根据检测线和质控线的颜色判断待测样品中是否存在耐甲氧西林金黄色葡萄球菌:
6、当存在耐甲氧西林金黄色葡萄球菌时,由crrna引导的cas12a酶能够特异性识别并切割带pam的dsdna靶标,并且激活针对ssdna的反式切割活性,对ssdna进行非特异性切割,形成只修饰有第一标志物的第一子ssdna和只修饰有第二标志物的第二子ssdna,产物溶液滴加到样品垫上后,aunp-sa与第二子ssdna结合,形成的结合物被质控线上的第二特异性捕获体捕获,从而使质控线呈红色,而检测线不显色;
7、当不存在耐甲氧西林金黄色葡萄球菌时,ssdna未被切割使得其上同时保留有修饰的第一标志物和第二标志物,产物溶液滴加到样品垫上后,ssdna与aunp-sa结合,形成的结合物随后被检测线上的第一特异性捕获体捕获而使检测线呈红色,检测线上剩余的aunp-sa继续向前流动,随后被质控线上的第二特异性捕获体捕获而使质控线呈红色。
8、优选的是,所述第一标志物为6-羧基荧光素fam,所述第二标志物为生物素biotin;所述第一特异性捕获体为兔抗5-fam多克隆抗体,所述第二特异性捕获体为biotin-bsa。
9、优选的是,所述等温扩增子体系采用era等温扩增方法。
10、优选的是,步骤s3中等温扩增的温度为37℃,反应时间为45min。
11、优选的是,所述aunp-sa通过以下方法制备得到:
12、1)向胶体金溶液中加入k2co3溶液、链霉亲和素,混匀,避光反应;
13、2)向步骤1)的产物中加入bsa溶液,混匀,封闭;
14、3)将步骤2)所得溶液离心,弃去上清液,再加入复溶液,得到链霉亲和素-胶体金标记物aunp-sa;其中,所述复溶液包括tris-hcl溶液、bsa和蔗糖。
15、优选的是,所述aunp-sa通过以下方法制备得到:
16、1)移取1ml粒径20nm、浓度为0.05mg/m的胶体金溶液于离心管中,加入4μl浓度为0.2m的k2co3溶液、10μl浓度为1mg/ml的链霉亲和素,混匀,避光反应30min;
17、2)向步骤1)的产物中加入100μl质量分数为10%的bsa溶液,混匀,封闭30min;
18、3)将步骤2)所得溶液在4℃条件下以10000rpm的转速离心30min,弃去上清液,再加入100μl的复溶液(50mm tris-hcl溶液(ph=8.5)+1%bsa+10%蔗糖),得到链霉亲和素-胶体金标记物aunp-sa;其中,所述复溶液包括浓度为50mm且ph=8.5的tris-hcl溶液、质量分数为1%的bsa和质量分数为10%的蔗糖。
19、优选的是,所述免疫层析试纸条通过以下方法制备得到:在硝酸纤维素膜上涂覆兔抗5-fam多克隆抗体作为检测线、涂覆biotin-bsa作为质控线,在37℃烘箱中干燥,然后将样品垫、硝酸纤维素膜和吸水纸依次黏贴在背板上,将aunp-sa滴加在检测线上,得到所述免疫层析试纸条。
20、优选的是,所述等温扩增子体系包括用于扩增耐甲氧西林金葡菌的meca基因的引物组,包括引物meca-era-pf和引物meca-era-pr,核酸序列依次如seq no.2和seq no.3所示。
21、优选的是,crispr-cas12a检测子体系包括cas12a、crrna和ssdna,crrna的序列如seq no.1所示,ssdna的序列为5’-6fam-ttatt-biotin-3’。
22、本发明还提供一种基于细菌裂解、等温扩增和crispr检测的一步法、可视化细菌检测系统,其采用如上所述的方法进行耐甲氧西林金葡菌的检测,该系统包括所述免疫层析试纸条和所述检测反应体系。
23、本发明的有益效果是:
24、(1)本发明提供一种基于细菌裂解、等温扩增和crispr检测的一步法、可视化细菌检测方法及系统,本发明通过特异性裂解酶、era扩增及crrna识别三重特异地对病原菌进行检测,采用免疫层析试纸条进行可视化信号输出,通过具体实施案例(耐甲氧西林金黄色葡萄球菌)验证了这一方法的可行性,本发明为病原菌的可视化检测提供了一种成本低廉、操作便捷、特异性强的方法;
25、(2)本发明提出的crispr-免疫层析试纸条检测平台与其他依赖荧光和电化学信号等方式的crispr生物分析检测平台相比,不需要荧光读取器和电化学工作站等精密仪器,通过裸眼观察即可进行判读,具有成本低、操作便捷的特点;与基于lamp、rpa的试纸条相比,特异性更强,能有效避免假阳性;
26、(3)本发明提出的基于细菌裂解、等温扩增和crispr检测一步法的可视化直接检测方法不需要额外的基因组dna提取过程,具有操作简单、成本低、耗时少、灵敏度高和特异性强等特点,扩增反应在37℃等温环境下进行,可以有效脱离对实验室大型仪器的依赖,满足居家检测的要求。
本文地址:https://www.jishuxx.com/zhuanli/20240619/1389.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。