一种基于外泌体mRNA的前列腺癌早期诊断标志物及其应用的制作方法
- 国知局
- 2024-09-05 14:35:19
本发明涉及一种诊断标志物,尤其涉及一种基于外泌体mrna的前列腺癌早期诊断标志物及其应用。
背景技术:
1、前列腺癌(prostate cancer,pca)是一种严重威胁男性健康的恶性肿瘤,居全球男性恶性肿瘤发病率第2位。
2、目前,前列腺穿刺活检是确诊前列腺癌的金标准,但活检为有创检查,会引起血尿、感染、败血症等一系列后遗症。影像学检查可发现较大的肿瘤,对于微小病灶的诊断能力有限,且无法做出明确诊断。直肠指检可发现前列腺结节,但对于移行区的肿瘤,指检难以发现。前列腺特异性抗原(prostate specific antigen,psa)是前列腺癌诊断的通用标志物,用于筛查已有多年。但是psa灵敏度不足,约有15%的患者psa仍处于正常水平。特异性差,会造成过度诊疗,比如,当psa处于灰区(4-10ng/ml)时,活检阳性率只有10-25%。
3、psa早期筛查普及对降低前列腺癌死亡率非常重要。但是公认的psa正常和异常的临界值为4.0ng/ml,这一数值检测前列腺癌的特异性仅为40%左右。据估算,约有75%的psa异常者接受了非必要穿刺。按照中国前列腺癌联盟2015年公布的全国重要三甲医院穿刺量进行估算,每年接受非必要穿刺人群至少达25万人,按一例穿刺费用4000元计算,每年消耗约10亿元在非必要穿刺上。另外,psa检测前列腺癌的灵敏度约为75%左右,也会造成早期病人的漏诊。我国前列腺癌新发病例在确诊时仅30%局限在前列腺包膜内(无转移),余者均为局部晚期或广泛转移的患者,首诊中晚期使得这些患者无法接受局部的根治性治疗,预后较差。
4、本发明公开了一种基于外泌体(前列腺癌特异性)mrna的前列腺癌早期诊断标志物及其应用,实现了早期前列腺癌的高效诊断,降低了早期病人的漏诊率。灵敏度可达到92.5%,特异性80.3%,可避免80.3%的真阴性活检,减少了过度诊疗。无痛免穿刺的诊断方式减轻了很多病人的痛苦,并节约了非必要穿刺的高昂费用。
5、外泌体是指包含了复杂rna和蛋白质的小膜泡(30-150nm),现今,其特指直径在40-100nm的盘状囊泡。外泌体已被证明在癌症的发展过程中起着关键作用,因为它们能够调节细胞与细胞之间的交流。越来越多癌症特异性外泌体研究表明,外泌体含有生物活性分子可以作为生物标志物被用于癌症诊断。
6、前列腺癌特异性外泌体的富集主要是通过免疫亲和的方法,常使用抗体偶联磁珠法通过肿瘤细胞来源外泌体中特异性标志物完成特异性外泌体的富集。如文献“isolationof prostate cancer-related exosomes”中应用到磁珠偶联cd9和psma抗体捕获前列腺癌特异性外泌体。专利“前列腺癌特异性外泌体、lncrna及其制备方法和应用”中应用到磁珠偶联epcam和psma抗体捕获前列腺癌特异性外泌体。
7、用于富集外泌体的生物标志物的多为跨膜蛋白,因为外泌体的产生过程为细胞膜内陷形成内体(endosome),然后再形成多泡体(multivesicular bodies,mvb),最后分泌到细胞外成为外泌体。因此,我们通过寻找前列腺癌特异性的膜蛋白挖掘新的可更高效捕获前列腺癌特异性外泌体的生物标志物。如:or51e2﹑steap2﹑trpm8﹑trgc1等,均属于细胞膜上的表达蛋白且特异性在前列腺癌组织中高表达。其中,or51e2﹑steap2不仅在前列腺癌组织中高表达,也在内体(endosome)膜上表达,是最有潜力的前列腺癌特异性外泌体的生物标志物。
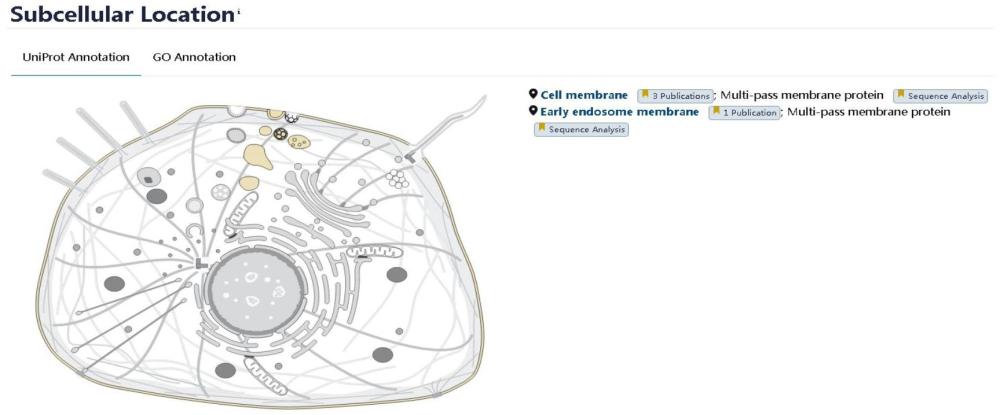
8、通过uniprot蛋白质数据库对or51e2和steap2蛋白在细胞中的定位分析如图1和图2所示。or51e2在内体(endosome)膜和细胞膜上表达。相关文献如下:
9、“olfactory receptor responding to gut microbiota-derived signalsplays a role in renin secretion and blood pressure regulation.”
10、“functional characterization of the odorant receptor 51e2 in humanmelanocytes.”
11、“odorant receptor 51e2 agonist beta-ionone regulates rpe cellmigration and proliferation.”
12、steap2在内体(endosome)膜和细胞膜上表达。相关文献如下“cloning andcharacterization of a novel six-transmembrane protein steap2,expressed innormal and malignant prostate.”
13、在分子生物学领域,前列腺癌的生物标志检测试剂盒已被应用于前列腺癌诊断,如专利“一种用于检测前列腺癌的组合物,试剂盒及其用途”通过检测ctdna gstp1、rassf1a、prkcb三个基因选定的cpg岛区域为最佳组合的检测靶标,通过其甲基化水平检测完成前列腺癌阴阳性的判读。专利“用于检测去势抗性前列腺癌的标志物及其应用”标志物包括以下至少一种基因或一组基因组合:peg10、ccdc74a、ppib、gapdh、ar和epcam用于去势抗性前列腺癌的诊断、辅助诊断和/或预后评估。专利“外泌体基因的应用、前列腺癌检测物及其检测试剂盒和检测装置”通过检测外泌体中pca3基因、spdef基因及tmprss2:erg融合基因中的至少一种,检出前列腺癌。
14、我们通过研究发现除了基因pca3,还有两种基因ck19和agr2 sv-h是前列腺癌诊断的潜在生物标记物,并通过试验数据得以证实。
15、前列腺癌抗原3(prostate cancer antigen 3,pca3)在95%的检测的全部前列腺癌中过度表达,在前列腺外组织(良性和恶性)中尚未检测到pca3转录,证明pca3是目前已知最具特异性的前列腺癌标志物。
16、前梯度同源蛋白2(anterior gradient homolog 2,agr2)是与肿瘤转移有关的内质网蛋白二硫化物异构酶基因家族的成员。与良性组织相比,agr2在前列腺癌中高表达。有研究显示,尿液外泌体agr2转录本agr2 sv-h在预测前列腺癌方面有很高的鉴别能力,是利用尿液外泌体无创检测前列腺癌的潜在诊断生物标记物。
17、细胞角蛋白19(cytokeratin 19,ck19)是细胞角蛋白家族的成员,在转移癌中高表达。一项针对中国人群的临床研究显示,尿液外泌体ck19基因表达水平在预测前列腺癌方面有较高的性能,是前列腺癌诊断的潜在生物标记物。
技术实现思路
1、本发明主要是解决现有技术中存在的不足,提供一种基于外泌体mrna的前列腺癌早期诊断标志物及其应用,通过磁珠偶联or51e2﹑steap2抗体捕获前列腺癌特异性外泌体,通过检测外泌体中mrna基因ck19、基因agr2 sv-h、基因pca3,达到前列腺癌早诊的目的;该检测灵敏度可达到92.5%,特异性80.3%,可避免80.3%的真阴性活检,减少了过度诊疗;无痛免穿刺的诊断方式减轻了很多病人的痛苦,并节约了非必要穿刺的费用。
2、本发明的上述技术问题主要是通过下述技术方案得以解决的:
3、一种前列腺癌特异性外泌体的制备方法,按以下步骤进行:
4、(1)尿液处理:将尿液离心后取上清备用;
5、(2)尿液总外泌体的分离;
6、(3)双抗体偶联免疫磁珠的制备:
7、取链霉亲和素磁珠用tbs缓冲液清洗后,用pbs缓冲液重悬得到悬液;向悬液中加入生物素标记的or51e2和steap2抗体进行孵育;孵育后用磁力架分离磁珠,用pbs缓冲液进行清洗,分离的磁珠用pbs缓冲液重悬得到悬浮液备用;(4)免疫磁珠捕获前列腺癌特异性外泌体;
8、(5)前列腺癌特异性外泌体的制备。
9、作为优选,所述磁珠为链霉素亲和修饰的磁珠,磁珠直径为1-3μm,磁珠为双抗体偶联免疫磁珠;所述or51e2和steap2抗体为生物素标记的or51e2和steap2抗体。
10、一种前列腺癌外泌体中的靶标mrna ck19、agr2 sv-h和pca3以及内参基因spdef的制备方法,包括以下步骤:
11、(1)外泌体mrna的提取;
12、(2)外泌体mrna反转录合成cdna;
13、(3)mrna ck19、agr2 sv-h和pca3的扩增:反转录的cdna为模板分别进行实时荧光定量pcr扩增获得mrna ck19、agr2 sv-h和pca3。
14、作为优选,所述实时荧光定量pcr的扩增引物为:
15、pca3正向引物:5’-agcacaaaaggaagcacagat-3’
16、pca3反向引物:5’-cctcacaagcgggaccag-3’
17、pca3探针:5’-atgcccggccgccatcttgggtc-3’
18、ck19正向引物:5’-ggacctgcgggacaagatt-3’
19、ck19反向引物:5’-cctgttccgtctcaaacttggt-3’
20、ck19探针:5’-ctccaggattgtcctgcagatcgacaatgcccg-3’
21、agr2 sv-h正向引物:5’-atggagaaaattccagtgtcagca-3’
22、agr2 sv-h反向引物:5’-acttgagagctttcttcatatgtctg-3’
23、agr2 sv-h探针:5’-ggccctctcctacactctggccagagtaccac-3’
24、spdef正向引物:5’-cctgtggacagagcaccaat-3’
25、spdef反向引物:5’-cactggtcgaggctgacttc-3’
26、spdef探针:5’-atgggcaaggccttccaggagctgg-3’。
27、作为优选,检测靶标mrna ck19、agr2 sv-h和pca3表达量的试剂为实时荧光定量pcr检测试剂。
28、作为优选,所述检测试剂还包括总外泌体提取试剂、逆转录试剂和qpcr试剂。
29、作为优选,按以下步骤进行:
30、(1)尿液样本的处理与保存:
31、新鲜采集样本应在4小时内进行处理,进行3000×g,4℃离心10min,弃沉淀,将上清转移到新的离心管备用,时间应不超过1个月;
32、(2)尿液总外泌体的分离:
33、①向15ml超滤管加入3ml pbs,4℃冰箱静置10min;
34、②取出步骤①处理过的15ml超滤管,去除超滤管中的液体,将处理后的尿液样本转移15ml到超滤管中,在温度4℃,3000×g离心15min;
35、③加入1ml pbs于15ml超滤管的滤膜上,静置1min后用移液枪对超滤膜进行吹洗,然后将所有液体全部转移到1.5ml ep管中,放置于2-8℃;
36、(3)双抗体偶联免疫磁珠的制备:
37、①取磁珠并去除上清:用移液器轻轻吹打以充分重悬链霉亲和素磁珠,取20-100ul置于1.5ml离心管中待用;
38、②洗涤磁珠:加入1×tbs至最终体积为0.5ml,用移液器轻轻吹打重悬链霉亲和素磁珠;置于磁力架上分离10秒,去除上清,完成一次洗涤步骤;然后再按照前述洗涤步骤,洗涤2次;
39、③抗体吸附:适量pbs稀释的生物素标记的or51e2和steap2抗体各10ul充分振荡重悬磁珠,置于旋转混合仪上,室温孵育30-60分钟或4℃孵育4-16小时;
40、④磁性分离:将离心管置于磁力架上分离1分钟,去除上清;
41、⑤洗涤:取1ml的pbs加入分离得到的磁珠中,重悬磁珠;将离心管置于磁力架上分离1分钟,去除上清;
42、⑥收集:每个样品加入100μl或适量的pbs,重悬磁珠;
43、(4)免疫磁珠捕获前列腺癌特异性外泌体得到悬浮液备用:
44、向双抗体偶联免疫磁珠中加入提取的尿液总外泌体1ml室温下孵育2-4小时或4℃孵育8-16小时;将离心管置于磁力架上分离1分钟,去除上清;取1ml的pbs加入分离得到的磁珠中,重悬磁珠;
45、将离心管置于磁力架上分离1分钟,去除上清;重复一次;用200ul 0.1%sds加入磁珠离心管中,充分震荡,95℃加热3分钟;置于磁力架上分离1分钟;保留上清,得到前列腺癌特异性外泌体。
46、作为优选,按以下步骤进行:
47、步骤(1)中尿液样本如需保存,样本应保存在温度为-80℃的环境中;
48、步骤(2)中超滤管的膜孔径为100kd;小步骤③中,用于后续实验步骤,如暂时不进行后续实验,可于-80℃保存,冷冻保存的样本在进行后续实验前应于2-8℃进行解冻;
49、步骤(3)的①中,使用前置于磁力架上分离1分钟,去除上清;
50、步骤(4)中,尿液总外泌体的抗体工作浓度约1:100。
51、一种基于外泌体mrna的前列腺癌早期诊断标志物及其应用,包括以下步骤:
52、(一)总mrna提取:
53、①向200ul的前列腺癌特异性外泌体中加入1ml的trizol,涡旋震荡30s,室温静置10min;
54、②加入300ul三氯甲烷,用手快速剧烈振荡混匀15s,室温静置3-5min;
55、③将离心管在12,000×g,4℃离心15min,将上清液转移至新的1.5mlep管中;
56、④向吸出的上清中加入上清总体积1.6倍的无水乙醇,充分混匀,然后将上述混合液转移至无核酸酶核酸吸附柱中,12,000×g,4℃离心30s,去除过柱液,若有剩余混合液则重复此离心步骤,直至所有溶液全部过柱;
57、⑤加入500ul无核酸酶水配的75%乙醇,室温静置2min,12,000×g,4℃离心30s,弃废液;
58、⑥重复步骤⑤一次;
59、⑦将离心柱放回收集管中,12,000×g,4℃空柱离心2min;
60、⑧将离心柱转移至1.5ml离心管,开盖干燥3min;吸取无核酸酶水20ul加入离心柱中央的膜上,室温静置1min,12,000×g,4℃离心1min;弃去离心柱,离心产物可以直接进行后续实验,或储存于-80℃备用;
61、(二)cdna合成:
62、总mrna置于70℃变性5min,立即放于冰上冷却,破坏rna的高级结构;以总mrna为模板,primer mix为逆转录引物,反应体系如下:
63、 总mrna xul 5×rtbuffer 4ul primermix 1ul rtenzymemix 1ul rnasefreeh2o (14-x)ul 总体积 20ul
64、按照以下温度条件进行实验:37℃,25min;85℃,15s;-20℃保存备用;
65、(三)实时荧光pcr检测目的基因:
66、实时荧光定量pcr反应体系如下:
67、
68、
69、阴阳性质控品:
70、 阳性质控品 10ul 含靶基因的rna片段 阴性质控品 10ul ddh2o
71、反应条件:
72、
73、引物序列如下:
74、pca3正向引物:5’-agcacaaaaggaagcacagat-3’
75、pca3反向引物:5’-cctcacaagcgggaccag-3’
76、pca3探针:5’-atgcccggccgccatcttgggtc-3’
77、ck19正向引物:5’-ggacctgcgggacaagatt-3’
78、ck19反向引物:5’-cctgttccgtctcaaacttggt-3’
79、ck19探针:5’-ctccaggattgtcctgcagatcgacaatgcccg-3’
80、agr2 sv-h正向引物:5’-atggagaaaattccagtgtcagca-3’
81、agr2 sv-h反向引物:5’-acttgagagctttcttcatatgtctg-3’
82、agr2 sv-h探针:5’-ggccctctcctacactctggccagagtaccac-3’
83、spdef正向引物:5’-cctgtggacagagcaccaat-3’
84、spdef反向引物:5’-cactggtcgaggctgacttc-3’
85、spdef探针:5’-atgggcaaggccttccaggagctgg-3’;
86、(四)代入逻辑回归公示与结果判读:
87、根据荧光pcr检测结果,代入以下公示:
88、ca-score=1/[1+exp(﹣z)],z=0.8026﹣0.158a+0.103b﹣0.179c;
89、其中a为ck19相对spdef的表达量,b为agr2 sv-h相对spdef的表达量,c为pca3相对spdef的表达量;
90、z为自然常数,﹣0.158、0.103和﹣0.179为加权计算系数,0.8026为常数系数;
91、a,b,c的计算方法如下:a=ct(ck19)﹣ct(spdef);b=ct(agr2 sv-h)﹣ct(spdef);c=ct(pca3)﹣ct(spdef);得出ca-score,当检测的ca-score大于0.68时,表明受检者患前列腺癌风险较高,当检测的ca-score小于0.68时,表明受检者前列腺癌风险较低。
92、作为优选,步骤(2)中,primer mix是指oligo dt和random primer,直接用于mrna和非编码rna逆转录。
93、所述的前列腺癌外泌体中靶标mrna ck19、agr2 sv-h和pca3表达量的试剂在制备用于前列腺癌早期诊断中的应用。
94、双抗体偶联免疫磁珠和实时荧光定量pcr的扩增引物﹑探针。
95、or51e2﹑steap2﹑trpm8﹑trgc1等,均属于细胞膜上的表达蛋白,且特异性在前列腺癌组织中高表达。or51e2﹑steap2不仅在前列腺癌组织中高表达,也在内体(endosome)膜上表达。通过or51e2﹑steap2双抗体偶联磁珠能够捕获前列腺癌特异性外泌体。
96、前列腺癌特异性外泌体中mrna基因ck19、agr2 sv-h和pca3三种靶标联合应用早诊前列腺癌。建立logistic回归模型,作为前列腺癌早期诊断指标,提高诊断和预示前列腺癌的检测性能。
97、本发明公开了一种前列腺癌特异性外泌体的捕获方法。or51e2﹑steap2不仅在前列腺癌组织中高表达,也在内体(endosome)膜上表达(外泌体的产生过程为:细胞膜内陷形成内体(endosome),然后再形成多泡体(multivesicular bodies,mvb),最后分泌到细胞外成为外泌体)。通过or51e2﹑steap2双抗体偶联磁珠能够捕获前列腺癌特异性外泌体且纯度高,产量可达到1010particles/ml,提取的外泌体符合后续前列腺癌靶标的检测需求。
98、本发明公开了一种基于外泌体(前列腺癌特异性)mrna的前列腺癌早期诊断标志物及其应用,实现了早期前列腺癌的高效诊断,降低了早期病人的漏诊率,灵敏度可达到92.5%,特异性80.3%,可避免80.3%的真阴性活检,减少了过度诊疗。无痛免穿刺的诊断方式减轻了很多病人的痛苦,并节约了非必要穿刺的费用。
本文地址:https://www.jishuxx.com/zhuanli/20240905/287138.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表