用于合成SGLT抑制剂的中间体的制备方法与流程
- 国知局
- 2024-09-05 14:41:31
本发明涉及一种用于合成钠依赖性葡萄糖协同转运体(sglt)抑制剂的中间体的制备方法。
背景技术:
1、钠依赖性葡萄糖协同转运体(sglt)允许葡萄糖抗浓度梯度地转运,并同时允许na+按照浓度梯度地转运。目前,已克隆出两种重要的sglt异构体(isoform),且以sglt1和sglt2而周知。sglt1位于肠、肾脏和心脏,并且通过表达调节心脏葡萄糖的转运。由于sglt1为高亲和力、低容量的转运体,其仅负责一部分肾脏葡萄糖的再吸收。相反地,sglt2为低亲和力、高容量的转运体,其主要位于早期近曲小管内上皮细胞的顶端部位。在健康个体中,将超过99%的在肾小球中过滤的血浆葡萄糖再吸收,而低于1%的总过滤葡萄糖通过尿液排出。据估计,90%的肾脏葡萄糖的再吸收是通过sglt2促进的,并且剩余10%是通过晚期近端直小管中的sglt1介导的。虽然sglt2的基因突变对碳水化合物代谢不具任何特别的不良作用,但根据突变导致每天增加约140g的肾脏葡萄糖分泌。根据人类突变研究,sglt2已成为治疗研究的对象,因为据估计sglt2负责大部分肾脏葡萄糖的再吸收。
2、美国公开专利公报第2015/0152075号(专利文件1)公开了对sglt2具有抑制活性的具有二苯基甲烷残基的化合物和其制备方法。上述文献公开了:上述二苯基甲烷衍生物化合物对人类sglt2活性示出优异的抑制作用,并且相比于作为sglt2抑制剂而周知的达格列净(dapagliflozin),其显著降低动物尿糖的排出,由此,上述二苯基甲烷衍生物化合物对糖尿病的治疗是有效的。此外,美国公开专利公报第2014/0274918号中公开了二苯基甲烷衍生物,其作为钠依赖性葡萄糖协同转运体1(sglt1)和钠依赖性葡萄糖协同转运体2(sglt2)的双重抑制剂是有效的。
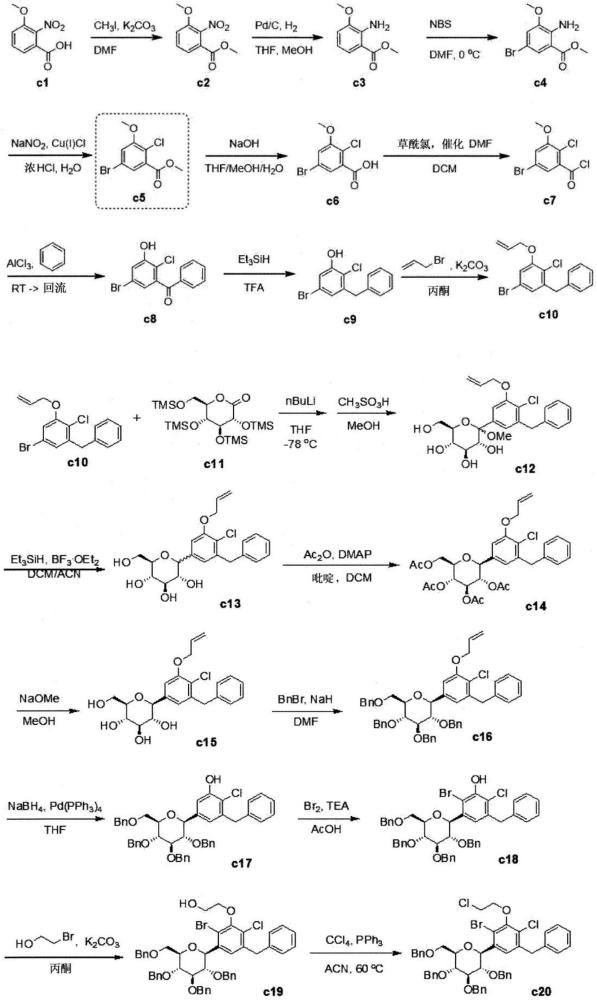
3、美国公开专利公报第2015/0152075号(专利文件1)的实施例172等中公开了以与下述反应式1相同的方式制备用作sglt抑制剂的二苯基甲烷化合物c28的方法。
4、[反应式1]
5、
6、
7、然而,根据现有的上述化合物c28的制备方法,使用线性合成法,诸如糖苷配基在与葡萄糖基偶合之后形成五角环。在此种线性合成的情况下,由于途径复杂,最终产率低,此外,在与二氢苯并呋喃键合的葡萄糖基的取代基或环丙基苄基的合成过程中出现错误,或在所要更换成另一者的情况下,存在必须从头开始重新进行合成的麻烦。此外,对于合成化合物c28的环丙基的过程,也是在合成途径结束时通过simon-smith反应环化烯烃的方式进行,从而具有产率根据试剂(二乙基锌、溶剂)等的状态(纯度、无水等)和反应浓度而大幅改变的问题。
8、同时,韩国公开专利公报第2017-0142904号(专利文件2)公开了用于制备对sglt2具有抑制活性的二苯基甲烷衍生物的方法。相较于现有文献中所公开的线性合成法,该文件公开了合成路线较简单并可提高产率,而且可降低线性合成路线中固有的风险因素,因为二苯基甲烷衍生物是通过会聚(convergent)合成法进行制备,上述会聚合成法中,按照主要基团单独合成后,如下述反应式2a和2b中所示般偶合。
9、[反应式2a]
10、
11、[反应式2b]
12、
13、然而,c40是用于制备用作sglt抑制剂的二苯基甲烷化合物c28的重要中间体,由于合成c40的步骤(反应式2a)很长,具有14个步骤,并且当使用c1作为起始物进行该步骤时,需要特殊装置(诸如臭氧产生器),因此存在总产率和经济可行性方面的困难。
14、[相关技术领域的文件]
15、[专利文件]
16、美国公开专利公报第2015/0152075号
17、韩国公开专利公报第2017-0142904号
技术实现思路
1、发明所要解决的问题
2、本发明提供化学式9化合物的新型制备方法,上述化学式9化合物为用于合成sglt抑制剂的中间体。
3、用于解决问题的方案
4、本发明人通过在合成化学式9化合物时利用更商业化的起始物开发出具有反应步骤短且总产率高的合成方法,从而完成本发明,其中上述化学式9化合物为下述化学式i化合物的重要中间体。
5、作为最终目标化合物和用作sglt抑制剂的有效成分的化学式i化合物如下。
6、[化学式ⅰ]
7、
8、在上述式中,
9、n为1或2,
10、x为卤素(例如,f、cl、br或i),
11、b为或
12、在此情况下,ra、rb、rc和rd各自独立地为氢、卤素、羟基、巯基、氰基、硝基、氨基、羧基、氧代基、c1-7烷基、c1-7烷硫基、c2-7烯基、c2-7炔基、c1-7烷氧基、c1-7烷氧基-c1-7烷基、c2-7烯基-c1-7烷氧基、c2-7炔基-c1-7烷氧基、c3-10环烷基、c3-7环烷硫基、c5-10环烯基、c3-10环烷氧基、c3-10环烷氧基-c1-7烷氧基、苯基-c1-7烷基、c1-7烷硫基-苯基、苯基-c1-7烷氧基、单-或二-c1-7烷氨基、单-或二-c1-7烷氨基-c1-7烷基、c1-7烷酰基、c1-7烷酰基氨基、c1-7烷基羰基、c1-7烷氧基羰基、氨基甲酰基、单-或二-c1-7烷基氨基甲酰基、c1-7烷基磺酰基氨基、苯基磺酰基氨基、c1-7烷基亚磺酰基、c6-14芳基硫醇基、c6-14芳基磺酰基、c6-14芳基、5-13元杂芳基、5-10元杂环烷基、5-10元杂环烷基-c1-7-烷基、或5-10元杂环烷基-c1-7烷氧基;
13、环c为c3-10环烷基、c5-10环烯基、c6-14芳基、5-13元杂芳基、或5-10元杂环烷基;
14、上述烷基、烯基、炔基和烷氧基各自独立地未取代或具有选自以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-7烷基、和c2-7炔基;
15、上述环烷基、环烯基、芳基、杂芳基和杂环烷基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-4烷基、和c1-4烷氧基;
16、上述杂芳基和杂环烷基各自独立地包含选自由n、s和o组成的组中的一种以上的杂原子。
17、在本发明的具体例中,上述环b-1可选自由以下组成的组中。
18、
19、在上述式中,r7为氢或c1-7烷基;r8a和r8b各自独立地为c1-7烷基、或彼此连接以形成5-10元杂环烷基(包含选自由n、s和o组成的组中的一种以上的杂原子)。
20、在其他具体例中,上述环b-2可选自由以下组成的组中。
21、
22、根据上述化学式i化合物的优选一例,上述n为1;上述x为卤素;上述b可为由选自由卤素、羟基、氰基、硝基、氨基、巯基、c1-7烷基、c3-10环烷基、和c1-7烷氧基组成的组中的一个或两个取代基取代或未取代的苯基。
23、此外,上述化学式i化合物可为二苯基甲烷衍生物和杂环烷基环的键合位置呈α-型、β-型、或它们的外消旋型的化合物。
24、例如,上述化学式i化合物可为下述化学式ia化合物。
25、[化学式ia]
26、
27、在上述式中,b、n和x如上所定义。
28、本发明提供下述化学式9化合物的制备方法,上述化学式9化合物是用于制备化学式i的二苯基甲烷衍生物的中间体。
29、[化学式9]
30、
31、在上述式中,
32、x和y各自独立地为卤素,
33、b为或
34、在此情况下,ra、rb、rc和rd各自独立地为氢、卤素、羟基、巯基、氰基、硝基、氨基、羧基、氧代基、c1-7烷基、c1-7烷硫基、c2-7烯基、c2-7炔基、c1-7烷氧基、c1-7烷氧基-c1-7烷基、c2-7烯基-c1-7烷氧基、c2-7炔基-c1-7烷氧基、c3-10环烷基、c3-7环烷硫基、c5-10环烯基、c3-10环烷氧基、c3-10环烷氧基-c1-7烷氧基、苯基-c1-7烷基、c1-7烷硫基-苯基、苯基-c1-7烷氧基、单-或二-c1-7烷氨基、单-或二-c1-7烷氨基-c1-7烷基、c1-7烷酰基、c1-7烷酰基氨基、c1-7烷基羰基、c1-7烷氧基羰基、氨基甲酰基、单-或二-c1-7烷基氨基甲酰基、c1-7烷基磺酰基氨基、苯基磺酰基氨基、c1-7烷基亚磺酰基、c6-14芳基硫醇基、c6-14芳基磺酰基、c6-14芳基、5-13元杂芳基、5-10元杂环烷基、5-10元杂环烷基-c1-7-烷基、或5-10元杂环烷基-c1-7烷氧基;
35、环c为c3-10环烷基、c5-10环烯基、c6-14芳基、5-13元杂芳基、或5-10元杂环烷基;
36、上述烷基、烯基、炔基和烷氧基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-7烷基、和c2-7炔基;
37、上述环烷基、环烯基、芳基、杂芳基和杂环烷基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-4烷基、和c1-4烷氧基;
38、上述杂芳基和杂环烷基各自独立地包含选自由n、s和o组成的组中的一种以上的杂原子。
39、本发明提供化学式9化合物的制备方法,上述方法包括以下步骤:
40、从化学式5化合物获得化学式6化合物;以及
41、通过使化学式6化合物与化学式7化合物进行反应来获得化学式8化合物。
42、[化学式5]
43、
44、[化学式6]
45、
46、[化学式7]
47、
48、[化学式8]
49、
50、[化学式9]
51、
52、在上述式中,
53、r2、r3、x和y各自独立地为卤素,
54、b为或
55、在此情况下,ra、rb、rc和rd各自独立地为氢、卤素、羟基、巯基、氰基、硝基、氨基、羧基、氧代基、c1-7烷基、c1-7烷硫基、c2-7烯基、c2-7炔基、c1-7烷氧基、c1-7烷氧基-c1-7烷基、c2-7烯基-c1-7烷氧基、c2-7炔基-c1-7烷氧基、c3-10环烷基、c3-7环烷硫基、c5-10环烯基、c3-10环烷氧基、c3-10环烷氧基-c1-7烷氧基、苯基-c1-7烷基、c1-7烷硫基-苯基、苯基-c1-7烷氧基、单-或二-c1-7烷氨基、单-或二-c1-7烷氨基-c1-7烷基、c1-7烷酰基、c1-7烷酰基氨基、c1-7烷基羰基、c1-7烷氧基羰基、氨基甲酰基、单-或二-c1-7烷基氨基甲酰基、c1-7烷基磺酰基氨基、苯基磺酰基氨基、c1-7烷基亚磺酰基、c6-14芳基硫醇基、c6-14芳基磺酰基、c6-14芳基、5-13元杂芳基、5-10元杂环烷基、5-10元杂环烷基-c1-7-烷基、或5-10元杂环烷基-c1-7烷氧基;
56、环c为c3-10环烷基、c5-10环烯基、c6-14芳基、5-13元杂芳基、或5-10元杂环烷基;
57、上述烷基、烯基、炔基和烷氧基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-7烷基、和c2-7炔基;
58、上述环烷基、环烯基、芳基、杂芳基和杂环烷基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-4烷基、和c1-4烷氧基;
59、上述杂芳基和杂环烷基各自独立地包含选自由n、s和o组成的组成的一种以上的杂原子。
60、在韩国公开专利公报第2017-0142904号(专利文件2)中,制备化学式9化合物的过程由总共14个步骤组成(上述反应式2a)。此外,当使用c1作为起始物进行上述过程时,存在需要特殊装置(诸如臭氧产生器)的问题。当无臭氧反应装置时,可使用oso4/naio4进行反应,但当使用oso4/naio4时,随着规模逐渐变大,形成更多杂质,以致于存在oso4/naio4无法应用在生产上的问题。
61、为了解决上述现有技术的问题,在本发明的一具体例中,可使用市售2,3-二氢苯并呋喃(下述化学式1化合物)、2,3-二氢苯并呋喃-7-羧酸(下述化学式2化合物)、或2,3-二氢苯并呋喃-7-胺(下述化学式3化合物)(包括盐型)作为用于获得化学式9化合物的起始物。
62、相较于根据韩国公开专利公报第2017-0142904号(专利文件2)的现有方法的26%的总产率,在本发明一具体例中,通过使用2,3-二氢苯并呋喃(下述化学式1化合物)作为起始物,并通过选择性溴化和甲酰化过程以共7个步骤的有效工艺以39%的高产率合成化学式9化合物,并且将合成步骤数也减少至总共7个步骤而使生产效率最大化。此外,由于不需特殊装置(诸如臭氧产生器),因此即使使用普通装置也可生产化学式9化合物,并且能够以高产率生产化学式9化合物,并且,可大幅改善经济可行性。
63、在一具体例中,由于本发明的化学式9化合物的制备方法可包括下述步骤1至步骤7来制备化学式9化合物,并且可选择化学式1化合物、化学式2化合物、化学式3化合物、或化学式4化合物作为起始物,因此必要时可省略步骤1至步骤4中的一个以上:
64、从化学式1化合物获得化学式2化合物(步骤1),
65、从化学式2化合物获得化学式3化合物(步骤2),
66、从化学式3化合物获得化学式4化合物(步骤3),
67、从化学式4化合物获得化学式5化合物(步骤4),
68、从化学式5化合物获得化学式6化合物(步骤5),
69、通过使化学式6化合物与化学式7化合物进行反应来获得化学式8化合物(步骤6),以及
70、从化学式8获得化学式9(步骤7)。
71、[化学式1]
72、
73、[化学式2]
74、
75、[化学式3]
76、
77、[化学式4]
78、
79、[化学式5]
80、
81、[化学式6]
82、
83、[化学式7]
84、
85、[化学式8]
86、
87、[化学式9]
88、
89、在上述式中,
90、r1为nh2,
91、r2、r3、x和y各自独立地为卤素,
92、b为或
93、在此情况下,ra、rb、rc和rd各自独立地为氢、卤素、羟基、巯基、氰基、硝基、氨基、羧基、氧代基、c1-7烷基、c1-7烷硫基、c2-7烯基、c2-7炔基、c1-7烷氧基、c1-7烷氧基-c1-7烷基、c2-7烯基-c1-7烷氧基、c2-7炔基-c1-7烷氧基、c3-10环烷基、c3-7环烷硫基、c5-10环烯基、c3-10环烷氧基、c3-10环烷氧基-c1-7烷氧基、苯基-c1-7烷基、c1-7烷硫基-苯基、苯基-c1-7烷氧基、单-或二-c1-7烷氨基、单-或二-c1-7烷氨基-c1-7烷基、c1-7烷酰基、c1-7烷酰基氨基、c1-7烷基羰基、c1-7烷氧基羰基、氨基甲酰基、单-或二-c1-7烷基氨基甲酰基、c1-7烷基磺酰基氨基、苯基磺酰基氨基、c1-7烷基亚磺酰基、c6-14芳基硫醇基、c6-14芳基磺酰基、c6-14芳基、5-13元杂芳基、5-10元杂环烷基、5-10元杂环烷基-c1-7-烷基、或5-10元杂环烷基-c1-7烷氧基;
94、环c为c3-10环烷基、c5-10环烯基、c6-14芳基、5-13元杂芳基、或5-10元杂环烷基;
95、上述烷基、烯基、炔基和烷氧基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-7烷基、和c2-7炔基;
96、上述环烷基、环烯基、芳基、杂芳基和杂环烷基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-4烷基、和c1-4烷氧基;
97、上述杂芳基和杂环烷基各自独立地包含选自由n、s和o组成的组中的一种以上杂原子。
98、从化学式1化合物获得化学式2化合物的步骤(步骤1)可包括:将溶剂中的化学式1化合物锂化后,使用二氧化碳气体羧化上述经锂化的化学式1化合物,由此获得化学式2化合物。
99、上述锂化可通过已知有机锂试剂进行,并且有机锂试剂为包含碳-锂键的有机金属化合物。在本发明的一具体例中,可用于锂化的有机锂试剂包括甲基锂、正丁基锂、仲丁基锂、异丙基锂、叔丁基锂、苯基锂等。例如,有机锂试剂可为正丁基锂。
100、相对于1当量的化学式1化合物,上述锂化可通过1至2当量(例如,1.当量5至2当量)的有机锂试剂进行。例如,可使用1.6当量以上的正丁基锂作为有机锂试剂。尽管不限于此,但化学式1化合物的锂化可通过在有机锂试剂中额外使用四甲基乙二胺(tmeda)来提高反应性。在从化学式1化合物获得化学式2化合物的步骤(步骤1)中所使用的溶剂可为选自由以下组成的组中的一种以上:丙酮、乙腈、二氯甲烷、二甲基甲酰胺、二甲基丙烯脲、二甲基亚砜、乙酸乙酯、六甲基磷酰胺、四氢呋喃、戊烷、己烷、庚烷、乙醚和二乙醚,但不限于此。
101、在锂化化学式1化合物之后,使用二氧化碳引入羧基。在此情况下,可使用co2气体以防水分流入,从而可使产率最大化。使用二氧化碳气体的羧化可在-60℃至0℃(例如,-60℃至-15℃)下进行。优选地,可通过在-60℃至-15℃下进行羧化来抑制发热,从而可使产率最大化。
102、从化学式2化合物获得化学式3化合物的步骤(步骤2)可包括:
103、通过将化学式2化合物的羧基转化成酰叠氮基来获得下述化学式2a化合物,
104、从化学式2a化合物获得化学式2b化合物,以及
105、从化学式2b化合物获得化学式3化合物。
106、[化学式2a]
107、
108、[化学式2b]
109、
110、在上述式中,a表示c1-4烷基或c1-4烷氧基。
111、步骤2可包括:步骤2-1,通过将化学式2化合物的羧基转化成酰叠氮基来获得下述化学式2a化合物,并从化学式2a化合物获得化学式2b化合物;以及步骤2-2,从化学式2b化合物获得化学式3化合物。
112、在从化学式2a化合物合成化学式2b化合物和从化学式2b化合物获得化学式3化合物的步骤(步骤2-1)中所使用的溶剂可选自由以下组成的组中:乙醇、丙醇、丁醇、和甲氧基乙醇。尽管上述溶剂皆可适用,但考虑用于制备化学式2b化合物的反应温度以及随后浓缩去除溶剂的容易度,使用正丙醇为佳。相对于起始物,可使用4至9倍(w/v)的上述溶剂。
113、从化学式2a化合物获得化学式2b化合物并从化学式2b化合物获得化学式3化合物可在70℃至115℃下进行,但不限于此。优选反应温度可根据溶剂的选择而设定在可使溶剂回流的温度。在本发明的一具体例中,从化学式2a化合物获得化学式2b化合物并从化学式2b化合物获得化学式3化合物的步骤可在正丙醇中进行,并且可在90℃至100℃的反应温度下进行。
114、使用正丙醇合成化学式2b化合物并从化学式2b化合物合成化学式3化合物的过程可由下述反应式示例性表达。
115、
116、tea:三乙胺
117、dppa:叠氮磷酸二苯酯
118、通过tea和dppa进行克尔蒂斯重排反应来从化学式2化合物制备化学式2a的叠氮化合物。当将正丙醇原位加入化学式2a的叠氮化合物中并加热时,经由异氰酸酯化合物(化学式2a')制备化学式2b化合物。在此情况下,由于叠氮化物和异氰酸酯中间体不稳定,因此该制备原位进行。
119、在从化学式2b化合物获得化学式3化合物的步骤2-2中,化学式3化合物是通过用naoh水解化学式2b化合物来获得的。在此情况下,优选地,可通过在ph 1至2下使用氢溴酸/乙酸形成hbr盐以有效地去除共同产生(co-produced)的杂质而获得高纯度的化学式3化合物。
120、从化学式3化合物获得化学式4化合物的步骤(步骤3)可包括:通过使溶剂中的化学式3化合物与n-卤代琥珀酰亚胺进行反应来获得化学式4化合物。
121、步骤3为在邻位和对位处选择性地引入两个卤素的反应,并且作为卤素供给源的n-卤代琥珀酰亚胺的当量、反应温度和反应溶剂是重要因素。在本发明的实施例中,使用溴作为卤素,并且在该情况下,重要的是在化学式3化合物上形成单溴之后,在最大化对应于二溴的化学式4化合物的生成的同时最小化三溴的生成。
122、反应溶剂优选为可充分溶解化学式3化合物并允许该反应在均相状态下进行的溶剂。这种反应溶剂可为选自由以下组成的组中的一种以上的溶剂:乙醇、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺(dmac)和n-甲基吡咯烷酮(nmp),但不限于此。相对于化学式3化合物,可使用10至40倍(w/v)的上述溶剂。
123、尽管不限于此,但在本发明的一具体例中,上述溶剂为乙醇,并且相对于化学式3化合物,可使用30至40倍的上述溶剂。
124、相对于化学式3化合物,可使用2至2.3当量的n-卤代琥珀酰亚胺,优选地,可使用2.05至2.15当量的n-卤代琥珀酰亚胺,以最小化杂质的产生。
125、从化学式3化合物获得化学式4化合物的步骤(步骤3)的反应温度可为-10℃至30℃,优选地,可在-10℃至5℃下进行反应,以最小化杂质的产生。同时,从上述化学式4化合物获得化学式5化合物的步骤(步骤4)可包括:通过桑德迈尔(sandmeyer)反应卤化化学式4化合物的胺。上述桑德迈尔反应可包括:通过使化学式4化合物与nano2进行反应来形成化学式4化合物的重氮盐,并通过使化学式4化合物的重氮盐与过渡金属盐进行反应来获得化学式5化合物,但不限于此。过渡金属盐是指包括铜、铁和钴的过渡金属的盐,但不限于此。例如,上述过渡金属盐可为包括cucl或cubr的铜盐。
126、相对于化学式4化合物,可使用1至2当量的上述nano2,但不限于此。
127、同时,化学式4化合物的重氮盐与过渡金属盐的反应可在30℃至80℃,例如40℃至70℃及50℃至60℃下进行。为了最小化非卤化的杂质,化学式4化合物的重氮盐与过渡金属盐在50℃至60℃下反应为佳。
128、可通过溶剂洗涤所得产物,以纯化杂质,并且可使用乙醇、1-丙醇、异丙醇等。优选地,步骤4可包括以异丙醇纯化所得产物的过程。
129、从化学式5化合物获得化学式6化合物的步骤(步骤5)可包括:使用有机镁试剂和二甲基甲酰胺(dmf)作为反应试剂,并选择性地将化学式5化合物的x取代基转化成醛基。在此,有机镁试剂为由rmgx(r=烷基或芳基,x=卤素)表达的化合物。
130、在本发明的一实施例中,作为有机镁试剂的一例的异丙基氯化镁将化学式5化合物的邻位处的x转化成mgx而形成格氏(grignard)试剂,并且该格氏试剂与dmf进行反应来转化成醛基。
131、相对于1当量的化学式5化合物,可使用1至2当量的有机镁试剂,优选地,可使用1至1.7当量的有机镁试剂,但不限于此。相对于1当量的化学式5化合物,可使用3至6当量的dmf,优选地,可使用4至5当量的dmf。
132、在步骤5中,可使用四氢呋喃(thf)、二乙醚、2-甲基四氢呋喃等作为反应溶剂。尽管不限于此,但可使用化学式5化合物的5倍至15倍(w/v)的反应溶剂,优选地,可使用化学式5化合物的8至12倍(w/v)的反应溶剂。
133、步骤5的反应可在-10℃至50℃,例如0℃至50℃、10℃至50℃、20℃至50℃和30℃至50℃下进行。为了使软物质和反应中间体的产生最小化,优选地,上述反应可在30℃至50℃下进行。然而,当添加dmf时,由于热生成而使温度上升,因此反应起始温度为低于上述温度的25℃至30℃为佳。
134、通过使化学式6化合物与化学式7化合物进行反应来获得化学式8化合物的步骤(步骤6)可包括:锂化化学式7化合物的卤素位置后,将经锂化的化合物与化学式6化合物偶合。可以使用前述的有机锂试剂进行锂化。尽管不限于此,但相对于1当量的化学式7化合物,可通过1至1.3当量的有机锂试剂进行锂化。例如,可使用n-buli。当相较于化学式7化合物,有机锂试剂过多时,上述有机锂试剂可与存在于化学式6化合物中的卤素进行反应,因此使用适合当量的有机锂试剂为佳。此外,为了更稳定地保持所要生成的锂盐,优选地,在上述锂化反应之前,将丁基氯化镁或叔丁基氯化镁加入至溶剂中的化学式7化合物。已证实当仅使用有机锂试剂时,根据有机锂试剂的使用当量,产生1%至9%的残留在最终生成的化学式9化合物中的两种杂质,反之,当使用可与锂盐形成复合物而使锂盐更稳定的丁基氯化镁或叔丁基氯化镁时,根据丁基氯化镁或叔丁基氯化镁的使用当量,可将杂质降低至0%至1%的水平。相对于1当量的化学式7化合物,可使用0.2至1当量的丁基氯化镁或叔丁基氯化镁,例如,可使用0.5至1当量、0.5至0.7当量的丁基氯化镁或叔丁基氯化镁。
135、通过使化学式6化合物与化学式7化合物进行反应来获得化学式8化合物的步骤可包括:从化学式7化合物获得化学式7’化合物,并使化学式7’化合物与化学式6化合物偶合。
136、[化学式7’]
137、
138、从化学式8化合物获得化学式9化合物的步骤(步骤7)可通过已知方法进行。尽管不限于此,但可根据韩国公开专利公报第2017-0142904号(专利文件2)中所公开的内容,通过还原化学式8化合物来获得化学式9化合物。
139、根据上述方法,可使用化学式1化合物作为起始物,并经由总共7个短反应步骤以高产率和高质量获得化学式9化合物及作为最终目标化合物的化学式i化合物,上述化学式1化合物在商业上更容易获得化学式9化合物,上述化学式9化合物相当于作为sglt抑制剂的化学式i化合物的重要中间体。此外,上述sglt抑制剂的制备方法具有优异的经济可行性,因为上述sglt抑制剂无需特殊装置(诸如臭氧产生器)也可产生。
140、在本发明另一具体例中,化学式9化合物可通过包括以下步骤的方法制备:从化学式10化合物获得化学式11化合物;通过使化学式11化合物与化学式12化合物进行反应来获得化学式13化合物;以及从化学式13化合物获得化学式9化合物。
141、本发明提供化学式9化合物的制备方法,上述方法包括下述步骤:
142、从化学式10化合物获得化学式11化合物;
143、通过使化学式11化合物与化学式12化合物进行反应来获得化学式13化合物;以及
144、从化学式13化合物获得化学式9化合物。
145、[化学式10]
146、
147、[化学式11]
148、
149、[化学式12]
150、
151、[化学式13]
152、
153、[化学式9]
154、
155、在上述式中,
156、x、y和r4各自独立地为卤素,
157、b为或
158、在此情况下,ra、rb、rc和rd各自独立地为氢、卤素、羟基、巯基、氰基、硝基、氨基、羧基、氧代基、c1-7烷基、c1-7烷硫基、c2-7烯基、c2-7炔基、c1-7烷氧基、c1-7烷氧基-c1-7烷基、c2-7烯基-c1-7烷氧基、c2-7炔基-c1-7烷氧基、c3-10环烷基、c3-7环烷硫基、c5-10环烯基、c3-10环烷氧基、c3-10环烷氧基-c1-7烷氧基、苯基-c1-7烷基、c1-7烷硫基-苯基、苯基-c1-7烷氧基、单-或二-c1-7烷氨基、单-或二-c1-7烷氨基-c1-7烷基、c1-7烷酰基、c1-7烷酰基氨基、c1-7烷基羰基、c1-7烷氧基羰基、氨基甲酰基、单-或二-c1-7烷基氨基甲酰基、c1-7烷基磺酰基氨基、苯基磺酰基氨基、c1-7烷基亚磺酰基、c6-14芳基硫醇基、c6-14芳基磺酰基、c6-14芳基、5-13元杂芳基、5-10元杂环烷基、5-10元杂环烷基-c1-7-烷基、或5-10元杂环烷基-c1-7烷氧基;
159、环c为c3-10环烷基、c5-10环烯基、c6-14芳基、5-13元杂芳基、或5-10元杂环烷基;
160、所述烷基、烯基、炔基和烷氧基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-7烷基和c2-7炔基;
161、所述环烷基、环烯基、芳基、杂芳基和杂环烷基各自独立地未取代或具有选自由以下组成的组中的一个以上的取代基:卤素、羟基、氰基、硝基、氨基、巯基、c1-4烷基和c1-4烷氧基;
162、所述杂芳基和杂环烷基各自独立地包含选自由n、s和o组成的组中的一种以上的杂原子。
163、从化学式10化合物获得化学式11化合物的步骤为卤化化学式10化合物的羧基的过程。在溶剂中溶解化学式10化合物,并在催化剂的存在或不存在下与卤化试剂进行反应。可使用二氯甲烷、二氯乙烷等作为溶剂。尽管不限于此,可使用草酰卤、亚硫酰卤等作为卤化试剂。当使用草酰卤作为卤化试剂时,可使用二甲基甲酰胺作为催化剂,并且相对于化学式10化合物,可使用0.1wt%至1wt%的催化剂,但不限于此。
164、通过使化学式11化合物与化学式12化合物进行反应来获得化学式13化合物的步骤可在-35℃至-10℃的反应温度下进行以使副反应最小化。优选地,上述步骤可在-20℃至-10℃的反应温度下进行。相对于化学式11化合物,可使用1至3当量的化学式12化合物,优选地,可使用2至3当量的化学式12化合物,更优选地,可使用2至2.6当量的化学式12化合物,但不限于此。可使用如alcl3、fecl3、bicl3、zncl2和fe2o3等路易斯(lewis)酸,优选地,可使用alcl3,以实现化学式11化合物与化学式12化合物的反应。相对于化学式11化合物,可使用0.9至1.5当量的路易斯酸,优选地,可使用1.0至12当量的路易斯酸,但不限于此。
165、可通过还原化学式13化合物来制备化学式9化合物。
166、由于相较于化学式7化合物,化学式12化合物较便宜并且容易控制质量,因此比使用化学式7化合物更为有利。
167、同时,化学式10化合物可利用1)化学式5化合物、2)化学式6化合物或3)化学式14化合物制备得到。
168、在一具体例中,上述化学式10化合物可以是通过羧化化学式5化合物而获得的。
169、[化学式5]
170、
171、在上述式中,
172、r2、x和y各自独立地为卤素。
173、在另一具体例中,上述化学式10化合物可以是通过将化学式6化合物的醛基转化成羧基而获得的。
174、[化学式6]
175、
176、在上述式中,
177、r2和y各自独立地为卤素。
178、在另一具体例中,上述化学式10化合物可以是通过羧化化学式14化合物而获得的。
179、[化学式14]
180、
181、在上述式中,
182、x和y各自独立地为卤素,
183、r5为c1-4烷基。
184、同时,上述化学式6化合物可从化学式5化合物或化学式14化合物合成得到。
185、在本发明的一具体例中,上述化学式6化合物可以是通过将化学式5化合物的x取代基选择性地转化成醛基而获得的。此过程如上所述。
186、[化学式5]
187、
188、在上述式中,
189、r3、x和y各自独立地为卤素。
190、在另一具体例中中,
191、上述化学式6化合物可通过如下过程获得。从化学式14化合物获得化学式15化合物,从化学式15化合物获得化学式6化合物。
192、[化学式14]
193、
194、[化学式15]
195、
196、在上述式中,
197、x和y各自独立地为卤素,
198、r5为c1-4烷基。
199、在从1)化学式5化合物、2)化学式6化合物或3)化学式14化合物制备化学式10化合物,并再次由其制备化学式9化合物的方法使用化学式12化合物。由于相较于现有反应式中所使用的化学式7化合物,化学式12化合物较便宜,并且当使用化学式12化合物时,可解决在制备化学式7化合物时产生杂质所引起的问题,从而可获得高质量的化学式9化合物和最终目标物。
200、发明效果
201、根据本发明,可获得高产率和高质量的化学式9化合物,上述化学式9化合物相当于作为sglt抑制剂的化学式i化合物的重要中间体。由于本发明的sglt抑制剂的制备方法无需特殊装置(诸如臭氧产生器)也可生产sglt抑制剂,还可大幅改善经济可行性。
本文地址:https://www.jishuxx.com/zhuanli/20240905/287648.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表