增强Argonaute蛋白裂解活性的引导DNA及其在靶标检测中的应用
- 国知局
- 2024-09-19 14:47:15
本发明涉及增强argonaute蛋白裂解活性的引导dna及其在靶标检测中的应用,属于生化分析。
背景技术:
1、簇状规则间隔短回文重复序列及其相关系统(crispr)/cas是一种基因编辑和生物分析工具,由于其具有反式切割能力,已被广泛用于检测生物标志物、细菌和病毒等多种目标物。然而其作用需要一个邻近原间隔基序(pam)或靶序列内的原间隔基序侧翼位点。到目前为止,用一种cas酶实现一锅法检测多个靶标仍然是一种技术难题。argonaute(ago)是另外一种具有可编程内切酶活性的新一代基因编辑工具,主要来源于原核生物和真核生物。ago蛋白在引导rna(grna)或dna(gdna)的引导下,切割互补的入侵靶标,有效地作为内在免疫系统对抗外来遗传物质。值得注意的是,ago的切割具有精确靶向性、可编程性和不依赖pam序列的引导dna(gdna)的特点。因此,在分子诊断领域的应用已逐渐得到认可。目前比较突出的ago变异体有pyrococcus furiosus argonaute(pfago),thermusthermophilus argonaute(ttago)等,已广泛应用于核酸检测。pfago(87-99.9℃)和ttago(65-85℃)是具有动态波动结构的嗜热型ago,在生理温度下具有部分熔化的表面。这一特性被证明有利于获得更高的dna切割活性。然而,高温条件限制了它们的应用场景。
2、与嗜热型ago相反,嗜中温型ago,如clostridium perfringens argonaute(cpago)和cbago已经引起了研究人员的注意。cbago具有较低的温度要求,目前在科学研究中影响较为广泛。然而,嗜中温型ago由于其结构的致密性限制了它们的酶切活性。目前大多数涉及嗜中温型ago的应用依赖于各种信号扩增策略,如聚合酶链式反应、环状介导等温扩增、重组酶聚合酶扩增技术来满足灵敏度要求。这种繁琐的扩增过程不可避免地增加了经济和时间成本,降低了操作便利性,并极大地限制了嗜中温型ago的应用。因此,研究影响嗜中温型ago蛋白酶切活性的关键因素,有助于大幅提高其切割效率,可以极大地促进嗜中温型ago蛋白在多重目标物检测中的应用。
3、现有技术中主要有两种方法来增强cbago的裂解活性。其中一种是改造cbago的结构,而另一个是设计更高效的gdna。改造cbago结构具有挑战性,难预测,而且效果有限。因此,通过设计特定结构的gdna来增强cbago的切割活性具有更广泛的应用场景。然而,多碱基错配和dna的空间结构对cbago切割效率的影响尚未得到充分的研究。
技术实现思路
1、[技术问题]
2、本发明要解决的技术问题是:现有技术中argonaute蛋白切割效率有限,且在检测应用中步骤繁琐,检测灵敏度低。
3、[技术方案]
4、为解决上述技术问题,本发明提供如下技术方案:
5、在第一方面,本发明提供了一种增强argonaute蛋白裂解活性的引导dna,所述引导dna包括:
6、(a)dna酶;
7、(b)能够与argonaute蛋白结合的单链dna;
8、所述dna酶连接于所述单链dna的5'端。
9、在一种实施方式中,所述dna酶3’端通过磷酸二酯键与所述单链dna5’端连接。
10、在一种实施方式中,所述dna酶为8-17dnazyme。
11、在一种实施方式中,所述8-17dnazyme具有如下所示的核苷酸序列:5’tccgagccggtcgaa 3’。
12、在一种实施方式中,所述引导dna的长度为25~40nt。
13、在一种实施方式中,所述引导dna的5'端修饰了磷酸基团。
14、在一种实施方式中,所述argonaute蛋白为嗜中温argonaute蛋白。
15、在一种实施方式中,所述argonaute蛋白来源于丁酸梭菌(clostridiumbutyrium)。可选的,所述ar gonaute蛋白具有ncbi登录号wp_058142162.1所示的氨基酸序列。
16、在第二方面,本发明提供了一种检测靶标核酸的方法,所述方法包括:
17、(a)提供第一方面所述引导dna;
18、(b)提供argonaute蛋白;
19、(c)提供靶标核酸;所述靶标核酸上修饰了荧光基团和淬灭基团;所述靶标核酸与所述引导dna至少部分反向互补;
20、将(a)、(b)和(c)混合,使所述引导dna引导argonaute蛋白靶向裂解靶标核酸,通过测定荧光基团释放的荧光信号,测定样品中被裂解的靶标核酸含量。
21、在第三方面,本发明提供了一种测定样本中靶标物质的方法,所述方法包括:
22、(1)提供一种系统,所述系统具有:
23、核酸适配体,
24、cdna,
25、第一单链dna和第二单链dna;其中:
26、所述核酸适配体含有与cdna互补的第三互补片段;
27、所述第一ssdna含有与cdna互补的第一互补片段;
28、所述第二ssdna含有与cdna互补的第二互补片段;
29、所述第一ssdna和第二ssdna至少部分反向互补;
30、(2)使样本与所述系统接触,当样本中存在靶标物质时,核酸适配体与所述靶标物质特异性结合,释放cdna,cdna与所述第一ssdna和第二ssdna互补结合形成复合物;
31、(3)使发夹探针hp、发夹探针chp、核酸内切酶和信号探针与所述复合物混合,其中:
32、所述发夹探针hp包含与所述第一ssdna互补的片段、与第二ssdna互补的片段、核酸内切酶识别位点以及第一方面所述引导dna;
33、所述发夹探针hp包含环状区和茎秆区,环状区含有所述核酸内切酶识别位点,茎秆区含有与发夹探针chp互补的核苷酸片段;
34、所述发夹探针hp与所述复合物接触并互补杂交形成双链区,暴露核酸内切酶识别位点,核酸内切酶于核酸内切酶识别位点处切割所述发夹探针hp,使发夹探针hp释放所述引导dna;
35、(4)混合argonaute蛋白、zn2+以及步骤(3)所述引导dna,使所述引导dna引导argonaute蛋白靶向切割信号探针,其中:
36、所述信号探针连接有荧光基团以及淬灭基团;
37、所述引导dna与所述信号探针至少部分反向互补。
38、在一种实施方式中,所述第三互补片段长度大于所述第一互补片段与第二互补片段长度之和。
39、在一种实施方式中,所述第三互补片段长度为20nt,所述第一互补片段长度为与第二互补片段长度均为8nt。
40、在一种实施方式中,所述核酸适配体包括与靶标物质结合的寡核苷酸序列,可选为单链dna或rna,其能够与靶标物质特异性结合。
41、在一种实施方式中,所述发夹探针hp从5’端至3’端依次包括:与所述第一ssdna互补的片段、与第二ssdna互补的片段和第一方面所述引导dna;所述核酸内切酶识别位点位于所述与第二ssdna互补的片段上,所述核酸内切酶识别位点与第一方面所述引导dna相邻且无间隔序列。
42、在一种实施方式中,所述发夹探针chp为一段与发夹探针hp茎秆区部分互补的单链dna片段。发夹探针chp通过与发夹探针hp茎秆区互补结合稳定发夹探针hp的结构。
43、在一种实施方式中,第一方面所述引导dna位于所述发夹探针hp的茎秆区,所述发夹探针chp与第一方面所述引导dna的3’端通过碱基互补杂交。
44、在一种实施方式中,所述靶标物质包括微生物。所述微生物进一步可选为病原微生物,包括但不限于病毒、细菌、真菌、衣原体、支原体。作为选择的举例,没有限定,所述病原微生物可选为鼠伤寒沙门氏菌、单增李斯特菌、金黄色葡萄球菌、大肠杆菌中的至少一种。
45、在一种实施方式中,所述荧光基团、淬灭基团各自独立的位于所述信号探针的5’端或3’端。
46、在一种实施方式中,所述荧光基团包括但不限于:fam、alexa fluor 405、hex、cy3、cy5、rox、vic、joe、tet、texas red、或其组合。
47、在一种实施方式中,所述淬灭基团包括但不限于:tamara、bhq、dabsyl、或其组合。
48、在一种实施方式中,所述引导dna为单链dna分子。
49、在一种实施方式中,所述信号探针为单链dna分子。
50、在一种实施方式中,所述信号探针3’末端核苷酸为5’rag 3’。
51、在一种实施方式中,所述核酸适配体、cdna、第一单链dna、第二单链dna、发夹探针hp、发夹探针chp和信号探针选择自以下(a)~(c)中的至少一组:
52、(a):
53、核酸适配体:5’gcaatggtacggtacttcctcggcacgttctcagtagcgctcgctggtcatcccacagctacgtcaaaagtgcacgctactttgctaa 3’;
54、cdna:5’gggatgaccagcgagcgcta 3’;
55、第一单链dna:5’gcgctcgccgtctgtgatccccattct 3’;
56、第二单链dna:5’ccggctcggaagtggactctcccagccggcagacgtggtcatc 3’;
57、发夹探针hp:5’agaatggggatcaccggctgggagagtccacttccgagccggtcgaaaaccagcatagt 3’;
58、发夹探针chp:5’actatgct 3’;
59、信号探针:5’荧光基团-actatgctggttrag-淬灭基团3’;
60、(b):
61、核酸适配体:5’ccggacgcttatgccttgccatctacagagcaggtgtgacgg 3’;
62、cdna:5’gctctgtagatggcaaggca 3’;
63、第一单链dna:5’ccttgccacaatgtgactgttgcatga3’;
64、第二单链dna:5’ccggctcggaagtggactctccgagccggacattgtctacaga 3’;
65、发夹探针hp:5’tcatgcaacagtcccggctcggagagtccacttccgagccggtcgaaccttcaacgtct 3’;
66、发夹探针chp:5’agacgttg 3’;
67、信号探针:5’荧光基团-agacgttgaaggrag-淬灭基团3’;
68、(c):
69、核酸适配体:5’tttggtccttgtcttatgtccagaatgcgaggaaagtctatagcagaggagatgtgtgaaccgagtaaatttctcctactgggataggtggattat 3’;
70、cdna:5’cacacatctcctctgctata 3’;
71、第一单链dna:5’tagcagagaggacagagctaagcatct 3’;
72、第二单链dna:5’ccggctcggaagtggactcaagctaccggtgtcctgagatgtg 3’;
73、发夹探针hp:5’agatgcttagctcccggtagcttgagtccacttccgagccggtcgaacctctcgagtag 3’;
74、发夹探针chp:5’ctactcga 3’;
75、信号探针:5’荧光基团-ctactcgagaggrag-淬灭基团3’。
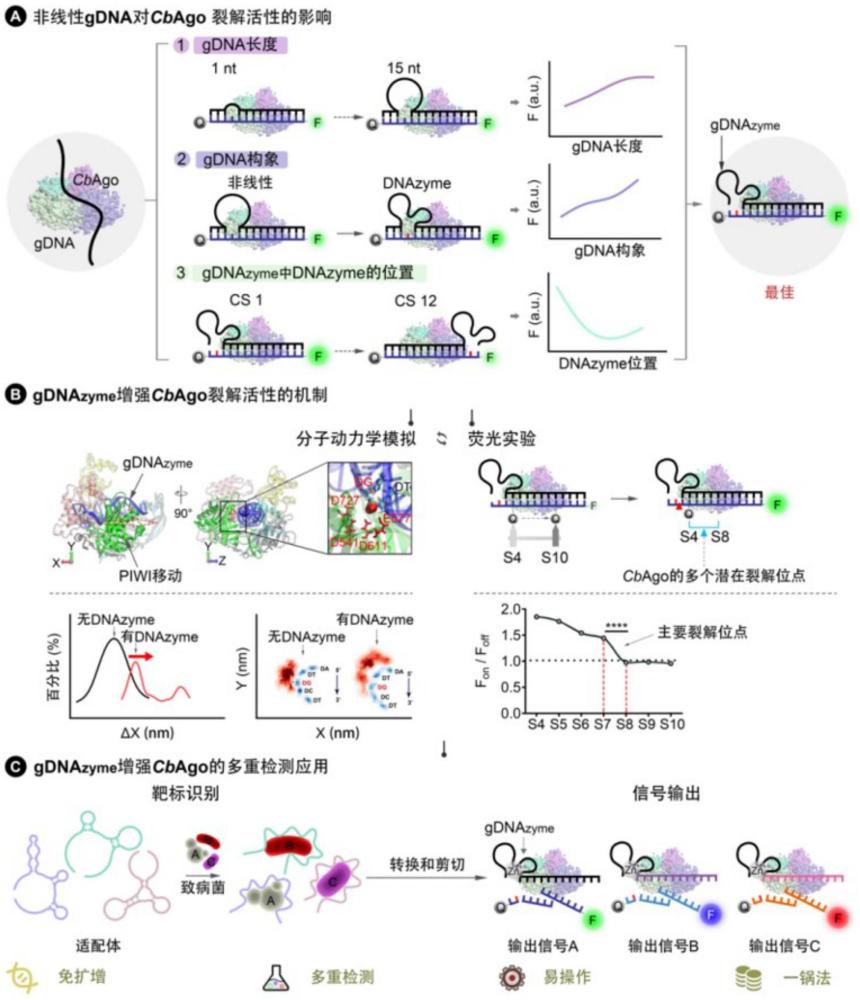
76、在一种实施方式中,每组信号探针上修饰的荧光基团不同,每组核酸探针上修饰的淬灭基团相同或不同。
77、在一种实施方式中,对所述核酸适配体和cdna的摩尔浓度比不做限定,可以是(10~1):1,进一步可选为1:1。所述核酸适配体的摩尔浓度可选为不低于0.05μm、不低于0.1μm、不低于0.2μm、不低于0.5μm或不低于1μm。优选为不低于0.2μm。
78、在一种实施方式中,对所述发夹探针hp和发夹探针chp的摩尔浓度比不做限定,可以是(10~1):1,进一步可选为1:1。所述发夹探针hp的摩尔浓度可选为不低于0.05μm、不低于0.1μm、不低于0.2μm、不低于0.5μm或不低于1μm。优选为不低于0.2μm。
79、在一种实施方式中,所述方法不涉及疾病的诊断和/或治疗。
80、在第四方面,本发明提供了一种反应体系,所述反应体系含有第一方面所述引导dna、信号探针和a rgonaute蛋白;所述引导dna和所述信号探针至少部分反向互补;所述信号探针连接有荧光基团以及淬灭基团;所述信号探针3’末端核苷酸为5’rag 3’。
81、在第五方面,本发明提供了一种试剂盒,所述试剂盒含有第一方面所述引导dna或第四方面所述反应体系。
82、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
83、与现有技术相比,本发明具备以下有益效果:
84、1、本发明提供的非线性gdna可显著增强cbago的切割效率。通过探究gdna的长度、gdna的构象以及构象的位置,本发明筛选出最佳的gdnazyme(一种包含dnazyme片段的gdna)。gdnazyme中dnazyme片段位于gdna5’端时,dnazyme片段具有增强cbago切割效率的协同增效效应,其通过拓展cbago的切割位点,使cbago的切割效率得到了显著的增强。
85、2、本发明打破了传统的嗜中温型ago需要联合各种扩增反应实现高灵敏性检测的思维定势。以往基于嗜中温型ago的检测会联合如聚合酶链式反应、环状介导等温扩增、重组酶聚合酶放大技术等,以满足灵敏度要求。本发明的提出,可以实现目标物的免扩增高灵敏检测,避免了繁琐的扩增过程,节约了经济和时间成本,提高了操作的便利性,极大地拓宽了嗜中温型ago的应用。
86、3、本发明基于gdnazyme增强cbago的作用机制,开发了基于gdnazyme介导cbago的免扩增适体传感器。首先基于致病菌可以识别并结合其对应的适体dna这一要点,另外设计了含有剪切酶识别位点和gdnazyme片段的发夹型探针,作为结构转换元件;最后借助核酸内切酶的切割作用输出gdnazyme与cbago共同作用于信号探针。这一设计充分利用了gdnazyme增强cbago的作用机制,并且在均相环境中实现检测,避免了固相分离等繁琐操作步骤。对单一金黄色葡萄球菌进行定量检测中,检测限达到了35cfu/ml,远高于直接使用gdnazyme组别(检测限为587cfu/ml)和线性gdna引导cbago组别(检测限为1.06×105cfu/ml)。此外,本发明所述方法可以对多种致病菌进行同时检测,灵敏度可以达到46cfu/ml。拓宽了cbago在检测领域的应用,同时为目标物多重检测提供了技术支撑。
本文地址:https://www.jishuxx.com/zhuanli/20240919/300222.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表