靶向PCSK9基因的寡核苷酸药物的中间体杂质检测方法与流程
- 国知局
- 2024-10-09 15:39:45
本发明属于药物检测,具体涉及一种靶向pcsk9基因的寡核苷酸药物的中间体杂质检测方法。
背景技术:
1、近年来,治疗用寡核苷酸作为一种可能治疗多种疾病的药物模式,越来越受到市场的关注,批准的治疗最初仅限于治疗罕见疾病。然而,随着靶向pcsk9基因的英克司兰钠注射液被批准用于动脉粥样硬化性心血管疾病患者的降胆固醇治疗后,该类寡核苷酸药物的研发和生产工作受到越来越多相关企业的重视。
2、目前寡核苷酸药物主要使用固相磷酸酰胺化学法进行合成,其过程包括迭代偶联、盖帽、氧化和脱保护步骤,从而延长核苷酸序列。然而,由于各步骤反应效率均无法达到100%,这使得中间体和成品中会含有较多序列相关杂质。序列相关杂质的存在使得寡核苷酸药物在使用过程中具有一定的安全性风险,为了提高使用安全性,需要对合成过程中产生的杂质进行鉴定和分离。
3、质谱和液相色谱在寡核苷酸药物质量研究方面的引入,为治疗性寡核苷酸药物的快速临床应用提供了技术基础。理论上来看,通过液相色谱对杂质进行分离,再通过质谱分析相应的杂质,不仅可以实现对成品的质量控制,并能快速指导工艺优化,节约成本投入。然而,实际生产过程中发现,液相色谱和质谱的联用方案在寡核苷酸药物及其中间体的鉴定和纯化中应用仍存在诸多问题和限制。
4、例如:
5、quality aspects of oligonucleotide drug development:srecificationsfor active pharmaceutical ingredients[j]。drug information journal, 2012, 46(5):611-626提出了可以分别利用质谱和液相色谱进行寡核苷酸的鉴别和纯度检测,但在液相色谱中仅能使用保留时间作为鉴别的可靠方式,但由于寡核苷酸杂质众多,分离状况欠佳,且仅依据单一的液相或质谱的方式进行序列鉴别并不足够有力。
6、assay, purity, and impurity profile of phosphorothioateoligonucleotide therapeutics by ion pair–hplc–ms[j].nucleic acidtherapeutics, 2022, 32(3):206-220建立了液质连用的方法分析不同硫代寡核苷酸药物有关物质,但其提供的方法中,不完全硫代序列杂质(p=o)1未分离,只能通过eic提取离子流进行含量检测,且未提出鉴别寡核苷酸的方式。
7、cn118050441a公开了一种分离并鉴定寡核苷酸n及其n-1杂质的方法,该方法使用阴离子交换色谱柱进行了寡核苷酸n及其n-1杂质的分离和鉴定,但其主要依赖于保留时间来进行鉴定,且使用的流动相为不挥发性盐溶液,与质谱兼容性差,无法联用质谱进行杂质鉴定。
8、因此,亟需开发重现性好、可以有效兼容质谱仪的寡核苷酸药物鉴别和纯度分析方法。
技术实现思路
1、针对现有技术中存在的上述缺陷和不足,本发明提供了一种靶向pcsk9基因的寡核苷酸药物的中间体杂质检测方法。
2、本发明提供的方法可同时鉴别和分离中间体中正义链和反义链的缩短序列杂质、硫代不完全序列杂质和增长序列杂质,具有良好的除杂效果。而且,该方法在各批次间重现性良好,可用于中间体的质量控制。
3、本发明的发明人发现,在采用液相色谱和质谱联用的方式对寡核苷酸类药物或其中间体进行杂质分离(又可称为“除杂”)和纯度鉴定时,液相色谱的流动相选择十分重要。一方面,不同的流动相对于寡核苷酸的分离具有不同的效果,尤其是流动相中离子的选择和用量的调整,对试剂的组成种类和浓度的调整等,可以影响杂质和主成分的分离情况;另一方面,液相色谱和质谱联用技术需要色谱选用的流动相具有良好的可挥发性,若使用挥发性差的流动相添加剂,挥发后残留的盐会导致质谱仪堵塞及损坏。
4、基于此,本发明提供一种靶向pcsk9基因的寡核苷酸药物的中间体杂质检测方法,其包括采用高效液相色谱对含有所述寡核苷酸药物中间体的供试溶液进行杂质分离和检测,其中,液相色谱的条件包括:
5、采用的色谱柱选自固定相采用十八烷基硅烷键合硅胶为填充剂的色谱柱;以及
6、流动相a选自1,1,1,3,3,3-六氟-2-丙醇和正己胺的水溶液;
7、流动相b选自甲醇和乙腈的混合溶液;
8、所述寡核苷酸药物包括正义链和反义链,所述正义链的核苷酸序列如seq id no:7所示,所述反义链的核苷酸序列如seq id no:8所示;
9、所述杂质包括核苷酸序列如seq id no:1-6所示的序列杂质中的一种或多种。
10、本发明中,“杂质”主要指核苷酸序列杂质(又可称为“序列杂质”),即与目标寡核苷酸序列不同(包括核苷酸序列的长度、核苷酸种类和排布等不同,也包括核苷酸序列上的修饰不同)的其他寡核苷酸序列。
11、采用本发明提供的方法可以检出选自以下中的任意一种或多种杂质:
12、寡核苷酸药物中间体的缩短序列杂质、增长序列杂质和硫代不完全杂质;
13、其中,所述缩短序列杂质包括在正义链和/或反义链的序列上缺失至少1个碱基的寡核苷酸序列;
14、所述增长序列杂质包括在正义链和/或反义链的序列上增加至少1个碱基的寡核苷酸序列;
15、所述硫代不完全序列杂质包括在正义链和/或反义链的序列上至少1个目标碱基没有被硫代修饰的寡核苷酸序列。
16、本发明中,缩短序列杂质对于核苷酸缺失的具体位置没有特别限制,只要与目标寡核苷酸序列相比,在寡核苷酸序列(无论正义链还是反义链)中缺失了至少一个核苷酸即为所述缩短序列杂质。本发明中,增长序列杂质对于核苷酸增加的位置没有特别限制,只要与目标寡核苷酸序列相比,在寡核苷酸序列(无论正义链还是反义链)中增加了至少一个核苷酸即为所述增长序列杂质。本发明中,硫代不完全序列杂质对于目标碱基未被硫代修饰的位置也没有特别限制,只要与目标寡核苷酸序列相比,在寡核苷酸序列(无论正义链还是反义链)中应当为具有硫代修饰的核苷酸位点未进行修饰,或是进行了其他类别的修饰,均可视为所述硫代不完全序列杂质。
17、例如,缩短序列杂质可以为相对于目标正义链(seq id no:7)而言,缺失其中任意1-20个核苷酸的寡核苷酸序列。例如核苷酸的缺失量可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
18、例如,缩短序列杂质可以为相对于目标反义链(seq id no:8)而言,缺失其中任意1-22个核苷酸的寡核苷酸序列。例如核苷酸的缺失量可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22个,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
19、例如,增长序列杂质可以为相对于正义链(seq id no:7)或是反义链(seq id no:8),在其序列中的任意位置增加至少一个核苷酸所得到的寡核苷酸序列。例如增加的核苷酸数量可以为1-100个,如1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、30、40、50、60、70、80、90、100个,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
20、优选地,所述硫代不完全序列杂质包括在正义链的序列上2个目标碱基(即正义链5’→3’的第一位g和第二位a)中的其中至少1个没有被硫代修饰的寡核苷酸序列。例如可以为正义链5’→3’的第一位g未被硫代修饰、第二位a未被硫代修饰,或是第一位g和第二位a均未被硫代修饰。
21、优选地,所述硫代不完全序列杂质包括在反义链的序列上4个目标碱基(即反义链5’→3’的第二位a、第三位a、第二十二位a和第二十三位a)中至少1个没有被硫代修饰的寡核苷酸序列。例如可以为反义链5’→3’的第二位a、第三位a、第二十二位a和第二十三位a中的任意1个、任意2个或任意3个未被硫代修饰,或是上述四个位点均未被硫代修饰。
22、应当注意的是,以上针对硫代不完全杂质的说明中,“未被硫代修饰”是指目标序列中本应当进行硫代修饰的位点没有进行硫代修饰,其既可以包括该位点没有进行任何修饰,也可以包括该位点进行了硫代修饰之外的其他任意类型的修饰。
23、根据本发明的一些优选实施方案,其中,所述杂质包括seq id no:1-6中的至少一种所示的序列。需要说明的是,seq id no:1-6中仅为示例性的列出了几种与目标正义链序列或目标反义链序列结构十分接近,从而较难与目标序列分离的杂质序列(例如利用现有技术中的方法无法将这些杂质序列与目标序列分离)。本领域技术人员应当能够理解到,在本发明提供的方法可以去除核苷酸序列如seq id no:1-6中任一项所述的杂质序列的情况下,该方法对于具有其他结构的杂质序列应当也能够去除,且可以得到与这些杂质序列至少相当的去除效果。
24、本发明提供的方法中所涉及的寡核苷酸药物中间体以及杂质至少包括如下寡核苷酸序列结构信息表中所列举的寡核苷酸序列。下表中:
25、标“_”的位置代表缺失1个碱基;
26、通过以下化学符号描述:
27、c=胞嘧啶,u=尿嘧啶,a=腺嘌呤,g=鸟嘌呤;m=2’-o-甲基修饰的糖,f=2’-f修饰的糖;evp=乙烯基磷酸酯键,s=硫代磷酸酯核苷间键;
28、g5=[[(1r,2r,3r,4r)-1-[[28-[[2-(乙酰氨基)-2-脱氧-β-d-吡喃半乳糖基]氧基]-13,13-双[[3-[[3-[[5-[[2-(乙酰氨基)-2-脱氧-β-d-吡喃半乳糖基]氧基]-1-氧代戊基]氨基]丙基]氨基]-3-氧代丙氧基]甲基]-11,18,24-三氧代-15-氧杂-12,19,23-三氮杂二十八烷-1-基]氧基]-2-甲氧基-5-β-d-呋喃核糖基]磷酸氢。
29、
30、根据本发明的优选实施方案,其中,所述杂质为核苷酸序列如seq id no:1-6所示的序列杂质的混合物。
31、根据本发明的优选实施方案,其中,流动相a中,1,1,1,3,3,3-六氟-2-丙醇的浓度为100-300mmol/l;正己胺的浓度为10-30mmol/l。
32、例如,流动相a中,1,1,1,3,3,3-六氟-2-丙醇的浓度可以为100mmol/l、120mmol/l、140mmol/l、160mmol/l、180mmol/l、200mmol/l、220mmol/l、240mmol/l、260mmol/l、280mmol/l、300mmol/l,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
33、例如,流动相a中,正己胺的浓度可以为10mmol/l、12mmol/l、14mmol/l、16mmol/l、18mmol/l、20mmol/l、22mmol/l、24mmol/l、26mmol/l、28mmol/l、30mmol/l,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
34、优选地,流动相a中,1,1,1,3,3,3-六氟-2-丙醇的浓度为200 mmol/l。
35、优选地,流动相a中,正己胺的浓度为25mmol/l。
36、根据本发明的优选实施方案,其中,流动相b中,甲醇和乙腈的体积比为1:1。
37、根据本发明的优选实施方案,其中,色谱柱的填充剂粒径为1.7-2.7μm。
38、例如,色谱柱的填充剂粒径可以为1.7μm、1.8μm、1.9μm、2μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
39、优选地,色谱柱的填充剂粒径为1.7μm。
40、根据本发明的优选实施方案,其中,色谱柱的规格为2.1-4.6mm×50-150mm。
41、例如,色谱柱的规格可以为4.6mm×100mm、4.6mm×250mm和2.1mm×150mm中的任一种。
42、优选地,色谱柱的规格为2.1mm×150mm。
43、在本发明的一些优选实施方案中,所述液相色谱条件中,洗脱梯度为:
44、
45、也即,所述液相色谱的洗脱梯度为:
46、0-20min时, 流动相b体积从25%变化至50%;
47、20-22min时,流动相b体积从50%变化至60%;
48、22-22.1min时,流动相b体积从60%变化至25%;
49、22.1-27min时,流动相b体积维持在25%。
50、根据本发明的优选实施方案,其中,所述供试溶液中,所述寡核苷酸药物的浓度为0.1-1mg/ml。(即,正义链的浓度为0.1-1mg/ml,或者,反义链的浓度为0.1-1mg/ml)
51、例如,所述寡核苷酸药物的浓度可以为0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml、0.55mg/ml、0.6mg/ml、0.65mg/ml、0.7mg/ml、0.75mg/ml、0.8mg/ml、0.85mg/ml、0.9mg/ml、0.95mg/ml、1mg/ml,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
52、优选地,所述供试溶液中,所述寡核苷酸药物中间体的浓度为0.5-0.75mg/ml。
53、根据本发明的优选实施方案,其中,液相色谱条件还包括:柱温为70℃。
54、根据本发明的优选实施方案,其中,液相色谱条件还包括:流速为0.27-0.33ml/min。例如可以为0.27 ml/min、0.28ml/min、0.29ml/min、0.3ml/min、0.31ml/min、0.32ml/min、0.33ml/min,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
55、优选地,流速为0.3 ml/min。
56、根据本发明的优选实施方案,其中,液相色谱条件还包括:检测波长为258-262nm。例如可以为258nm、259nm、260nm、261nm、262nm,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
57、优选地,检测波长为260nm。
58、根据本发明的优选实施方案,其中,液相色谱条件还包括:进样量为1-5μl。例如可以为1μl、2μl、3μl、4μl、5μl,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
59、优选地,进样量为2μl。
60、在一些更优选的实施方案中,所述寡核苷酸药物中间体和杂质的保留时间包括:
61、
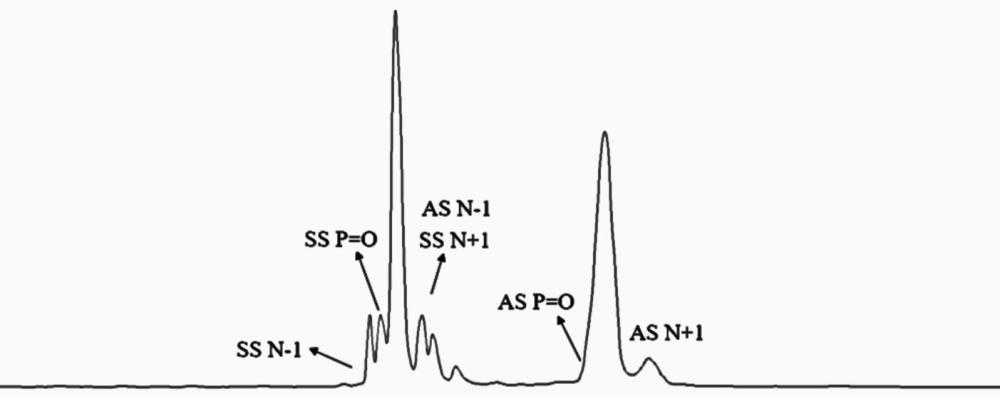
62、其中,保留时间的相对偏差rd小于1%。
63、根据本发明的优选实施方案,其中,所述方法还包括配制供试溶液的步骤,其包括将所述寡核苷酸药物与稀释剂接触。
64、本发明中,稀释剂可以为任意可用于液相色谱中稀释/溶解寡核苷酸药物或其中间体的试剂。
65、优选地,所述稀释剂为水和/或甲醇。也即,稀释剂可以为水(例如去离子水、超纯水等)、甲醇,或是甲醇的水溶液。
66、更优选地,所述甲醇的水溶液中,甲醇的含量为5-15体积%。例如可以为5体积%、6体积%、7体积%、8体积%、9体积%、10体积%、11体积%、12体积%、13体积%、14体积%、15体积%,或者也可以为上述任意两个值构成的范围,或是该范围中的任意中间值。
67、根据本发明的一些优选实施方案,其中,稀释剂为水。
68、根据本发明的一些优选实施方案,其中,所述方法还包括采用质谱对液相色谱得到的产物进行纯度检测的步骤。
69、优选地,质谱的条件包括:离子源为电喷雾离子源。
70、优选地,质谱的条件包括:采集极性为负极性模式。
71、优选地,质谱的条件包括:采集范围为m/z=600-3000。
72、优选地,质谱的条件包括:毛细管电压为3.0kv。
73、优选地,质谱的条件包括:干燥气体温度为350℃。
74、本发明所取得的有益效果至少包括:
75、本发明提供了一种可同时鉴别和分离目标寡核苷酸中间体正义链和正义链杂质1(缩短序列5’n-1),杂质2(硫代不完全序列杂质)、杂质3(增长序列杂质5’n+gms),以及目标反义链和反义链杂质4(缩短序列杂质5’n-1),杂质5(硫代不完全序列杂质)、杂质6(增长序列杂质5’n+afs)的方法。
76、其中,正义链中杂质1(缩短序列5’n-1),杂质2(硫代不完全序列杂质)、杂质3(增长序列杂质5’n+gms)与主峰间峰谷比均>1.00,峰形明显,能实现正义链主峰与3种杂质的分离。
77、反义链中除杂质5(硫代不完全序列杂质)外,杂质4(缩短序列5’n-1),、杂质6(增长序列杂质5’n+afs)与主峰间峰谷比均>1.00,峰形明显,能实现反义链主峰与2种杂质的分离。
78、在上述分离效果下,使用液相色谱联用高分辨质谱仪,进行正义链和反义链中间体的鉴别检测,根据正义链和反义链的指纹图谱中各峰的质谱数据进行分析,识别了相应杂质峰的分子量,并推测了其碱基缺失情况,基于序列的唯一性,通过分子量的差异,有效实现了目标寡核苷酸序列的鉴别。
79、此外,本发明提供的方法中通过甄选液相色谱选用的色谱柱和流动相,使得液相色谱分离得到的产物可以继续进行质谱鉴定,进一步提高分离产物的纯度鉴定精度和准确性,检测结果更加可信。
本文地址:https://www.jishuxx.com/zhuanli/20241009/309518.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。