药物递送系统及其使用方法与流程
- 国知局
- 2024-10-15 10:24:47
本公开总体与组织修复及医学领域有关。更具体而言,本公开是关于含有包含神经再生化合物的再生化合物的生物材料与药物递送平台、以及制造生物材料与药物递送平台的方法、以及使用这些生物材料与药物递送平台的治疗方法。
背景技术:
1、无论其原因为何,神经损伤都可能导致严重、在某些情况为重度的残疾与功能障碍。神经病变损伤尤其可造成慢性疼痛、丧失感觉、丧失部分或全部肌肉控制或其他不良影响。解决周边神经损伤的有害影响是相当大的挑战,尤其是当神经修复存在延迟或需要轴突在大的神经缺损或长距离上重新建立与周围目标的连接时。在这种情况下,再生轴突时常没有所需的化学及生理讯号来有效地再生并重新支配其终端目标器官。例如,相对较长的神经间隙可能会在近侧神经残端(nerve stump)经历神经营养因子的耗乏(depletion),而神经营养因子的浓度可能会在远侧神经残端的生长支持环境中下降。
2、尽管近来外科手术技术有所发展,但恢复全部功能的周边神经损伤患者的数量有限。因此,需要开发临床适用的技术来治疗神经损伤并恢复神经损伤后的感觉及功能结果。为了促进神经损伤与修复后功能及感觉的有效恢复,介入或治疗应支持轴突再生及/或增加再生其轴突的神经元的数量。
技术实现思路
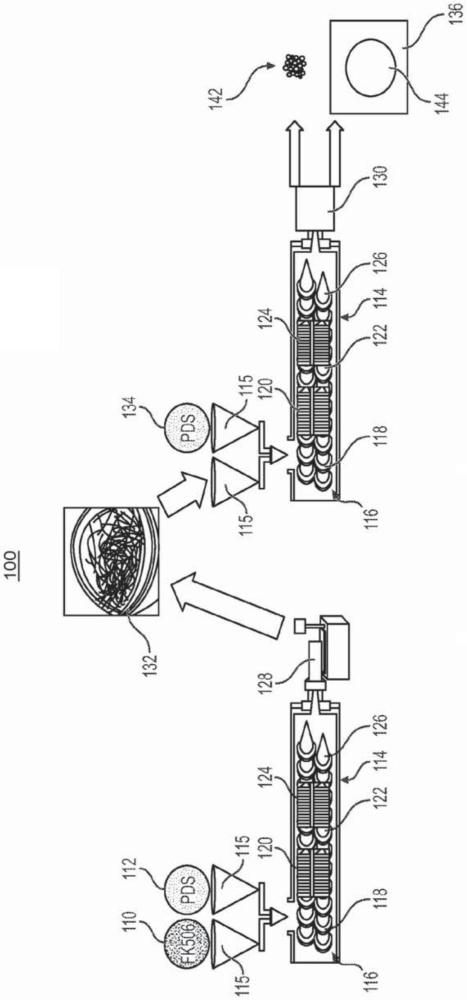
1、根据本公开,生物材料可包含再生剂如神经再生剂或免疫抑制剂。生物材料可用于组织损伤及直接修复(例如直接神经修复)或与植入物(例如神经移植物)一起使用,可附接于植入物(例如固定于植入物的表面),或者可掺入作为植入物的一部分。尤其,生物材料可包括掺入生物材料的一个或多个区域或表面的fk506,该生物材料适于植入在损伤神经处或附近。以此方式,生物材料可用于形成局部药物递送系统以促进损伤组织例如神经组织的修复。
2、一方面,制备可植入生物材料的方法可包括将包括聚二氧环己酮聚合体之聚合物与包括至少一种亲免疫素配体之神经再生剂或免疫抑制剂进行结合、熔化所述聚合物、以及挤出经结合之所述聚合物与所述神经再生剂或免疫抑制剂以形成所述可植入生物材料。
3、另一方面,制备可植入生物材料的方法可包含将聚合物与fk506进行结合、熔化所述聚合物、以及挤出经结合的所述聚合物与fk506以形成所述可植入生物材料。
4、另一方面,植入物可包含聚二氧环己酮聚合体及与所述聚二氧环己酮聚合体结合的至少一种亲免素配体。
5、另一方面,植入物可包含生物材料,所述生物材料包含聚合物及含有于所述聚合物的fk506。所述植入物的生物材料能够以被挤出的丸粒、棒、片材、弹簧或纤维的形式之一种或多种被掺入神经植入物中。
6、本公开的其他目的、特征及优点将自以下详细描述而变得明显。然而,应当理解,详细描述及实施方式虽然指示了本公开的示例性实施方式,但仅以说明的方式提出,因为对于所属技术领域中具有通常知识者而言,在本发明的精神及范围内的各种变化与修改会根据该详细描述而变得显而易见。需注意,仅因特定化合物归属于一个通式并非意指其不能够也属于另一个通式。
7、单数形式「一」、「一个」、「所述」包括复数之指代,除非上下文另有说明。术语「大约」及「约」是指与参考数字或数值几乎相同。如本文所用,术语「大约」及「约」通常应理解为涵盖指定量或数值的±10%。在申请专利范围及说明书中使用的术语「或」是用于表示「及/或」,除非明确指出仅指替代方案或替代方案相互排斥,尽管本公开支持仅指替代方案与「及/或」。如本文所用,「另一」可表示至少第二个或更多个。如本文所用,术语「植入」及「植入物」不需要放置于对象内使得该植入物位于皮肤或其他组织之下。相反地,术语「植入物」还包括用于放置在皮肤组织上的贴片、用于皮肤组织的包覆物、以及用于放置在黏膜上或黏膜附近或其他组织表面上的装置。
8、本公开的实施方式与使用神经再生剂或免疫抑制剂有关。如本文所用,术语「神经再生或免疫抑制剂」是指:一种或多种神经再生剂且不存在免疫抑制剂、不存在一种或多种神经再生剂且存在免疫抑制剂、彼此相异的单一神经再生剂及单一免疫抑制剂、存在既为神经再生性亦为免疫抑制性的单一试剂(例如fk506)、多种神经再生剂及多种免疫抑制剂、单一神经再生剂及多种免疫抑制剂、或多种神经再生剂及单一免疫抑制剂,而无关术语「神经再生或免疫抑制剂」是以单数还是复数形式呈现,或被简称为「试剂」。此外,尽管本文描述了用于神经修复的神经再生剂,但可想到能够使用适用于神经以外的组织的再生剂。
9、前文的一般描述与下文的详细描述均仅为示例性及解释性的,而非对所要求保护特征的限制。如本文所用,术语「包括」、「包含」、「含有」、「具有」或其其他变体旨在涵盖非排他性的包含,从而包括组件列表的过程、方法、物品或设备不仅包括该等组件,还可能包括其他未明确列出的元素或此类所固有的组件。此外,此处使用的术语「示例性」是指「示例」,而非「理想」。此外,用于描述数值范围的术语「之间」旨在包括本文所述的最小值及最大值。
10、所使用的术语及表达是用作描述而非限制,并且在使用此类术语及表达时,并非意在排除所示出及描述的特征或其部分的任何等同物,但应理解,在要求保护的公开范围内可以进行各种修改。
技术特征:1.一种制备可植入生物材料的方法,包括:
2.根据权利要求1所述的方法,其中所述至少一种亲免素配体包括环孢菌素a或fk506。
3.根据权利要求1或2所述的方法,其中经结合的所述聚合物及所述至少一种亲免素配体被挤出以形成丸粒。
4.根据前述权利要求任一项所述的方法,其中经结合的所述聚合物及所述至少一种亲免素配体被挤出以形成片材。
5.根据权利要求1至3中任一项所述的方法,其中经结合的所述聚合物及所述至少一种亲免素配体被挤出以形成弹簧状生物材料。
6.根据权利要求1至3中任一项所述的方法,其中所述聚合物及所述至少一种亲免素配体被挤出以形成纤维。
7.根据权利要求6所述的方法,其中所述纤维包含一个或多个结。
8.根据权利要求6所述的方法,其中所述纤维的直径为约50μm至约600μm。
9.根据权利要求6所述的方法,其中所述纤维的直径为约100μm至约400μm。
10.根据前述权利要求任一项所述的方法,其中所述可植入生物材料被包含于植入物中。
11.根据权利要求10所述的方法,其中所述植入物为神经包覆物。
12.根据权利要求10所述的方法,其中所述植入物为神经连接器。
13.根据权利要求10所述的方法,其中所述植入物为预卷的神经包覆物。
14.根据权利要求10所述的方法,其中所述植入物为神经移植物。
15.根据权利要求14所述的方法,其中所述神经移植物包含去细胞化材料。
16.根据前述权利要求任一项所述的方法,其中所述可植入生物材料包含于小肠黏膜下层中。
17.根据前述权利要求任一项所述的方法,其中所述至少一种亲免素配体包括fk506,挤出后的所述可植入生物材料中fk506的含量按重量计为约1%至约20%。
18.根据前述权利要求任一项所述的方法,其中所述神经再生剂或所述免疫抑制剂包含多种神经再生剂、多种免疫抑制剂、或至少一种神经再生剂与至少一种免疫抑制剂。
19.根据权利要求1至18中任一项所述的方法,其中所述神经再生剂或所述免疫抑制剂包含至少一种药剂,其同时作为神经再生剂和免疫抑制剂。
20.一种制备可植入生物材料的方法,包括:
21.根据权利要求20所述的方法,其中经结合的所述聚合物及fk506被挤出以形成丸粒。
22.根据权利要求20所述的方法,其中经结合的所述聚合物及fk506被挤出以形成片材。
23.根据权利要求20所述的方法,其中经结合的所述聚合物及fk506被挤出以形成弹簧状生物材料。
24.根据权利要求20所述的方法,其中经结合的所述聚合物及fk506被挤出以形成纤维。
25.根据权利要求24所述的方法,其中所述纤维包括一个或多个结。
26.根据权利要求24所述的方法,其中所述纤维的直径为约50μm至约600μm。
27.根据权利要求24所述的方法,其中所述纤维的直径为约150μm至约400μm。
28.根据权利要求20至27中任一项所述的方法,其中所述可植入生物材料被包含于植入物中。
29.根据权利要求28所述的方法,其中所述植入物为神经包覆物。
30.根据权利要求28所述的方法,其中所述植入物为神经连接器。
31.根据权利要求28所述的方法,其中所述植入物为预卷的神经包覆物。
32.根据权利要求28所述的方法,其中所述植入物为神经移植物。
33.根据权利要求32所述的方法,其中所述神经移植物包含去细胞化材料。
34.根据权利要求20至33中任一项所述的方法,其中所述可植入生物材料包含于小肠黏膜下层中。
35.根据权利要求20至34中任一项所述的方法,其中挤出后的所述可植入生物材料中fk506的含量按重量计为约1%至约20%。
36.根据权利要求20至35中任一项所述的方法,其中所述聚合物为均聚物、共聚物及/或聚合物掺合物,包含以下单体的一种或多种:乙交酯、丙交酯、己内酯、对二氧环己酮、三亚甲基碳酸酯、纤维素衍生物的单体、以及聚合以形成聚酯的单体。
37.一种植入物,包括:
38.根据权利要求37所述的植入物,其中所述至少一种亲免素配体包含环孢菌素a或fk506。
39.根据权利要求37所述的植入物,其中所述聚二氧环己酮及所述至少一种亲免素配体形成为丸粒、片材、弹簧或纤维的一种或多种。
40.根据权利要求37所述的植入物,其中所述聚二氧环己酮及所述至少一种亲免素配体包含于一条或多条直径为约50μm至约600μm的纤维中。
41.根据权利要求37所述的植入物,其中所述聚二氧环己酮聚合体及所述至少一种亲免素配体包含于一条或多条直径为约150μm至约400μm的纤维中。
42.根据权利要求37至41中任一项所述的植入物,其中所述植入物为神经包覆物。
43.根据权利要求37至41中任一项所述的植入物,其中所述植入物为神经连接器。
44.根据权利要求37至41中任一项所述的植入物,其中所述植入物为预卷的神经包覆物。
45.根据权利要求37至41中任一项所述的植入物,其中所述植入物为神经移植物。
46.根据权利要求45所述的植入物,其中所述神经移植物包含去细胞化材料。
47.根据权利要求37所述的植入物,其中所述聚二氧环己酮及所述至少一种亲免素配体被夹在多层材料层之间。
48.根据权利要求47所述的植入物,其中所述材料层为小肠黏膜下层。
49.一种植入物,包括:
50.根据权利要求49所述的植入物,其中所述聚合物为均聚物、共聚物及/或聚合物掺合物,包含以下单体的一种或多种:乙交酯、丙交酯、己内酯、对二氧环己酮、三亚甲基碳酸酯、纤维素衍生物的单体、以及聚合以形成聚酯的单体。
51.根据权利要求49所述的植入物,其中所述生物材料包含纤维。
52.根据权利要求51所述的植入物,其中所述纤维的直径为约50μm至约600μm。
53.根据权利要求51所述的植入物,其中所述纤维的直径为约100μm至约400μm。
54.根据权利要求49至53中任一项所述的植入物,其中所述植入物为神经包覆物。
55.根据权利要求49至53中任一项所述的植入物,其中所述植入物为神经连接器。
56.根据权利要求49至53中任一项所述的植入物,其中所述植入物为预卷的神经包覆物。
57.根据权利要求49至53中任一项所述的植入物,其中所述植入物为神经移植物。
58.根据权利要求57所述的植入物,其中所述神经移植物包含去细胞化材料。
59.根据权利要求49所述的植入物,其中所述生物材料被夹在多层材料层之间。
60.根据权利要求59所述的植入物,其中所述材料层为小肠黏膜下层。
61.根据权利要求49至60中任一项所述的植入物,其中所述聚合物为可注射聚合物。
62.根据权利要求61所述的植入物,其中所述可注射聚合物包含水凝胶。
63.根据权利要求61所述的植入物,其中所述可注射聚合物包含胶态凝胶。
64.根据权利要求61所述的植入物,其中所述可注射聚合物包含微胞。
65.一种治疗对象的方法,其特征在于包含将权利要求37至64中任一项所述的植入物植入对象。
66.根据权利要求65所述的方法,其中所述植入物被植入所述对象的周边神经。
67.根据权利要求65或66所述的方法,其中所述对象为哺乳动物。
68.根据权利要求67所述的方法,其中所述对象为人。
技术总结本公开提供了一种制备可植入生物材料的方法,包含将包括聚二氧环己酮聚合体的聚合物与包括至少一种亲免素配体的神经再生剂或免疫抑制剂进行结合,并熔化所述聚合物。所述方法进一步包含挤出经结合的所述聚合物与所述神经再生剂或所述免疫抑制剂以形成所述可植入生物材料。技术研发人员:卡斯拉·塔伊达朗,贾斯汀·德乌尔林,安吉洛·斯科佩利亚诺斯,罗伯特·C·迪卢奇奥受保护的技术使用者:阿克松根股份公司技术研发日:技术公布日:2024/10/10本文地址:https://www.jishuxx.com/zhuanli/20241014/317602.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表