生成新型amiRNA的组合物和方法与流程
- 国知局
- 2024-11-19 10:03:38
背景技术:
1、本发明一般涉及amirna(人工微rna)技术。
2、rna干扰(rnai)是一种生物学过程,其中通过小互补rna抑制给定基因的表达。这样的小rna中的一类称为微rna(mirna),其负责沉默所有已知真核生物中的数十万个基因。mirna源自特定细胞酶复合物对初级mirna的加工。
3、给定初级mirna的主要部件是支架和引导/随从区(guide/passenger)。支架进一步分为基部、基底茎(basal stem)和环。这些区域中的特定结构和核苷酸序列调节初级mirna加工成mirna的效率和精度以及随后沉默靶信使rna(mrna)的效力。
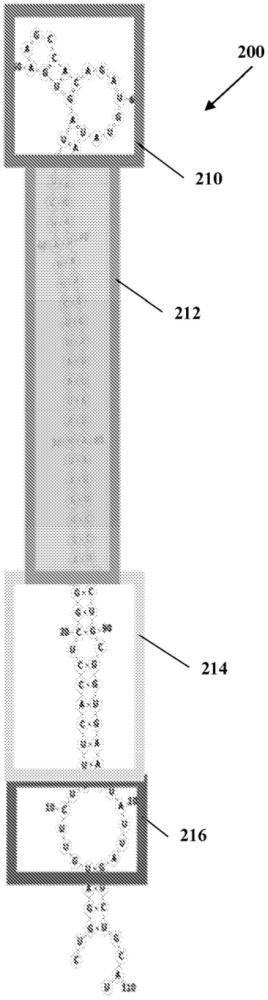
4、引导/随从区负责靶向特定mrna。在大多数情况下,引导/随从区相当于成熟mirna(又名mirna-mirna*双链体)。图1描绘了从初级mirna加工为mirna的示意图。mirna由rna聚合酶ii转录,作为加帽和多腺苷酸化的初级转录物(pri-mirna)的一部分,这些转录物可以是蛋白质编码的或非编码的。初级转录物由drosha核糖核酸酶iii酶切割,以产生大约70nt的茎环前体mirna(pre-mirna),该前体mirna进一步由细胞质中的细胞质dicer核糖核酸酶切割,以生成成熟mirna(引导)和反义mirna星(mirna)产物。成熟mirna(引导)被整合到rna诱导沉默复合物(risc)中,该复合物通过与mirna的不完全碱基配对识别靶mrna,并且最常见的结果是靶mrna的翻译抑制或不稳定(mrna靶向)。
5、生成amirna背后的原理是产生具有增强的效力的rnai分子,这些分子可以潜在地靶向细胞中的任何rna。加工和靶向过程由每个细胞中已经存在的酶复合物辅助(不同于基因表达的其他调节方法,诸如crispr/cas9),使治疗剂的构建更加可行和安全。此外,amirna可以从rna聚合酶ii启动子表达,从而产生较少的细胞毒性作用。
6、目前生成amirna构建体的方法对于高通量应用来说可能很繁琐,并且成本和时间效率低下。
7、本发明试图解决这些问题以及其他问题。
技术实现思路
1、本文提供了用于生产或生成一种或多种amirna的方法;还提供了可用于该方法的构建体和组合物。本公开内容中提供的方法和构建体是用于生产新一代amirna的高效方法。
2、所述方法和组合物的部分内容在以下描述中阐述,并且部分内容将从描述中显而易见,或者可以通过所述方法和组合物的实践来了解。所述方法和组合物的优点将通过所附权利要求中特别指出的元素和组合来实现和获得。应当理解,前述一般描述和以下详细描述都仅是示例性和解释性的,并不限制所要求保护的方法和组合物。
3、因此,本发明的目的是不将任何先前已知的产品、制造产品的工艺或使用产品的方法包含在本发明中,使得申请人保留权利并特此披露对任何先前已知的产品、工艺或方法的免责声明。进一步指出的是,本发明并不旨在将任何不符合uspto(35u.s.c.§112,第一段)或epo(epc第83条)书面描述和实施要求的产品、制造产品的工艺或使用产品的方法包含在本发明的范围中,使得申请人保留权利并特此披露对任何先前描述的产品、制造产品的工艺或使用产品的方法的免责声明。在实施本发明时,遵守epc第53(c)条和epc第28(b)和(c)条可能是有利的。明确保留以下:明确排除在本申请的系列中或任何其他系列中或任何第三方的任何先前提交的申请中的申请人的任何一个或多个授权专利的主题的实施方式的所有权利。本文中的任何内容均不应被视为承诺。
技术特征:1.一种生成amirna和修饰所选的初级mirna的方法,包括:
2.根据权利要求1所述的方法,其中,修饰基底茎的总长度为9至13个碱基对,最佳长度为11个碱基对。
3.根据权利要求2所述的方法,进一步包括检查所述基部修饰构建体、所述基底茎修饰构建体和所述环修饰构建体以形成预期结构。
4.根据权利要求3所述的方法,进一步包括与mire和mir155相比,通过所述amirna构建体降低pten mrna的表达。
5.根据权利要求4所述的方法,其中,所述环修饰构建体是与seq id no:3-9具有至少75%的序列同一性的环区。
6.根据权利要求5所述的方法,其中,所述茎修饰构建体与seq id no:1具有至少75%的序列同一性。
7.根据权利要求4所述的方法,其中,所述环区与seq id no:10-11具有至少75%的序列同一性。
8.根据权利要求4所述的方法,进一步包括所述amirna构建体的drosha和dicer加工并检测比随从链数量多数千个数量级的引导链。
9.根据权利要求4所述的方法,进一步包括drosha加工并且所述amirna构建体比mire和mir155更有效地被加工。
10.一种异源或合成或人工单链核糖核酸(rna)序列,包括:(i)所选的初级mirna及其互补物,以及(ii)所述所选的初级mirna及其互补物之间的基部区,其中,所述基部区的核苷酸序列与seq id no:1具有至少75%的序列同一性。
11.一种异源或合成或人工单链核糖核酸(rna)序列,包括:(i)所选的初级mirna及其互补物,以及(ii)所选的初级mirna和环区之间的基部区和基底茎,其中,所述基部区、所述基底茎区和所述环区的核苷酸序列与seq id no:3-9具有至少75%的序列同一性。
12.一种异源或合成或人工单链核糖核酸(rna)序列,包括:(i)所选的初级mirna及其互补物,以及(ii)连接至所述所选的初级mirna的环区,并且所述环区的核苷酸序列同一性与seq id no:10-11具有至少75%的序列同一性。
13.一种细胞,表达:根据权利要求10-12中任一项所述的rna或其互补序列;或根据权利要求12所述的dna或其互补序列;或根据权利要求4-6中任一项所述的载体。
14.根据权利要求13所述的细胞,其中,所述rna被加工成:根据权利要求4-6中任一项所述的微rna或其互补序列;或由根据权利要求4-6中任一项所述的dna编码的微rna。
技术总结本文提供了用于生产或生成一种或多种amiRNA的方法,还提供了可用于该方法的构建体和组合物,并且所提供的方法和构建体是用于生产新一代amiRNA的高效方法,其中可以通过从不同的内源性和修饰的初级miRNA产生基部区、基底茎区和环区的杂交构建体来修饰miRNA。技术研发人员:朱塞佩·米利泰洛,克里斯托夫·费尔曼,约翰内斯·朱伯受保护的技术使用者:米瑞莫斯公司技术研发日:技术公布日:2024/11/14本文地址:https://www.jishuxx.com/zhuanli/20241118/331353.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。