合成的基因组编辑系统的制作方法
- 国知局
- 2024-07-17 12:33:13
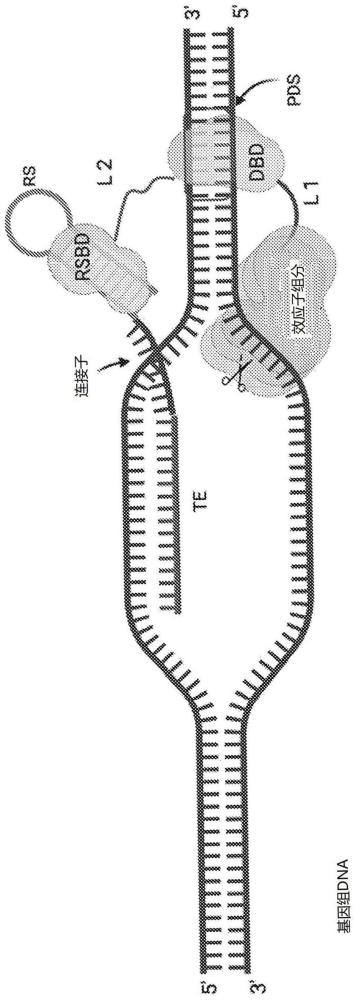
发明领域本发明提供了一种合成的用于dna修饰的模块化系统,如可以用于基因组编辑,其包含具有dna靶向能力和结合模块化多肽的识别模块的能力的靶向核酸,其中模块化多肽还包括作为单独模块的效应子组分。效应子组分可以是单独或例如在二聚化后用于修饰基因的结构或调节基因的蛋白质组分。理想地,它可以是包含连接的自组装短肽的多聚体的人工切口酶,如本文现在也教导的。通过在模块化多肽组分中另外包括缺乏酶活性并且识别靶标中的预定序列的短肽dna结合组分,已经获得了完全合成的基因修饰工具,其远小于crispr-cas9单向导rna(sgrna)基因修饰系统,从而易于递送至细胞。多肽组分可以在单个aav载体中与靶向核酸一起递送。发明背景rna引导的crispr-cas9系统和其他rna引导的crispr-cas系统已经彻底改变了基因编辑领域,因为最初的研究显示sgrna在靶dna中的原间隔序列(protospacer)邻近基序(pam)识别时指导crispr-cas9双链dna断裂的能力。然而,关于将这种rna引导的dna靶向系统用于所有所需目的,尤其是用于治疗性基因组修饰,仍有待解决的若干限制。一个如此认识到的缺点是限制有效aav包装的尺寸。具有sgrna的酿脓链球菌(streptococcuspyogenes)cas9(spcas9)(最广泛使用的cas9版本)的大小为4.1kbp(1368aa),并且最近鉴定的较小cas酶仍然是尺寸相当大的核酸酶,并且对于所需的载体递送而言不是最佳的。aav的总体大小仅允许包装至多5kb的异源序列。此外,免疫原性是人体内治疗应用的考虑因素。已经在成人群体中报道了酿脓链球菌cas9反应性t细胞。targetgene biotechnologies ltd.的公开的国际申请wo2013/088446提出了一种替代性dna编辑系统,其采用经由具有特异性赋予核酸(scna)的连接结构域连接的fok1核酸酶结构域。scna包含与靶核酸序列互补的核苷酸序列和能够将scna特异性连接至连接结构域的识别组分,例如scna的识别组分可以是特异性结合配偶体对或天然存在的rna适体之一,其识别其同源多肽结合组分。需要此类人工核蛋白复合物在靶dna上配对以实现fok1核酸酶结构域的二聚化。此外,由此提供的fok1核酸酶必须能够与dna有效相互作用以在靶位点处产生双链dna断裂。然而,wo2013/088446仅提供了任何治疗效用的预示性例证,并且对这种系统的效率仍然存在疑问。发明概述在这种情况下,发明人已经着手提供用于基因修饰的全合成模块化系统,作为使用crispr-cas/sgrna系统的替代方案,其在核酸酶模式下为预定靶位点处的dna靶双链或单链切割提供良好的效率,并且可以被设计成提供尺寸小得多的基因编辑系统。使用现在教导的人工切口酶可实现的小尺寸提供了选择多种递送手段的机会,包括用一种或多于一种靶向rna递送单一aav载体。在一个方面,本发明提供了用于修饰靶核酸(例如靶dna)的核蛋白复合物,其包含(a)靶向核酸和(b)模块化多肽组分,其中所述靶向核酸包含:(i)与靶区域互补的靶向核酸元件(在本文中也称为靶向元件,te);(ii)与所述模块化多肽组分的核酸识别模块(例如rna支架结合结构域,rsbd)特异性相互作用的识别元件(例如rna支架,rs),和(iii)连接所述靶向元件和所述识别元件的连接序列,并且所述模块化多肽组分包含以下所连接的单独功能模块:(a)所述核酸识别模块,其缺乏酶活性;(b)dna结合结构域(dbd),其识别靶中的预定序列,模块(a)和所述dbd不是在连接中天然存在的,和(c)用于修饰靶的效应子组分,由此将发生由所述靶向核酸的靶向元件和所述dbd指导的位点特异性修饰,和(d)任选地,或如果需要,第一接头和/或第二接头,由此连接模块(a)、(b)和(c),其中所述dbd是不超过70-75个氨基酸残基的多肽序列,例如不超过30mer、不超过25mer、不超过20mer,优选不超过15mer。不受理论的束缚,dbd的预期目的是在结合预定序列(pds)时使靶向的dsdna的结构失去稳定,以便促进靶向核酸序列对dsdna结构的可及性以进行杂交。可以如实施例1中所例示的评估这种功能能力,例如,使用包括所选择的pds和t7核酸内切酶1(t7e1)的dsdna来评估dna结构。t7e1是众所周知的结构选择性酶,其将检测dsdna中的结构畸形。将认识到在dbd多肽与pds结合时检测所需结构变形的其他方法。dbd可以对单个预定序列具有结合亲和力,但也可以具有结合多于一个预定序列的能力。要求dbd与靶向核酸的靶向元件一起指导位点特异性修饰。然而,dbd被视为不仅仅是用于定位在所需目标部位的辅助工具;它被视为在促进靶向元件的杂交中具有结构作用,从而促进总体期望的靶标修饰。因此将认识到,在这种情况下提供短dbd多肽序列与使用例如锌指蛋白或tale阵列仅将效应子或效应子的部分定位在特定dna序列处是不可比较的。通常,本发明的模块化多肽的效应子组分将是末端模块。优选地,核酸识别模块(例如rsbd)也将是末端模块。因此,优选地,模块化多肽组分将包含:(a)所述核酸识别模块;(b)直接与(a)连接的所述dna结合结构域(dbd),其识别靶中的预定序列,模块(a)和所述dbd在连接中不是天然存在的;(c)用于修饰靶的直接与(b)连接的效应子组分,由此将发生由靶向核酸的靶向元件和所述dbd指导的位点特异性修饰,和(d)任选地,或如果需要,第一接头和/或第二接头,其分别提供所述dbd与所述效应子组件和所述核酸识别模块的直接连接。模块化多肽组分的模块通常是线性连接的。因此,模块(a)、(b)和(c)可以例如在n-末端与(a)线性连接并且在c-末端与效应子组分线性连接,反之亦然。以这种方式,靶向核酸与模块化多肽组分的识别模块的相互作用远离效应子组分。靶向核酸可以是rna,优选完全是rna。将认识到核酸靶向元件在功能目的上与crispr-cas9 grna相当。如上所述,方便且优选地,该靶向元件可以通过连接子与提供rna支架(可能可替代地称为rna适体)的rna基序连接,所述rna支架结合模块化多肽中的同源蛋白质或肽模块。在这种情况下,模块化多肽组分的rna支架识别模块可以称为rna支架结合结构域(rsbd)。以这种方式,核蛋白复合物可以有利地包含(i)能够从编码核酸序列表达为rna的核酸组分(nac)和(ii)也可从单个编码核酸序列表达的模块化多肽组分。因此,在优选的实施方案中,用于修饰靶核酸(例如靶dna)的本发明的核蛋白复合物包含(a)全核酸组分(nac)和(b)模块化多肽组分,其中nac包含:(i)与靶区域互补的靶向元件(te);(ii)特异性结合所述模块化多肽组分的rna支架结合结构域(rsbd)的rna支架(rs),和(iii)连接所述te和rs的连接序列,并且所述模块化多肽组分包含以下连接的单独功能模块:(a)所述rsbd;(b)与(a)连接的dna结合结构域(dbd),其识别靶中的预定序列,模块(a)和所述dbd在连接中不是天然存在的;(c)用于修饰靶的与(b)连接的效应子组分,由此将发生由所述nac的靶向元件和所述dbd指导的位点特异性修饰,和(d)任选地,或如果需要,将所述dbd分别连接到所述效应子组分和rsbd的第一接头和/或第二接头,其中如以上讨论的,所述dbd是不超过70-75个氨基酸残基的多肽序列,例如不超过30mer、不超过25mer、不超过20mer,优选不超过15mer。参见图1。将理解模块化多肽组分的单独功能模块可以有利地独立取代并由单个核酸编码,使得它们以限定的线性连续连接。靶可以是任何靶核酸、rna或dna,包括病毒核酸。靶可以是单链dna或更常见的是双链dna(dsdna)。如上所述的本发明的核蛋白复合物可能特别有利于作为crispr-cas系统的替代物,用于递送至细胞以实现基因组dna修饰,特别是在包括植物细胞和人细胞的真核细胞中。不受理论的束缚,如上所述,认为dbd通过其对双链dna中的预定序列的特异性识别有助于双螺旋的解链和/或解旋,从而有助于靶核酸的靶向和效应子组分在所需位点的操作。核定位信号(nls)和/或细胞器定位信号也可以作为模块化多肽组分的一部分提供,用于有效转运到真核细胞的细胞核中或有效转运到期望的细胞器中,例如线粒体或叶绿体定位信号。这种信号序列通常在n-或c-末端提供。它可以连接到一个或多个另外的序列,例如用于帮助检测的检测标记,如表位标记,条件是保持模块化多肽组分的所需功能;参见图25。效应子组分将不特异性地结合所述预定序列,并且通常将缺乏靶结合能力。然而,将认识到仅必要的是效应子组分不阻止核酸靶向元件和dbd对所需修饰的位点特异性靶向。这可能不排除具有一些靶(例如dna)识别能力的效应子组分。如上所述,靶的修饰可以是结构或化学修饰,例如核苷酸序列的改变,或调节的改变,例如转录激活。效应子组分可以是已知用于修饰dna的任何类型的效应子,包括例如fok1核酸酶结构域(即fok1核酸酶减去其dna结合结构域),其可以在发生二聚化时形成功能性核酸酶,例如通过将本发明的两种核蛋白复合物适当靶向靶dna区域。然而,如上所述,效应子组分可优选包含人工核酸酶,其由如下文进一步讨论的连接的自组装短肽形成。这样的人工核酸酶可以充当人工切口酶,因为它在靶位点处仅切割双链dna的一条链。效应子组分可以是融合蛋白,其中切口酶与另一种功能组分(例如碱基编辑器或逆转录酶)连接或被另一种功能组分(例如碱基编辑器或逆转录酶)替代。如上所述,dbd将是短肽,通常不超过20mer,例如不超过16mer-18mer,优选不超过15mer,针对与靶中预定序列(例如2-7个,优选3-6个核苷酸,例如本文所例示的dsdna靶中的6个核苷酸序列5'gaggtc3')的结合亲和力而选择。预期dbd有助于扫描基因组并在所需修饰位点(例如切割位点)附近建立初始接触。此外,进一步强调的是,预期dbd与靶dna的结合在相邻位点处触发结构变化和随后的解链。这种解旋应有助于te查询相邻序列的互补性,并且在te是rna序列的情况下,形成rna-dna复合物(r-环)。因此,本发明的基因组编辑工具的dbd组分被视为用于提高基因组修饰效率的重要模块,其可以在不损害对短的整体多肽组分长度的希望的情况下提供,优选地与来自也表达至少一种靶向rna的aav载体的表达相容。因此,本发明的基因组编辑工具的模块化多肽组分可以包含具有接头的完全合成的短肽,并且通过靶dna位点处的人工核酸酶提供切口酶或核酸酶活性。这种采用模块化多肽组分的基因组编辑工具被称为apget,代表”人工肽基因组编辑工具”。这样的多肽组分可以不超过220个氨基酸(减去任何可切割的标签、定位信号或除组分(a)-(d)之外的任何其他序列),如seq.id.no.1的apget多肽所例示的:由在n-末端至c-末端方向上融合的以下组分组成:-对应于λn22蛋白的22个氨基酸的rsbd,mdaqtrrrerraekqaqwkaan(seq.id.no.2)-接头ggggsggggsggggsggggsggggsggggsggggsggggsggggs(seq.id.no.3),即(ggggs)7-dbd sletwlkhrekdggs(seq.id.no.4),其结合由5'至3'序列5'gaggtc3'表示的dsdna序列-接头ggggsggggsgggggs(seq.id.no.5)和核酸酶模块iekdihindggieidihidsggieidihissgsieidihinngnieidihigsdgieidihignsgieidihidnggieidihidsdgieidihisssgieidihigsegieidihigdsgieidkhinqgs(seq.id.no.6),减去可以如上所述提供的任何另外的n-或c-末端序列,例如以提供短nls和可能的检测标签。核酸酶(以上seq.id.no.1中以粗体显示)具有十个相同的7mer肽单元(ieldihi,seq.id.no.7),其全部以相同的n至c-末端方向连接(在本文中称为非反向十聚体的实例),其中4mer接头提供β-转角和另外的n-和c-末端侧翼序列。这允许折叠,由此相同肽单元的十聚体可以产生类似于反平行β折叠的二级结构,其中连续的单体单元将以相反方向取向;参见图8b和图9。seq.id.no.1的模块化多肽组分,作为本发明的dna编辑工具的一部分,已经显示能够在靶向的位点切割dsdna的单链。因此,人工核酸酶模块可以被视为提供切口酶的功能,因此可以被称为人工切口酶。预期可以通过例如提供具有较低多重性的自组装肽和/或其他组分的变化的核酸酶来实现较小的此类基因组编辑工具。这包括相同模式的任何不同肽序列以及不同肽序列的组合。seq.id.no.1的人工核酸酶可以被另一种效应子组分取代,例如转录激活子,如vp64,或如下所述的另一种效应子组分。此外,将认识到柔性接头中的一个或两个可以被替代接头取代。因此,例如,人工核酸酶(或取代效应子组分)和dbd之间的接头1可以被指定为接头l1a(seq.id.no.69)的接头取代。rsbd和dbd之间的接头2可以例如被如接头2b(seq.id.no.70)所例示的较短接头取代。本发明的模块化多肽组分中的接头可以针对任何一对dbd结合和靶切割位点而变化和优化。将认为这种变化是基于已知的靶序列信息和适当的测试的长度要求计算的问题。此类接头还可以设计成用于增加蛋白质稳定性和/或溶解性。尽管选择λn22蛋白作为如以上seq.id.no.1所示的示例性apget的rsbd是基于这仅是具有众所周知的识别19个核苷酸的框bλ噬菌体序列的能力的短的22个氨基酸序列(baron-benhamou等(2004)methods mol.biol.257,135-54),但是,将理解这可以另外地或可替代地被另一种rsbd取代,包括其保留对rna支架的所需结合亲和力的任何变体,例如相同的框b序列。还将理解rs可以串联使用以促进多个rsbd的结合。与作为靶向核酸的rs提供的框b序列配对的λn22蛋白rsbd可以被许多其他众所周知的rna适体-多肽结合结构域配对中的任一种取代,如下文进一步讨论的。与用于产生靶向的dna链断裂并采用较大分子量的蛋白质(如zfn、talen、大范围核酸酶和crispr-cas实体)的已知基因编辑系统相比,apget的多肽组分的小尺寸预期能改善系统的dna扫描和识别效率。这种较大的现有技术系统将具有较低的扩散速率。本文提供的示例还表明apget减去任何核酸酶或其他效应子组分,即仅包含核酸识别模块,例如与dbd连接并与适当的靶向核酸偶联的rsbd,可用于抑制靶位点处的转录。这样的系统在本文中被称为apget-i系统。在某些情况下,可以选择其来表达添加了最终c-末端接头序列的apget-i多肽,例如以上seq.id.no.5的接头。然而,对于转录抑制,优选减去这种接头的apget-i多肽。将认识到,本发明的核蛋白复合物的模块化多肽组分可以最初表达为具有n-末端和/或c-末端延伸的较长多肽的一部分,以有助于例如在表达系统(例如宿主细胞,如大肠杆菌)或体外表达系统中的溶解性和/或纯化和/或检测。这样的延伸可以包括蛋白酶切割位点,例如tev蛋白酶切割位点,由此蛋白酶切割去除最终模块化多肽中对于靶修饰不需要的序列;参见图10和31。在一些情况下,可以选择表达包含蛋白质转导结构域(ptd)的模块化多肽组分,有时也称为细胞穿透肽(cpp)或结构域,以促进跨膜递送,例如进入靶细胞中。同样,这种结构域可以拥有提供蛋白酶切割位点的接头。这样的ptd可以位于n-末端或c-末端。通常,ptd可以分为3种类型:主要包含精氨酸、鸟氨酸和/或赖氨酸残基的长度为例如6-12个氨基酸的阳离子肽,疏水性肽,如分泌的生长因子和细胞因子的前导序列,以及细胞特异性肽。示例性ptd包括但不限于hiv tat蛋白、聚精氨酸肽序列、vp22结构域(zender等(2002)cancergene ther.9,486-96)、pdx1蛋白转导结构域(noguchi等(2003)diabetes 52,1732-1737)、截短的人降钙素肽(trehin等(2004)pharma.res.21 1248-1256)和聚赖氨酸序列(wender等(2000)proc.natl.acad.sci.usa 97,13003-13008)。可以提供可激活的cpp(acpp),其包含通过可切割接头与匹配的聚阴离子(例如glu9或e9)连接的聚阳离子cpp(例如arg9或r9),其将净电荷降低至接近零,从而抑制粘附和摄取到细胞中(aguilera等(2009)integr.biol.(camb)1,371-381)。在接头切割时,聚阴离子被释放,从而局部暴露聚精氨酸并激活其固有的粘附性以促进膜转运。本发明的核蛋白复合物可以作为活性复合物(例如通过电穿孔)或与多肽组分和由多核苷酸表达的靶向核酸中的一种或两种一起递送至宿主细胞。因此,在另一方面,提供了用于在宿主细胞中提供本发明的一种或多种核蛋白复合物的核酸或核酸组合。如上所述,核酸可以优选是载体,例如aav载体,其能够表达模块化多肽组分(例如包括本发明的人工切口酶)和靶向核酸。可以向宿主细胞提供多于一种靶向核酸以靶向多于一个位点。例如,一对本发明的包括人工切口酶的核蛋白复合物可以通过载体递送至细胞来提供,可能通过单个载体,连同用于同源重组的序列模板。本发明的一种或多种核蛋白复合物的应用扩展到可以使用crispr-cas/sgrna的dna修饰的全套应用程序。因此,作为本发明的另一方面,提供了一种使用本发明的一种或多种核蛋白复合物或一种或多种核酸修饰一种或多种靶核酸序列的方法,以在宿主细胞中提供其,条件是所要求保护的这些方法不扩展到修饰人的种系身份的方法或对人或动物体本身实施的医学治疗方法。如上所述,理想地,可以通过从载体表达在细胞中提供用于提供一种或多种核蛋白复合物的单个模块化多肽组分。同一载体也可以优选地表达所需的一种或多种靶向核酸。作为本发明的另一方面,提供了(i)至少一种用于本发明的基因组修饰工具的模块化多肽组分或编码其的多核苷酸和(ii)一种或多种可以与所述多肽组分连接的靶向核酸或一种或多种编码其的多核苷酸的组合,其用于如上所述的本发明的方法或用于治疗性治疗。如上所述,多肽组分和一种或多种靶向核酸都可以优选地从单一载体表达。将理解用于本文讨论的apget核蛋白复合物的人工核酸酶代表了本发明的另一方面。掺入催化残基的自组装肽簇的使用先前已用于产生充当酯酶或提供许多其他酶促反应的人工酶。然而,在这种情况下,发明人首次获得了一种人工核酸酶,其使用设计成实现所需功能的方法可以使用连接的自组装短肽在dsdna中提供切口酶功能,同时最小化尺寸,从而提供非常适合于在基因组编辑工具中提供效应模块的人工酶。以这种方式连接各个肽单元也有助于控制自组装的程度。本发明的此类人工核酸酶和基因组修饰核蛋白复合物将在下文参考以下附图更详细地讨论。
背景技术:
技术实现思路
本文地址:https://www.jishuxx.com/zhuanli/20240716/104911.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表