一种中药玉竹根腐病致病菌的分离、鉴定方法及应用
- 国知局
- 2024-09-05 15:05:37
本发明涉及一种中药材根部病害的鉴定与化学防治,具体涉及一种最新发现的玉竹根腐病病害的鉴定与化学防治及应用。
背景技术:
1、玉竹为百合科多年生草本植物。别名小黄精、竹叶参、对叶生、萎蕤。玉竹应用历史悠久,在国内外久负盛名。2012年被列入首批药食两用中药名单。中国药典描述其味甘,性微寒,归肺、胃经,具有养阴润燥、生津止渴的功效,常用于肺胃阴伤、燥热咳嗽、咽干口渴、内热消渴。现代药理证实玉竹具有强心、降血压、降血糖、降血脂和增强免疫功能等功效,其化学成分含多种化合物,其中,黄酮类、多糖类、皂苷类化合物在玉竹中含量较高,也是玉竹发挥药理作用的主要活性成分。
2、作为食药两用品种,玉竹具有种植效益高、种植技术成熟、市场前景广阔的优势。中国医药行业每年对玉竹的需求量巨大,可达数千万吨,出口量也有数百万吨,因此玉竹是贸易量较大的重要药材之一。但是玉竹的药用部位常需种植数年,其根部病害发生较为普遍,其中又以根腐病严重影响玉竹的产量和品质,严重时会造成玉竹的大幅度减产甚至绝收。笔者在贵州省安顺市西秀区刘官乡对玉竹调查研究发现,该地有一种真菌导致玉竹患根腐病,病斑椭圆形或不规则形,生于玉竹块根表面,初期斑点小、圆,为浅红色,后期病斑扩大,中央变为红褐色或棕褐色,最后导致玉竹表面出现绿色霉菌,根部腐烂。查阅资料,并无相关玉竹根腐病病害的报道,本次是首次对该种玉竹根腐病病害的报道。
技术实现思路
1、本发明的发明目的在于:寻找出导致玉竹出现病害的病因,并寻找到一种有效防止病害的就化学试剂。
2、为了达到上述目的,本次发明所采用的技术方案如下:
3、一种中药玉竹根腐病致病菌的分离、鉴定方法,包括以下措施:
4、 (1) 病株采集:在贵州省安顺市西秀区刘官乡中药材种植基地采集典型病株,并描述病株形态;
5、(2) 病原菌分离纯化: 将病变部位接种到培养基中,通过多次接种分离得到纯的病原菌菌株;
6、 (3) 病原菌回接实验: 选取健康的玉竹根部组织,将分离菌株接种到健康玉竹根部组织上,放入培养皿中保湿培养,随时注意病斑变化;之后将接种部位病斑与采集的玉竹病害病斑进行对比,筛选出致病菌;
7、(4) 形态学鉴定: 将筛选出的病原菌进行培养,待菌落产孢,挑取菌落边缘菌丝,于显微镜下观察病原菌形态特征;
8、(5) dna提取: 根据dna提取试剂盒的步骤提取病原菌dna,设立两组实验a和b;
9、(6) pcr扩增: 将提取的dna进行pcr扩增,用凝胶成像系统显色,之后将dna测序;
10、(7) 测dna序列: 测序之后,构建系统发育树,判断病原菌种属(病原菌为简青霉);
11、(8) 药剂筛选实验: 本次实验选取3种化学试剂,分别为50%嘧菌酯、50%多菌灵、格菌.精甲霜,进行室内药剂筛选药剂,配置为1mg/l、5mg/l、25mg/l、125mg/l、625 mg/l 5种浓度梯度溶液,将不同梯度药液与培养基以1:9比例配置为含药培养基,病原菌接种到培养基中,28℃恒温光照培养5d,通过十字交叉测得菌落直径,通过软件处理,得到毒力回归方程,抑制率,ec50等相关参数;
12、(9) 结果分析:本发明进一步公开中药玉竹根腐病致病菌的分离、鉴定方法在用于筛选出防治玉竹根腐病化学试剂方面的应用;所述的筛选出防治玉竹根腐病化学试剂指的是50%嘧菌酯,50%多菌灵,实验结果显示50%嘧菌酯的ec50为78.64mg/ml,50%多菌灵的ec50为121.77mg/ml。这两种药剂抑菌作用较强,可以作为防治此种玉竹根腐病病害的化学防治药剂。
13、本发明主要找到了玉竹根腐病发生的原因,重点考察了导致玉竹根腐病的病原菌种类,主要的难点在于用于防治实验的化学试剂较少。
14、本发明更加详细的描述如下:
15、1.材料与方法
16、2.1材料
17、2.1.1病株采集
18、于2023年8月在贵州省安顺市西秀区刘官乡中药材种植基地采集玉竹根腐病样本,观察发现玉竹感染根腐病部位腐烂,表面出现绿色霉菌。随即采集健康玉竹植株和染病玉竹植株带回实验室内培养,用于后续实验检测。
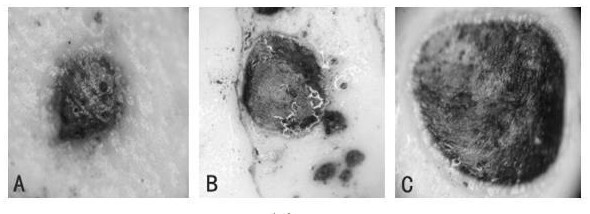
19、病斑描述:病斑椭圆形或不规则形,生于玉竹块根表面,初期斑点小、圆,为浅红色,后期病斑扩大,中央变为红褐色或棕褐色(如图1),最后导致玉竹根部腐烂。
20、2.1.2培养基
21、马铃薯葡萄糖琼脂培养基(pda)(上海博微生物试剂有限公司);抗生素(青霉素和硫酸链霉素);
22、2.1.3试剂
23、
24、2.1.4主要器材
25、手术刀;手术剪;离心管;离心柱;扩增管;滤纸;接种针;酒精灯;移液枪(1000μl;250μl;10μl;2.5μl);洁净工作台(济南鑫贝西生物技术有限公司);生化培养箱(山东博科科学仪器有限公司)canon eos 700d数码相机(佳能(canon));电热恒温水浴锅(天津泰斯特仪器有限公司);体视镜、eclipse ni光学显微镜、nikon图像分析系统(尼康(nikon));pcr热循环仪(赛默飞世尔公司(thermo fisher scientific));pico 17离心机(赛默飞世尔公司(thermo fisher scientific));
26、2.1.5 供试药剂
27、
28、2.2方法
29、2.2.1病原菌分离纯化
30、于2023—2024年在贵州省安顺市西秀区刘官乡玉竹种植基地对病害进行调查,同时进行症状描述,并采集典型病株,备用。
31、选取症状明显的玉竹病根洗净擦干后使用组织分离法对致病菌进行分离,将洁净工作台紫外灭菌后,用酒精灯对手术刀进行灭菌处理,手术刀灭菌完毕后切取小块玉竹根腐病病变部位,将其放入灭菌水中漂洗多次后用滤纸吸干表面水分,接种到pda平板中央,将pda平板置于28 ℃恒温培养箱培养,定期观察记录。这一步需重复多次,制作多个平板,以防杂菌污染或分离出不需要的菌类。
32、2.2.2 致病性测定
33、2.2.2.1 非致伤法:
34、挑选未感染根腐病的健康玉竹根茎,清洗干净,随后于洁净工作台中进行灭菌处理,在洁净工作台内用灭菌后的接种针切下并挑取直径约1cm的圆形菌块菌面朝下贴于玉竹表面,准备一个培养皿向里面铺设2层经过无菌水湿润灭菌滤纸,随后放入处理过的玉竹根部,贴菌块的一面朝上,加入少量无菌水保湿,于28℃下培养,定期观察记录。
35、2.2.2.2 贴片法:
36、按照柯赫氏法则,将分离纯化后得到的菌落转接到含pda培养基的培养皿内培养,挑选健康的玉竹根部,清洗干净后,用无菌处理的手术刀刮去直径约1cm的圆形表皮,从分离得到的菌板取相同大小形状的菌块菌面朝下置于削皮处,准备一个培养皿向里面铺设2层经过无菌水湿润灭菌滤纸,随后放入处理过的玉竹根部,于28℃下培养。同时使用无菌pda菌块作为对照培养,观察发病情况。将接种的根部组织病状与对照组进行对比,出现典型症状后,取实验组患病部位再次分离纯化病原菌,与原菌种进行比较,观察回接前后两次得到的菌种是否相同。
37、2.2.2.3 注射法:
38、按照柯赫氏法则,将分离纯化后得到的菌落转接到含pda培养基的培养皿内培养,用灭菌后的接种针挑取少许菌丝加入无菌水制为混悬液,挑选健康的玉竹根部,将混悬液注射进玉竹内,准备一个培养皿向里面铺设2层经过无菌水湿润灭菌滤纸,随后放入处理过的玉竹根部,于28℃下培养。同时使用无菌水作为对照培养,观察发病情况。将接种的根部组织病状与对照组进行对比,出现典型症状后,取实验组患病部位再次分离纯化病原菌,与原菌种进行比较,观察回接前后两次得到的菌种是否相同。
39、2.2.3形态学鉴定
40、用28℃恒温培养分离纯化得到的菌株,于7天后观察其菌丝菌落的生长状况、颜色和质地,用体视镜直接观察菌株的菌丝菌落颜色、质地等宏观特征。之后挑取少许菌丝于滴加无菌水的载玻片上,搅匀,盖上盖玻片,将其制作成玻片观察菌株包括菌丝颜色、分生孢子的形态等显微特征,对不同类型的菌丝及分生孢子进行测量并记录,其中分生孢子使用tarosoft(r)image framework软件测量其直径并算出直径大小区间。根据观察到的病原菌宏观形态特征,参考《植物病原真菌学》[12]对病原菌进行形态学测定。
41、2.2.4分子系统学鉴定
42、2.2.4.1 基因组dna提取
43、(1)使用酒精灯灭菌后的手术刀,刀背朝里倾斜45度刮取菌丝。(刮取过程中动作轻柔,注意不刮下培养基,以防误差)
44、(2)将刮取的菌丝使用滤纸上吸取多余水分后,放置于离心管中,使用研磨棒研磨,直到观察到离心管内没有明显团块,加入600μl buffer fg1,涡旋混匀。
45、(3)将(2)得到的样品加入65℃水浴锅,水浴加热15分钟,期间每隔5分钟拿出上下颠倒混匀,共计混匀2次。
46、(4)在(3)得到的样品中加入140μl buffer fg2,涡旋混匀。随后放到提前准备好的冰水中冰浴5分钟,随后≥10,000×g离心10分钟。
47、(5)小心地将(4)中离心得到的上清液转移到一个新的离心管,动作需细心,避免将沉淀也移到新离心管。
48、(6)将(5)中得到的上清液一半体积buffer fg3和1倍体积的无水乙醇加入到上清液中,涡旋混匀。
49、(7)转移样品至插入2ml collection tube的dna mini column,随后以10,000×g离心1分钟。弃滤液,使用2ml collection tube。
50、(8)加入600μl dna wash buffer(使用前加入乙醇),随后以10,000×g离心1分钟,弃滤液,使用2ml collection tube。
51、(9)加入600μl dna wash buffer,随后以10,000×g离心1分钟,弃滤液,使用2mlcollection tube。
52、(10)为去除残留的乙醇,需要打开柱子盖子,最大转速空离2分钟(12000×g)。
53、(11)准备一个干净的1.5ml离心管,向其转移上述步骤得到的dna mini colunm,加入在恒温水浴锅65℃预热的elution buffer(或去离子水),加入elution buffer(或去离子水)后室温静置3—5分钟。随后以10,000×g离心1分钟,离心后得到的液体中就含有所需要的致病菌dna。
54、2.2.4.2 pcr扩增dna
55、(1)pcr反应体系配置
56、①按照下表进行pcr反应体系的配置。
57、
58、②将扩增管放入pcr扩增仪进行扩增。
59、(2)琼脂糖凝胶检测(见图2)
60、2.2.4.3 pcr测序
61、用引物its1和its4扩增its序列,pcr体系25μl。向上海生物工程有限公司发送pcr产物进行测序。
62、测得序列如下:
63、yz1:从玉竹根腐病样品上分离所得菌株的测序序列
64、cgggtgacaaagccccatacgctcgaggacctgacgcggtgccgccgctgcctttcgggcccgccccccgggaccggggggcggggcccaacacacaagccgtgcttgagggcagcaatgacgctcggacaggcatgccccccggaataccagggggcgcaatgtgcgttcaaagactccatgattcactgaattctgcaattcacattacgtatcgcatttcgctgcgttcttcatcgatgccggaaccaagagatccgttgttgaaagttttaactgatttagttaatcgctcagactgcaatcttcagacagagttcaatggtgtcttcggcgggcgcgggcccgggggcagatgccccccggcggccgtgaggcgggcccgccgaagcaacaaggtaaataaacacgggtgggaggttggacccagagggccctcactcggtaatgatccttccgcaggttcacctacggaaaccttgttacgacttttacttcca
65、yz2:根据柯赫氏法则将分离菌株回接后,在发病部位再分离所得菌株的测序序列
66、cgggtgacaaagccccatacgctcgaggacctgacgcggtgccgccgctgcctttcgggcccgccccccgggaccggggggcggggcccaacacacaagccgtgcttgagggcagcaatgacgctcggacaggcatgccccccggaataccagggggcgcaatgtgcgttcaaagactccatgattcactgaattctgcaattcacattacgtatcgcatttcgctgcgttcttcatcgatgccggaaccaagagatccgttgttgaaagttttaactgatttagttaatcgctcagactgcaatcttcagacagagttcaatggtgtcttcggcgggcgcgggcccgggggcagatgccccccggcggccgtgaggcgggcccgccgaagcaacaaggtaaataaacacgggtgggaggttggacccagagggccctcactcggtaatgatccttccgcaggttcacctacggaaaccttgttacgacttttacttcca
67、2.2.4.4 序列对比和分子生物学分析
68、在ncbi gen bank数据库对测序结果进行序列同源性对比,找到数据库相似度高的相应序列并将其下载,利用mega软件进行多序列联配,构建系统发育树,分析其与genbank公布的近缘种的亲缘关系。
69、经ncbi序列比对后,将初步判定实验菌株的种属,再进一步选择部分相近关系种属的菌株序列,构建系统发育树,以此判断实验菌株的分类地位。
70、2.2.5玉竹根腐病防治实验
71、室内毒力测定,则采用菌丝生长速率法。
72、2.2.5.1 含药平板配置:
73、多菌灵药液配置:配置为1mg/l、5mg/l、25mg/l、125mg/l、625mg/l5种浓度梯度溶液,精密称取1 mg多菌灵(50%)加入超纯水定容1l容量瓶,混匀,配制成1 mg/l浓液,其余浓度梯度溶液同理。
74、嘧菌酯药液配置:配置为1mg/l、5mg/l、25mg/l、125mg/l、625mg/l5种浓度梯度溶液,精密称取1 mg嘧菌酯(50%)加入超纯水定容1l容量瓶,混匀,配制成1 mg/l浓液,其余浓度梯度溶液同理。
75、咯菌.精甲霜(齐美新)药液配置:配置成0.1ml/l、0.5ml/l、1ml/l、1.25ml/l、1.5ml/l5种浓度梯度,精密吸取0.1 ml格菌.精甲霜加入超纯水定容1l容量瓶,混匀,即得含药0.1ml/l溶液,其余浓度溶液同理。
76、2.2.5.2 对照平板配置
77、在无菌操作台中,用灭菌移液管向培养皿中加入2ml配好的药剂,随后使用20ml量筒加入已灭菌并降温的pda培养基18ml,混匀,配置为20 ml的含药培养基,以相同方法配置含2ml无菌水和18ml灭菌pda培养皿作为空白对照。
78、2.2.5.3 毒力测定及数据处理
79、待培养皿混匀冷凝,于分离纯化培养好的病原菌菌落沿边缘用点接法取菌种,接种到含有药剂和对照组分的培养皿中央,以确保菌落呈圆盘状生长,便于后续测量,并且每种药剂的各个浓度梯度分别设立3个重复试验。将接种好的培养皿放在28℃恒温培养箱中培养7天,7天后采用十字交叉法量取菌落直径,计算抑制率(r),对菌丝生长抑制率和各药剂的质量浓度进行线性回归分析,求出各供试菌株的ec50值(杀死或抑制50%病原菌萌发的有效药剂浓度)。
80、r=[(d0-d)/d0]*100%
81、 式中:d0表示对照菌落直径,d表示处理菌落直径
82、应用统计学方法拟合出试验浓度对数-抑制率百分率概率值的回归方程以及相关系数r等相关数据(x:浓度取自然对数e的对数;y:抑制率对应的概率值)。并且以抑制率为50%时对应的概率值代入毒力方程求出x,再转化成抑菌中浓度ec50的值,ec50越小,说明该药剂对菌丝的抑制作用越好,最后用ec50值来衡量化学药剂对病原菌菌丝毒力的大小。
83、3.结果
84、3.1病原菌分离纯化结果
85、通过组织分离法对玉竹根腐病致病菌进行分离纯化,有多种真菌从新鲜玉竹根部发病的病斑处分离纯化出来,经过致病性检测,其中一种真菌回接结果与原性状相似,将其回接到健康玉竹根部组织上后,发现其发病症状与原病状相同。
86、3.2致病性测定
87、通过非致伤法将病原菌回接到健康玉竹组织上后,观察七天,未发生任何致病现象。贴片实验组:切取一定大小有菌丝的培养基,贴片接种到健康的玉竹组织后,培养7天,实验组接种部位出现红褐色病斑,与病株上的病斑一致(见图3)。
88、贴片对照组:切取一定大小的纯净培养基,贴片接种到健康的玉竹组织后,培养7天,实验组接种部位出现黄色氧化现象,未出现病斑(见图4)。
89、对照组。7天后实验组从内部出现病斑,对照组内部无明显现象(图5)。
90、3.3 形态学鉴定结果
91、生长出来的菌落长出絮状菌丝,呈白色绒毛状(图6a),背面菌落背面为浅黄色,中央菌丝呈现青色(图6b)。
92、在显微镜下观察玉竹致病菌的分生孢子盘和形态,观察发现:分生孢子梗由基质生出,直立,有分隔,无色,经过多次分枝,顶端呈现特殊的对称或不对称的扫帚状,顶端膨大,为类球形。分生孢子为无色单孢子,数量较多,呈球形或近球形,大小为3.05(2.8~3.4)μm ×3.07(2.8~3.5)μm。根据形态学结果,参照《植物病原真菌学》[15]和青霉属及其相关文献资料描述[16],将其初步鉴定为简青霉( penicillium simplicissimum)(如图6);类并且拥有较高支持率。
93、
94、3.5 室内毒力测定结果
95、将病原菌接种在含有不同浓度梯度的化学药剂及对照组实验的培养皿中,在28℃的条件下培养7天,统计菌落生长情况由表3可知,在本次提供实验的3种化学药剂及其一系列浓度范围内,不同的供试药剂对病原菌丝生长的抑制作用存在明显差异。化学药剂对病原菌生长的抑制作用规律相似,即随着浓度的增大,对病原菌的抑制作用越强,菌落生长直径越小(表4)。在此次室内毒力测定中,嘧菌酯和多菌灵在最高质量浓度625mg/l下抑制率均能达到90%以上,格菌.精甲霜在其最高质量浓度1.5ml/l下抑制率也能达到80%以上。
96、将50%嘧菌酯和50%多菌灵组分培养皿测得的菌落直径,以化学药剂有效含量(mg/l)以e为底的对数值(x)为横坐标,以抑制率对应的几率值(y)为纵坐标,用软件处理数据,求出相应的回归曲线方程,及在抑制率为50%时的浓度(ec50)如表3。在本次药剂筛选试验中,对比相似的嘧菌酯和多菌灵两种药物50%嘧菌酯其ec50值最低,其次是50%多菌灵,故两种药物中50%嘧菌酯的抑菌效果最好。
97、
98、4.结果与讨论
99、4.1鉴定结果
100、根据该致病菌的形态学鉴定和分子生物学鉴定的结果,可以鉴定出导致玉竹根腐病的致病菌为简青霉( penicillium simplicissimum)。
101、4.2思考讨论
102、本次实验使用的是采集回来的玉竹根部进行实验,由于是离体接种,所以本实验不能观察到健康玉竹生长过程中病原菌的侵染过程、方式及其对玉竹生长产生的影响,但是通过非致伤法对该病原菌进行回接时发现,此次实验的根腐病病原菌并不能透过表皮感染玉竹使其患上根腐病,而通过两种致伤法回接后发现,病原菌迅速感染玉竹,并且病斑十分明显,这说明简青霉菌可能是由于虫咬、物理损伤等原因导致青霉菌从伤口侵染从而产生危害,并不会直接侵害植物,为机会致病菌。由于缺少玉竹生长过程中青霉菌的相关实验,有关青霉菌侵染玉竹使其患上根腐病的作用机理有待继续深入探索。
103、室内毒力测定实验结果表明,本实验所选取的三种农药对于致病菌均有抑制作用,并且三种农药抑制效果存在差异,嘧菌酯和多菌灵两种药剂比对:剂量较低时,嘧菌酯抑菌效果更好,随着药物浓度的增加,多菌灵的抑菌效果逐渐超过嘧菌酯。格菌.精甲霜为液体农药,难以与其余两药比对。格菌.精甲霜是贵州省安顺市西秀区刘官乡玉竹种植基地为减少根腐病所使用药物,其余2种药物于本实验仅进行了室内抑菌实验,尚未去田间进行野外防治实验,对于三种农药在玉竹生长过程中的抑菌效果有待进一步探索。
104、本次化学药剂筛选所用试剂是市面上的常用抗病药剂,适于病害防治用药,成本较低。但使用化学药剂对玉竹会造成污染,对玉竹的品质造成影响,这是个不容忽视的问题。所以在日常管理中,对玉竹种植应该有更严格的规范要求,合理控制种植密度,及时清理病株,降低根腐病感染概率,防止根腐病的大规模感染。
本文地址:https://www.jishuxx.com/zhuanli/20240905/289522.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。