一种抗原表位的制备方法
- 国知局
- 2024-09-14 14:45:27
本发明属于生物,具体涉及一种抗原表位的制备方法。
背景技术:
1、肿瘤免疫治疗激活癌症患者自身免疫系统杀灭肿瘤,2013年被《科学》杂志评为十大科学突破之首,前景乐观。主要类型包括了免疫检查点抑制剂、car-t细胞治疗技术、tcr-t细胞治疗技术以及治疗性新抗原肿瘤疫苗等技术。其中免疫检查点抑制剂opdivo和keytruda已经成为2022年癌症治疗药物销量排名第2和第4名。免疫治疗的核心是提高t细胞对肿瘤抗原的应答。肿瘤抗原可分为肿瘤相关抗原(taa)和肿瘤特异性抗原(tsa)。tsa包括病毒抗原和由非同义体细胞突变产生的新抗原(neoantigen),taa则包括组织特异性抗原和发育特异性抗原。taa在肿瘤中异常或过度表达,但在正常组织中仍有表达,靶向taa可能有毒副作用;且免疫系统对自身抗原处于中枢耐受状态,taa引起的免疫应答较弱。因此,来源于肿瘤细胞突变的肿瘤新抗原是肿瘤免疫治疗的理想靶标。经过主要组织相容性抗原复合物(major histocompatibility complex,mhc)提呈,能够诱导辅助t细胞和杀伤性t细胞的激活,对肿瘤细胞产生特异性免疫反应。研究发现对新抗原的免疫应答是决定免疫治疗疗效的关键因素之一。免疫检查点抑制剂对具有微卫星不稳定性、高突变负担的肿瘤类型(如黑色素瘤、小细胞肺癌、膀胱癌等)更有效,即使在同类肿瘤中,对突变数量高的病人也常常更加有效。
2、新抗原作为一种tsa,具有肿瘤特异性高、免疫原性强的特点,是癌症治疗的理想靶标。以新抗原krasg12为靶点的tcr-t疗法显现了积极的临床效果。该突变由于是肿瘤驱动突变,表达于90%的胰腺癌,50%的结肠癌和25%的肺癌。然而,类似能够共享的新抗原表位稀少,很难形成有体系的治疗策略。因此,目前处于肿瘤治疗研究前沿的新抗原疫苗采取了个性化的治疗策略。近十年来二代测序技术的发展以及用于预测mhc结合表位的算法的发展为开发新抗原疫苗铺平了道路。广泛采用的方法是利用外显子和rna测序,经软件预测并验证hla有效递呈的新抗原表位,再用minigene,rna或者直接合成短肽,为患者量身打造个性化新抗原疫苗。2015年肿瘤新抗原疫苗的临床实验结果首次发表于science杂志,证实了新抗原dc疫苗可以在黑色素瘤中有效的激活抗原特异性的t细胞。其后多个类似的研究在黑色素瘤、脑胶质瘤等癌症患者中也看到了临床疗效,效果大大优于早期的以taa为靶点的肿瘤疫苗。此外,新抗原疫苗还能够联合pd-1抑制剂治疗晚期或转移性黑色素瘤、非小细胞肺癌、膀胱癌,达到延长和持续改善的无进展生存期。
3、然而,基于新抗原的疗法也存在难以克服的缺陷。第一,新抗原具有个性化的特点,导致了它很难实现共享。不同患者的新抗原种类不同,针对每个病人检测、设计和合成新抗原疫苗的生产成本远超过了其他类型的免疫治疗。第二,新抗原预测准确率也不高。目前的新抗原预测技术只能预测突变抗原与mhc-i的亲和力,不能预测其诱导t细胞应答水平的真正水平。新抗原的质量除了短肽-mhc亲和力,还包括外源度(即衡量新抗原与野生型蛋白质相比的异源性)、克隆分布、突变状态,以及tcr与mhc复合物的亲和力。在两项肿瘤新抗原临床试验中,患者分别接受20种肿瘤新抗原多肽或10种肿瘤新抗原rna药物,只有25%和16%的肿瘤新抗原激发了特异性的cd8+t细胞应答。第三,多数类型癌症的突变负荷(tumormutational burden,tmb)低,缺乏新抗原表达,疫苗难以设计。
4、另一方面,新抗原的免疫原性也受到了“免疫编辑(immunoediting)”的调控,肿瘤可通过下调免疫原性强的新抗原逃逸免疫监控。dr.schreiber 2002年提出免疫编辑理论,即免疫系统与肿瘤的关系存在三种状态:早期的免疫清除、中期免疫平衡和后期免疫逃逸。这一理论近年来逐渐得到证实。rooney等发现直肠癌样本中能够结合mhc i类分子的突变短肽远少于理论值,暗示了免疫系统对新抗原存在筛选压力。肿瘤中的新抗原图谱受到免疫监控呈现动态的过程。luksza等长期跟踪分析胰腺导管腺癌的新抗原特异性t细胞反应,于2022年在自然杂志发表了他们的研究结果,肿瘤会下调基因表达或从dna水平删除具有免疫原性的新抗原。
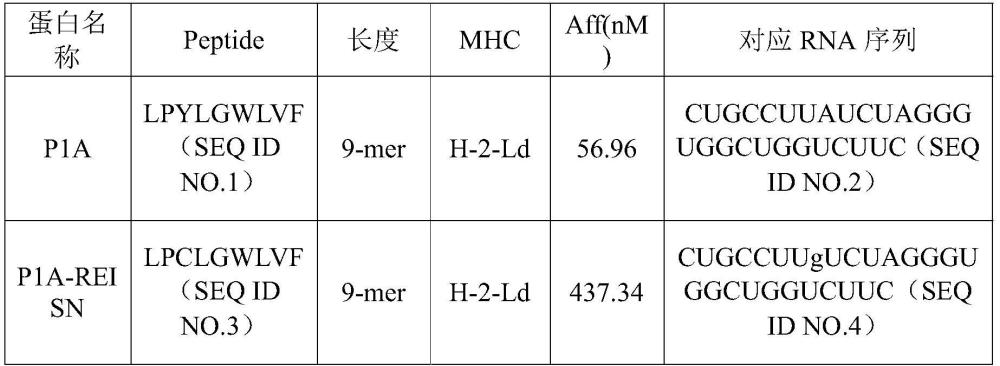
5、综上所述,新抗原预测技术的缺陷、在部分患者中表达比例低、以及个性化生产成本高昂和质量标准难以建立等都限制了其广泛应用的潜力。另外,肿瘤中自然发生的新抗原在“免疫编辑”调控下免疫原性低,亟待开发更为广谱、更为有效的新抗原相关技术。目前已有一些原位肿瘤疫苗的尝试,如促进树突细胞成熟的flt3l、gm-csf,以及tlr免疫激动剂,主要机制是促进新抗原的呈递和t细胞的启动。还有一些课题组创新性的使用溶瘤病毒、细菌及化疗增加新抗原的方法,但在肿瘤靶向、可控性和特异性方面仍存在着较大挑战。
技术实现思路
1、本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出抗原表位的制备方法。
2、本发明明还提出一种上述制备方法制备得到的抗原表位。
3、根据本发明的一个方面,提出了一种抗原表位的制备方法,所述制备方法包括以下步骤:利用rna编辑技术对肿瘤抗原进行定点突变得到新的抗原表位。
4、在本发明的一些实施方式中,所述定点突变通过将肿瘤抗原rna的核酸序列中的a突变到i和/或c突变到u来达成。
5、在本发明的一些实施方式中,所述肿瘤抗原包括肿瘤特异性抗原和肿瘤相关抗原。
6、在本发明的一些实施方式中,所述肿瘤特异性抗原包括化学物质诱发的肿瘤特异性抗原、病毒诱发的肿瘤特异性抗原和自发肿瘤的抗原性中的至少一种。
7、在本发明的一些实施方式中,所述肿瘤相关抗原包括胚胎抗原、分化抗原、癌睾抗原和病毒抗原中的至少一种。
8、在本发明的一些实施方式中,所述肿瘤包括睾丸癌、直肠癌、结直肠癌、小肠癌、大肠癌、胃癌、食管癌、下咽癌、喉癌、口腔癌、鼻腔癌、胰腺癌、肝癌、肺癌、乳腺癌、卵巢癌、宫颈癌、子宫内膜癌、阴道癌、输卵管癌、肾癌、黑色素瘤、脑瘤、甲状腺癌、甲状旁腺癌、白血病、淋巴瘤、骨髓瘤、肉瘤、前列腺癌、膀胱癌、胆管癌、胆囊癌中的至少一种。
9、在本发明的一些实施方式中,所述肿瘤相关抗原的表位包括p1a、afp和spag9-2。
10、在本发明的一些实施方式中,所述rna编辑采用的编辑系统至少包括leaper、λn-boxb或ms2-mcp2。
11、在本发明的一些实施方式中,所述编辑系统中包括向导rna(向导rna)的构建体,所述向导rna的序列不小于16bp,与靶位点mrna的序列反向互补,同源性不小于85%。
12、在本发明的一些实施方式中,所述构建体包括质粒、病毒载体或rna。
13、在本发明的一些实施方式中,所述rna包括修饰rna和环状rna。
14、在本发明的一些实施方式中,所述向导rna的序列如seq id no.5、seq id no.6、seq id no.7、seq id no.12、seq id no.19、seq id no.20、seq id no.21所示。
15、在本发明的一些实施方式中,所述方法还包括对制备得到的抗原表位进行检测的步骤,所述检测包括对抗原表位进行序列分析。
16、在本发明的一些实施方式中,所述序列分析的方法为测序。
17、在本发明的一些实施方式中,所述新抗原表位与mhc结合的亲和力不小于1000nm。
18、在本发明的第二方面,提出了一种抗原表位,由上述方法制备得到。
19、在本发明的一些实施方式中,所述抗原表位的氨基酸序列如seq id no.3、seq idno.11、seq id no.16、seq id no.17或seq id no.18所示。
20、在本发明的第三方面,提出了上述抗原表位的应用,所述应用为在制备治疗和/或预防肿瘤的产品中的应用。
21、在本发明的一些实施方式中,所述应用为在制备肿瘤免疫产品中的应用。
22、在本发明的一些实施方式中,所述应用为在制备肿瘤相关疫苗中的应用。
23、根据本发明的一些的实施方式,至少具有以下有益效果:本发明方案利用rna编辑对肿瘤抗原进行定点突变得到新抗原表位,避免的新抗原预测的不准确性,且降低预测的时间和经济成本;选择在肿瘤细胞共享表达,但在正常组织不表达的肿瘤抗原,人为引入的新抗原具备肿瘤特异性和共享性;使用较比dna编辑更为安全可控的rna编辑系统,编辑针对mrna而非基因组dna,编辑结果可逆且可控;同时,目前针对肿瘤抗原的研究受限于该类型抗原的中枢耐受,本发明针对该类抗原引入点突变,突变后的抗原表位不被中枢耐受所限制;免疫编辑压力下可能会使目前的新抗原治疗反应性降低,而本发明的方案可以在肿瘤发生发展的过程中随时灵活的引入新抗原,增强免疫治疗的反应性。
本文地址:https://www.jishuxx.com/zhuanli/20240914/295813.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表