一种合成5–羟甲基恶唑烷酮的方法
- 国知局
- 2024-10-09 14:37:55
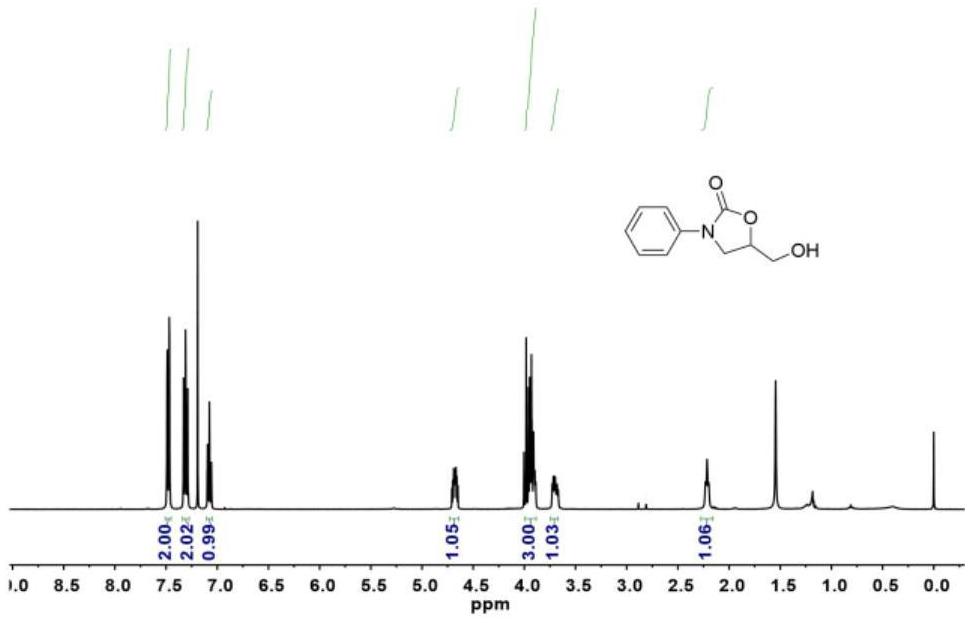
本发明属于有机合成领域,特别涉及一种无卤素离子对催化剂催化合成5–羟甲基恶唑烷酮的方法。
背景技术:
1、含氮、氧元素的五元杂环化合物2-恶唑烷酮是一种普遍存在于医药化学和有机合成中的结构单元,同时这种母核结构的活性药物如托洛沙酮、利伐沙班、利奈唑胺和德帕唑胺等已经被开发用于临床(med.chem.,2008,51:6558;med.chem.,2007,7:389;drugs.,2000,59:7.)。自从1958年恶唑烷酮首次被合成出来,许多新颖的合成策略都已被开发出来,如:胺衍生物与羰基化试剂多组分偶联(j.org.chem.,2014,79:9347;cn112851597b),环氧化物或氮吡啶为起始原料和co2的环加成反应(chemsuschem.,2019,12:3296),氨基甲酸酯的分子内环化反应(org.lett.,2014,16:1434)以及缩水甘油和异氰酸酯的加成反应(cn113200932b)等。在以往的合成方法中目标产物多为不可后修饰的4-取代恶唑烷酮,然而目前含有恶唑烷酮母核的药物分子中多为5-取代的官能团。
2、目前合成5-羟甲基恶唑烷酮的各种工作都仅限于金属催化和有机催化两种形式。路易斯酸(la)单官能催化环氧胺和co2的环加成反应首次由kleij提出,金属铝复合物活化环氧后,与二氧化碳在加压的条件下转化为目标恶唑烷酮(angew.chem.int.ed.,2016,55:3972)。金属催化剂有着高效、活性高的优点,但金属残留问题通常会限制铲品在医药研究领域的高端应用。使用有机催化的案例鲜有报道,目前已知的有使用三乙胺催化的案例(cn113461629a),以及使用有机氢键固载催化剂聚苯乙烯负载1,5,7-三氮杂双环癸-5-烯应用于实现环氧胺和co2的连续流反应(green chem.,2022,24:4628)。
技术实现思路
1、针对现有技术的不足,我们经过研究发现环氧胺和co2的payne-type重排反应可以高效合成5-羟甲基恶唑烷酮,是一种具有原子经济性的方法。payne-type重排反应现象在1962年被首次发现,是指2,3-环氧醇在碱性条件下重排为1,2-环氧醇(org.chem.,1962,27:3819)。因此,本发明提出的合成5–羟甲基恶唑烷酮的方法,通过简单制备的环氧胺和co2进行环加成反应在温和条件下高效、一步得到含有可修饰侧链的目标化合物,适应各种不同用途的后修饰反应。
2、与上述金属催化剂以及三乙胺催化机理不同的是,双官能离子对催化剂的氧负离子作为氢键受体(hba)与胺基氢键配位,使得氮原子的亲核性增强。同时,阳离子部分作为氢键供体(hbd)与环氧的氧原子形成氢键作用,使得环氧被活化,从而更容易被亲核开环。通过对底物的亲核位点(n-h)和亲电位点(c-o-c)的双活化,高选择性、高效得到目标产物。我们所提出的方法中,整个催化体系不含金属、卤素,这为之后工业化应用,以及在更为严格的医学研究领域应用提供了可能。
3、经过研究,我们提出了一种不含金属、无卤素的离子对催化剂催化环氧胺和co2合成5-羟甲基恶唑烷酮的方法。实现上述目的的技术方案如下:
4、一种合成5–羟甲基恶唑烷酮的方法,采用式(ii)所示环氧化物和二氧化碳在式(i)所示催化剂的催化下生成5–羟甲基恶唑烷酮;
5、
6、其中,所述式(i)中阳离子为氢键供体,选自含脒类有机碱的阳离子、双环胍类有机碱的阳离子或氨基吡啶类化合物的阳离子;阴离子为氢键受体,选自羟基吡啶的阴离子;
7、当r1~r5其中一个取代基选自氟、氯、溴、甲基、三氟甲基、甲氧基、酯基时,其他取代基选自氢;所述酯基选自乙酸甲酯或乙酸乙酯;
8、或者当r1、r3、r5同时选自甲基时,其他取代基选自氢;
9、或者当r2、r4同时选自氟、同时选自氯或同时选自溴时,其他取代基选自氢;
10、或者当r1、r5同时选自异丙基时,其他取代基选自氢;
11、或者当r2、r4同时选自异丙基时,其他取代基选自氢;
12、或者当r3选自吗啉基时,r4选自氟,其他取代基选自氢。
13、所述的脒类有机碱的阳离子选自1,8-二偶氮杂双螺环[5.4.0]十一-7-烯的阳离子;所述双环胍类有机碱的阳离子选自1,5,7-三叠氮双环(4.4.0)癸-5-烯的阳离子或7-甲基-1,5,7-三氮杂二环(4.4.0)癸-5-烯的阳离子;所述氨基吡啶类有机碱的阳离子选自4-二甲氨基吡啶的阳离子。
14、所述羟基吡啶的阴离子选自2-羟基吡啶的阴离子、3-羟基吡啶的阴离子或4-羟基吡啶的阴离子。
15、优选地,所述式(i)所示催化剂选自如下结构:
16、
17、进一步优选地,所述式(i)所示催化剂选自如下结构:
18、
19、优选地,式(ii)所示环氧化物选自如下结构:
20、
21、进一步优选地,式(ii)所示环氧化物选自如下结构:
22、
23、所述的5–羟甲基恶唑烷酮的合成方法为,按照摩尔比为100:0.5~100:5将式(ii)所示环氧化物和式(i)所示催化剂在反应容器中混合反应,反应温度为25~100℃,反应时间为1~6h,二氧化碳的初始压力为0.05–1.5mpa,反应在有机溶剂介质中反应;所述反应容器在反应前进行无水无氧处理并充满二氧化碳;所述的有机溶剂为甲苯、n,n-二甲基甲酰胺、1,4-二氧六环、氯苯、乙腈。
24、本发明所述的优选反应温度为80℃,反应时间优选1h,二氧化碳的初始压力为0.1mpa,如式(ii)所示的环氧胺与式(i)所示的无卤素催化剂的摩尔比为100:5。
25、有益效果
26、本发明开发一种无卤素含吡啶阴离子有机离子对催化剂,催化环氧胺与co2实现分子内环加成反应,高效制备5–羟甲基恶唑烷酮。本发明首次提出利用羟基吡啶与常见有机碱组成的无卤素有机离子对催化剂催化环氧胺与co2生成5–羟甲基恶唑烷酮。采用本发明的技术方案至少可以达到如下有益效果之一:
27、(1)本发明提供的催化体系能够高效合成具有可修饰侧链基团的药物活性中间体5-羟甲基恶唑烷酮,相比于现有技术中利用金属催化剂、含卤素催化剂合成的5-羟甲基恶唑烷酮,具有产率高、无金属残留、无卤素残留、条件温和等特点。在生物医药等对金属、含卤残留要求严格的领域具有很大的商业应用潜力。
28、(2)本发明催化体系使用离子对双功能催化剂,通过hbd的氢键作用以活化环氧胺,以吡啶阴离子的氧负离子与n-h氢质子氢键结合增强氮原子的亲核性,随后活化二氧化碳。相较于其他高温、高压、催化剂负载量高等条件下合成5-羟甲基恶唑烷酮,本发明反应条件非常温和,催化剂体系相对简单。
29、(3)本发明催化体系催化反应,过程简单,所需要的设备简便,适用于工业化放大。
30、(4)本发明中使用的催化体系廉价容易制备,且催化剂用量少,具有高效定量转化的特点。部分文献中目前所报道的时间需要20小时(org.chem.front.,2022,9:4294)甚至更久(angew.chem.int.ed.,2016,55:3972)。
31、综上所述,本发明相比于现有的其他催化体系具有反应条件温和、催化剂用量少、高效、易制备、催化剂廉价易制备、不含金属、不含卤素等明显优势。
本文地址:https://www.jishuxx.com/zhuanli/20241009/305913.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。