一种精准评价百合耐热性方法
- 国知局
- 2024-11-06 14:42:40
本发明属于植物抗性检测,涉及一种精准评价百合耐热性的方法,具体涉及一种以检测百合中相关耐热基因的荧光定量水平来精准评价百合耐热性的方法。
背景技术:
1、百合(lilyum spp.)是百合科(liliaceae)百合属(lilium)的一种多年生的球根植物,百合植物原产于北半球的亚洲、欧洲和北美洲,在世界上约有110种百合属植物,其中在我国就约有55个种及变种,资源十分丰富。百合花大艳丽,寓意美好,深受人们喜爱。伴随着花卉产业的蓬勃发展,花卉展览作为乡村旅游的活动之一逐步兴起,特别是在国庆等盛事期间,对于切花百合的需求逐渐增大。
2、一般来说,解除休眠后的切花百合从定植到开花要2—3个月,若要满足国庆期间上市则需要在7—8月对百合进行种植,并保证其顺利越夏。因百合本身喜凉爽湿润气候,不耐高温,而我国华南、华北地区春夏多高温天气,在栽植生产中常常会高温热害造成植株生长瘦弱甚至停滞、花蕾败育、植株病虫害严重等现象,不仅影响切花品质,而且引起百合种球品质退化严重,在一定程度上还制约了其在园林景观的应用与家庭园艺推广。所以,探究一种能够精确评价百合耐热性的方法是一项迫切的任务。这个方法不仅可以帮助花农选择更优良的品种进行种植,还可以在保证百合花的产量和品质的情况下,使花农获得利润最大化,具有十分重要的意义。
技术实现思路
1、本发明的目的在于提供一种精准评价百合耐热性方法,该方法得到的基因表达能够很好地评价百合耐热性,评价方法操作较为简单且容易实现。
2、本发明解决其技术问题采用的技术方案为:
3、第一方面,本发明请求保护llhsfa1、llhsfa2和llwrky33中至少一种基因或用于定量检测百合中llhsfa1、llhsfa2和llwrky33中至少一种基因的物质在如下(1)或(2)中的应用:
4、(1)精准评价百合耐热性;
5、(2)制备精准评价百合耐热性的试剂或试剂盒。
6、进一步,上述的应用中,用于定量检测百合中llhsfa1、llhsfa2和llwrky33中至少一种基因的物质为用于荧光定量检测百合中llhsfa1、llhsfa2和llwrky33基因的引物:
7、qrt-llhsfa1-f:atgggaagtgtctatgtgggg
8、qrt-llhsfa1-r:cattgatacttggcagttgttgg
9、qrt-llhsfa2-f:cagactgaggtcgagttggaag
10、qrt-llhsfa2-r:aacacagccctcttatcttctcg
11、qrt-llwrky33-f:ccaccaccaccaataataac
12、qrt-llwrky33-r:acttcctccagttgtatcc。
13、进一步,上述的应用中,所述精准评价百合耐热性的过程为:对待测百合进行热胁迫,荧光定量检测热胁迫处理后百合中llhsfa1、llhsfa2和llwrky33至少一种基因的表达量来快速评价百合的耐热性;热胁迫后llhsfa1、llhsfa2和llwrky33至少一种基因的表达量提高的百合品种为高耐热性或中耐热性百合品种,热胁迫后llhsfa1、llhsfa2和llwrky33至少一种基因的表达量降低的百合品种为不耐热百合品种。
14、第二方面,本发明请求保护一种精准评价百合耐热性方法,该方法为:对待测百合进行热胁迫,荧光定量检测热胁迫处理后百合中llhsfa1、llhsfa2和llwrky33至少一种基因的表达量来快速评价百合的耐热性;热胁迫后llhsfa1、llhsfa2和llwrky33至少一种基因的表达量提高的百合品种为高耐热性或中耐热性百合品种,热胁迫后llhsfa1、llhsfa2和llwrky33至少一种基因的表达量降低的百合品种为不耐热百合品种。
15、进一步,该方法具体包括以下步骤:
16、(1)对待测百合进行热胁迫,选取热胁迫后百合叶片样品并清洗;
17、(2)提取百合叶片的rna;
18、(3)逆转录,合成cdna;
19、(4)荧光定量检测耐热关键基因llhsfa1、llhsfa2和llwrky33至少一种基因的表达量与对照组进行比较来快速评价百合耐热性;热胁迫后llhsfa1、llhsfa2和llwrky33至少一种基因的表达量提高的百合品种为高耐热性或中耐热性百合品种,热胁迫后llhsfa1、llhsfa2和llwrky33至少一种基因的表达量降低的百合品种为不耐热百合品种。
20、本发明具体实施方式中,所述的热胁迫处理为42℃人工热激处理2h。
21、进一步,上述的方法中,用于荧光定量检测百合中llhsfa1、llhsfa2和llwrky33基因的引物为:
22、qrt-llhsfa1-f:atgggaagtgtctatgtgggg
23、qrt-llhsfa1-r:cattgatacttggcagttgttgg
24、qrt-llhsfa2-f:cagactgaggtcgagttggaag
25、qrt-llhsfa2-r:aacacagccctcttatcttctcg
26、qrt-llwrky33-f:ccaccaccaccaataataac
27、qrt-llwrky33-r:acttcctccagttgtatcc。
28、进一步,步骤(1)中,选取热胁迫后百合叶片样品的过程为:对处于营养生长期的长势良好、健康百合植株,选取百合植株茎秆中部完整、健康的叶片若干,用无酶水清洗干净叶片上的尘土,擦干叶片上的水分;所述的百合叶片样品,若不立即进行后续实验可将样品放入-80℃中保存。
29、进一步,步骤(2)中,所述的百合叶片rna,若不立即进行后续实验可将样品放入-80℃中保存。
30、进一步,步骤(3)中,所述的cdna,若不立即进行后续实验可将样品放入-20℃中保存。
31、本发明的具体实施方式中,精准评价百合耐热性方法包括以下步骤:
32、(1)取样:对待测百合进行热胁迫,对热胁迫后处于营养生长期的长势良好、健康百合植株,取百合植株茎秆中部完整、健康的叶片若干,用无酶水清洗干净叶片上的尘土,擦干叶片上的水分。若不立即进行后续实验可将样品放入-80℃中保存;
33、(2)提取百合叶片rna:
34、植物组织的裂解:
35、①将新鲜或-80℃冻存的植物组织样品转移至液氮预冷的研钵或高通量组织研磨仪中,用研杵或组织研磨仪研磨植物组织(研磨过程中需要不断向研钵中补加液氮,保证研磨过程中样品一直处于低温环境中),直至研磨成粉末状(无明显可见颗粒,研磨不充分会影响rna的收量)。
36、②将50~100mg已研磨成粉末状的样本转移至含有500μl裂解液buffer pps的1.5ml离心管(rnase free)中,立即高速涡旋混匀或用移液枪反复吹打至样本无明显沉淀。
37、③将上述裂解液12000rpm,4℃离心5分钟。转移上清液至新的1.5ml离心管(rnasefree)中。加入上清液1/10体积的buffer pa-2(此时会出现沉淀),涡旋振荡混匀10次(约15秒)。再12000rpm,4℃离心5分钟。
38、④将上清液转移至新的2.0ml离心管(rnase free)中。加入500μl裂解液bufferrls(在使用前确认buffer rls中已加入50×dtt solution),立即高速涡旋混匀或用移液枪反复吹打至样本充分裂解(无明显沉淀)。
39、纯化:
40、①向上述裂解液中加入1/2体积的无水乙醇,用移液枪吹打混匀,若出现明显粘稠物或沉淀,用移液枪吹打多次,打散沉淀。(注:若沉淀不打散后续会导致plant rna minicolumn堵塞,影响收量及纯度。)
41、②将上述混合液和沉淀全部转移至plant rnamini column中,12000rpm室温离心2分钟,弃滤液。
42、③向plant rnamini column中加入600μl的buffer rwa,12000rpm室温离心1分钟,弃滤液。
43、④向plant rnamini column中加入750μl的buffer rwb,12000rpm室温离心1分钟,弃滤液。
44、⑤消化:按下表1配制dnase i反应液并混匀。把50μl dnase i反应液加到plantrnamini column的膜中央,室温静置15分钟。表1如下所示:
45、表1dnase i反应液的配制
46、
47、
48、⑥向上述plant rnamini column膜中央加入350μl buffer rwb,12000rpm室温离心1分钟,弃滤液。
49、⑦向plant rnamini column中加入750μl的buffer rwb,12000rpm室温离心1分钟,弃滤液。
50、⑧将plant rnamini column的吸附柱安置于新的2.0ml collection tube上,12000rpm室温离心2分钟。
51、⑨将plant rna mini column的吸附柱安置于新的rnase free tube上,在吸附柱膜的中央处加入50μl-200μl rnase free water,室温静置5分钟,然后12000rpm室温离心2分钟洗脱得到rna,可用于后续实验。若不立即进行后续实验可将溶解后的rna放入-80℃中保存。
52、(3)逆转录,合成cdna:
53、①基因组dna去除:在rnase-free离心管中配制如表2所示的反应液1:
54、表2反应液1的配制
55、
56、用移液器轻轻吹打混匀。42℃2min。
57、②配制逆转录反应体系:在第1步的反应管中直接加入5×hiscript iii qrtsupermix,配制如表3所示的反应液2。
58、表3反应液2的配制
59、
60、用移液器轻轻吹打混匀。
61、no rt control反应(可选)
62、no rt control是指不加逆转录酶的逆转录阴性对照反应,用于检验rna模板中是否有基因组dna残留。
63、在rnase-free离心管中配制如表4所示的反应液3:
64、表4反应液3的配制
65、
66、用移液器轻轻吹打混匀。
67、③进行逆转录反应。
68、逆转录反应程序如表5所示。
69、表5进行逆转录反应
70、
71、*如果模板具有复杂二级结构或高gc区域,可将反应温度提高至50℃,有助于提高产量。
72、产物可立即用于qpcr反应,或在-20℃保存,并在半年内使用;长期存放建议分装后在-70℃保存。cdna应避免反复冻融。
73、(4)荧光定量实验:
74、①确定内参基因18s:可根据自己实验材料选择适合的内参基因。
75、②设计引物:引物利用在线网站(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool)进行设计,并由北京擎科生物科技有限公司合成。
76、荧光定量引物序列见下表6。
77、表6荧光定量所使用的引物序列
78、
79、③配制qpcr反应体系:
80、荧光定量pcr的反应试剂为premix ex taqtmii(takara),具体实验体系如下表7:
81、表7qpcr反应体系的配制
82、
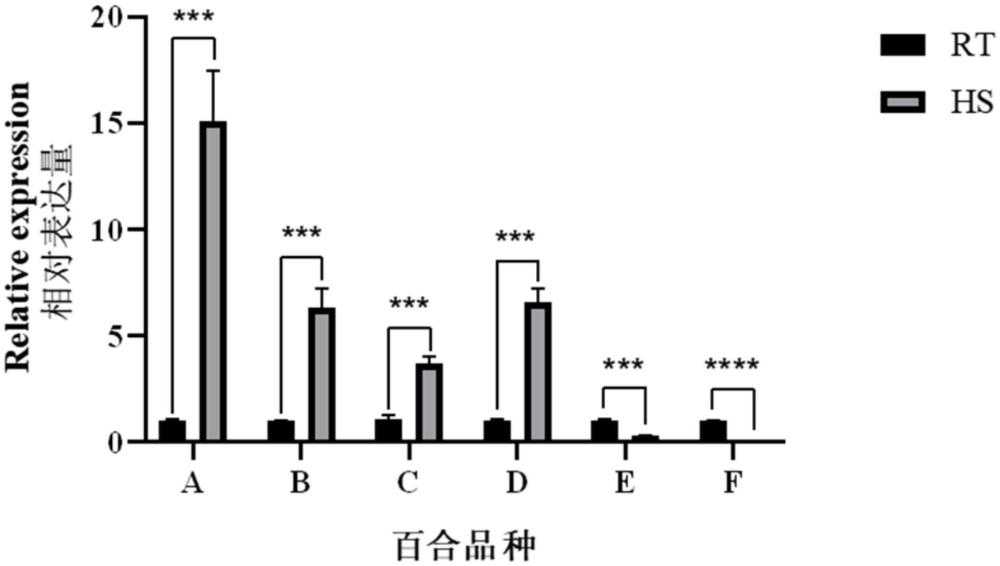
83、混匀样品,离心。
84、④qrt-pcr扩增条件:使用bio-rad cfx96荧光定量pcr仪进行pcr反应,具体反应程序为:
85、荧光定量pcr反应扩增条件如表8所示。
86、表8qrt-pcr扩增条件
87、
88、以18s为参考基因,每个样品进行生物学重复3次和技术重复3次,实验结果使用2-δδct方法统计分析,计算目标基因的相对表达量。
89、优选的,所述的相关耐热基因为llhsfa1、llhsfa2和llwrky33。
90、进一步优选的,所述的相关耐热基因为llhsfa1时,荧光定量结果为:热胁迫会提高llhsfa1在高耐和中耐百合品种中的表达量,会降低其在不耐百合品种中的表达量。
91、进一步优选的,所述的相关耐热基因为llhsfa2时,荧光定量结果为:热胁迫会提高llhsfa2在高耐和中耐百合品种中的表达量,会降低其在不耐百合品种中的表达量。
92、进一步优选的,所述的相关耐热基因为llwrky33时,荧光定量结果为:热胁迫会提高llwrky33在高耐和中耐百合品种中的表达量,会降低其在不耐百合品种中的表达量。
93、本发明的具体实施方式中,本发明的精准评价百合耐热性方法中的相关耐热基因是采用以下步骤筛选的:
94、(1)取样:
95、试验设2个温度因子:塑料大棚内种植百合营养生长期实验室人工42℃人工热激2h处理和百合营养生长期实验室室温(25℃)2h处理。
96、选取处于营养生长期的长势良好、健康百合百合植株茎秆中部完整、健康的叶片若干,用无酶水清洗干净叶片上的尘土,擦干叶片上的水分,放入-80℃中保存用于后续实验。
97、(2)百合叶片rna的提取:
98、①将新鲜或-80℃冻存的植物组织样品转移至液氮预冷的研钵或高通量组织研磨仪中,用研杵或组织研磨仪研磨植物组织(研磨过程中需要不断向研钵中补加液氮,保证研磨过程中样品一直处于低温环境中),直至研磨成粉末状(无明显可见颗粒,研磨不充分会影响rna的收量)。
99、②将50~100mg已研磨成粉末状的样本转移至含有500μl裂解液buffer pps的1.5ml离心管(rnase free)中,立即高速涡旋混匀或用移液枪反复吹打至样本无明显沉淀。
100、③将上述裂解液12000rpm,4℃离心5分钟。转移上清液至新的1.5ml离心管(rnasefree)中。加入上清液1/10体积的buffer pa-2(此时会出现沉淀),涡旋振荡混匀10次(约15秒)。再12000rpm,4℃离心5分钟。
101、④将上清液转移至新的2.0ml离心管(rnase free)中。加入500μl裂解液bufferrls(在使用前确认buffer rls中已加入50×dtt solution),立即高速涡旋混匀或用移液枪反复吹打至样本充分裂解(无明显沉淀)。
102、纯化:
103、①向上述裂解液中加入1/2体积的无水乙醇,用移液枪吹打混匀,若出现明显粘稠物或沉淀,用移液枪吹打多次,打散沉淀。(注:若沉淀不打散后续会导致plant rna minicolumn堵塞,影响收量及纯度。)
104、②将上述混合液和沉淀全部转移至plant rnamini column中,12000rpm室温离心2分钟,弃滤液。
105、③向plant rnamini column中加入600μl的buffer rwa,12000rpm室温离心1分钟,弃滤液。
106、④向plant rnamini column中加入750μl的buffer rwb,12000rpm室温离心1分钟,弃滤液。
107、⑤消化:按下表1配制dnase i反应液并混匀。把50μl dnase i反应液加到plantrnamini column的膜中央,室温静置15分钟。
108、下表1所示。
109、表1dnase i反应液的配制
110、
111、⑥向上述plant rnamini column膜中央加入350μl buffer rwb,12000rpm室温离心1分钟,弃滤液。
112、⑦向plant rnamini column中加入750μl的buffer rwb,12000rpm室温离心1分钟,弃滤液。
113、⑧将plant rnamini column的吸附柱安置于新的2.0ml collection tube上,12000rpm室温离心2分钟。
114、⑨将plant rna mini column的吸附柱安置于新的rnase free tube上,在吸附柱膜的中央处加入50μl-200μl rnase free water,室温静置5分钟,然后12000rpm室温离心2分钟洗脱得到rna,可用于后续实验。若不立即进行后续实验可将溶解后的rna放入-80℃中保存。
115、(3)逆转录,合成百合叶片cdna:
116、①基因组dna去除:在rnase-free离心管中配制如下混合液:
117、下表2所示。
118、表2反应液1的配制
119、
120、用移液器轻轻吹打混匀。42℃2min。
121、②配制逆转录反应体系:在第1步的反应管中直接加入5×hiscript iii qrtsupermix:
122、下表3所示。
123、表3反应液2的配制
124、
125、用移液器轻轻吹打混匀。
126、no rt control反应(可选)
127、no rt control是指不加逆转录酶的逆转录阴性对照反应,用于检验rna模板中是否有基因组dna残留。
128、在rnase-free离心管中配制如下混合液:
129、下表4所示。
130、表4反应液3的配制
131、
132、用移液器轻轻吹打混匀。
133、③进行逆转录反应。
134、下表5所示。
135、表5进行逆转录反应
136、
137、*如果模板具有复杂二级结构或高gc区域,可将反应温度提高至50℃,有助于提高产量。
138、产物可立即用于qpcr反应,或在-20℃保存,并在半年内使用;长期存放建议分装后在-70℃保存。cdna应避免反复冻融。
139、(4)百合相关耐热基因半定量实验:
140、①确定内参基因18s:可根据自己实验材料选择适合的内参基因。
141、②设计引物:引物利用在线网站(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool)进行设计,并由北京擎科生物科技有限公司合成。
142、基因半定量引物序列见下表9。
143、表9基因半定量所使用的引物序列
144、
145、③配制基因半定量反应体系:
146、基因半定量的反应试剂为2×rapidtaq master mix,具体实验体系如下表10:
147、表10基因半定量反应体系的配制
148、
149、混匀样品,离心。
150、④基因半定量扩增条件:使用pcr仪进行pcr反应,具体反应程序为:
151、下表11所示。
152、表11基因半定量扩增条件
153、
154、以18s为参考基因,每个样品进行生物学重复3次,根据实验结果进行统计分析。
155、(5)数据分析,得出最优耐热指示基因:通过对试验结果进行分析对比,确定最佳的耐热指示基因。
156、本发明试验过程中所采用的百合材料可以为自主研发培育并已推广和公开的新品种,或者市售的百合品种,例如由南京农业大学八卦洲百合实验基地自主研发培育并已推广和公开的功能性百合新品种‘飞翔天橙’、市售的百合品种‘伊萨贝拉’等;实施例中采用包括百合品种‘伊萨贝拉’(周径16~18cm)、‘异域阳光’(周径18~20cm)、‘麦丹娜’(周径20~22cm)在内的36个观赏百合品种,以及来源于南京农业大学百合种质资源保存中心(中国江苏省南京市八卦洲)的百合品种飞翔系列,包括‘飞翔天橙’(周径12~14cm)、‘飞翔韶华’(周径12~14cm)在内的6个功能性百合品种。
157、本发明的有益效果:
158、本发明以百合相关耐热基因的表达量为测定值,在基因半定量实验的基础上筛选出了对百合种质资源耐热性指示性最好的3个相关耐热基因,包括llhsfa1、llhsfa2和llwrky33。对筛选出的耐热基因,通过检测其在不同温度处理下的高耐、中耐和不耐百合品种中的基因表达量,对其实验结果进行数据分析,得出热胁迫会提高llhsfa1、llhsfa2和llwrky33在高耐和中耐百合品种中的表达量,会降低其在不耐百合品种中的表达量。本发明为百合耐热性资源的综合利用以及精准评价百合耐热性提供理论依据,并为其推广应用奠定基础。
本文地址:https://www.jishuxx.com/zhuanli/20241106/323671.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表