一类手性羟基吡啶噁唑啉骨架的化合物及其衍生物的制备方法及应用
- 国知局
- 2024-10-21 14:22:45
本技术涉及一类手性羟基吡啶噁唑啉骨架的化合物及其衍生物的制备方法及应用,属于有机合成。
背景技术:
1、在过去的几十年中,金属和有机催化占据了当代催化领域的主导,但仍然存在仅通过单个催化模式难以实现反应。因此,将两种催化模式放在同一分子内,从而构建双功能的催化剂引起了广大科学家们的关注。一方面,金属催化的单元用于激活一系列惰性化学键,另一方面,有机催化单元用于进一步激活底物和手性诱导。与仅使用单个催化系统相比,这两种不同的催化系统的组合可以更好地转化有机反应。在有机催化中氢键相互作用扮演者重要的角色。例如手性磷酸、手性硫脲等。
技术实现思路
1、本技术的目的是提供一类手性羟基吡啶噁唑啉骨架的化合物及其衍生物及其合成方法。为一种手性羟基吡啶噁唑啉(咪唑啉、噻唑啉)骨架的双功能配体,该催化剂在银催化亚胺基酯与n-苯基马来酰亚胺的不对称1,3-偶极环加成反应中取得了优秀的结果。
2、为了拓展手性双功能配体的种类并探索其在1,3-偶极环加成反应中更多的可能,本技术设计了一系列手性羟基吡啶噁唑啉骨架的化合物及其衍生物配体。本发明的技术方案如下:
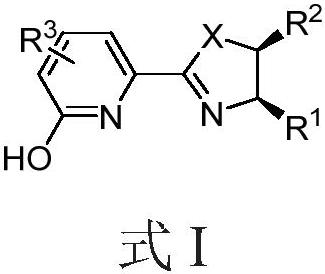
3、一方面,本发明提供一类中心手性化合物,具有式i所示的结构,
4、
5、式i中:
6、r1、r2各自独立地选自氢、苯基、苄基、叔丁基、异丙基中的一个或两个,但r1、r2不能同时为氢;或r1、r2相连,结构为
7、x独立地选自nr、o、s中的一种;所述nr中r取自c1-c5的烷基、苄基、boc、ts取代基中的一种。
8、r3独立地选自吡啶基团、取代吡啶基团、异喹啉基团;所述取代吡啶的取代基选自c1-c5的烷基、甲氧基、苯基、三氟甲基中的一种。
9、可选地,所述羟基吡啶噁唑啉骨架的化合物及其衍生物为具有外消旋的羟基吡啶噁唑啉骨架的化合物及其衍生物、(r)-羟基吡啶噁唑啉骨架的化合物及其衍生物、(s)-羟基吡啶噁唑啉骨架的化合物及其衍生物中的一种。
10、根据本技术的另一个方面,提供了一种上述所述的羟基吡啶噁唑啉骨架的化合物及其衍生物的制备方法,其中的一种实施方式是采用方法一制备;
11、
12、所述方法一是含有式ii所示化合物a、化合物b和溶剂u的混合液,在非活性气氛中发生环化反应,得到化合物c。然后在溶剂v、酸w条件下发生脱去羟基保护的反应,得到式i所示化合物;式ii中r1、r2、r3、x的定义同式i中r1、r2、r3、x的定义。
13、可选地,所述式ii所示方程式中化合物a与化合物b的摩尔比为1∶1.1~1∶1.5中的任意值。
14、可选地,所述环化反应的反应条件是温度t1为40~60℃中的两点间任意值,反应时间24~72小时。
15、可选地,所述环化反应中的非活性气氛选自氮气、氩气中的至少一种。
16、可选地,所述环化反应中的溶剂u选自甲醇、二氯甲烷、乙醇中的至少一种。
17、可选地,所述反脱去羟基保护应的反应条件温度t2为室温,反应时间为30~60分钟。
18、可选地,所述式ii所示脱去羟基保护反应,式ii化合物c在溶剂v中的摩尔浓度为1.0摩尔每升。
19、可选地,所述酸w为甲酸、三氟乙酸中的一种。
20、可选地,所述溶剂v为二氯甲烷、氯仿、乙酸乙酯中的一种。
21、可选地,所述溶剂v与酸w的比例体积比为1∶1~1∶3。
22、其中的另一种实施方式是采用方法二制备;
23、所述方法二包括偶联反应和脱去羟基保护反应;
24、
25、所述含有式iii所示化合物d、化合物e、碱e、金属m、配体l和溶剂z的混合液,在非活性气氛中发生偶联反应,得到化合物c。然后在溶剂v、酸w条件下发生脱去羟基保护的反应,得到式i所示化合物;式iii中r1、r2、r3、x的定义同式i中r1、r2、r3、x的定义。
26、所述偶联反应中:
27、可选地,所示式iii所示化合物d、化合物e的摩尔比为1∶1.1~1∶1.5;
28、可选地,所述式iii所示化合物d、碱e的摩尔比为1∶1.5~1∶3;
29、可选地,所述式iii所示化合物d、金属m的摩尔比为1∶0.025~1∶0.030;
30、可选地,所述式iii所示化合物d、配体l的摩尔比为1∶0.028~1∶0.050;
31、可选地,所述式iii所示化合物在溶剂z中的摩尔浓度为0.1~0.3mol/l。
32、可选地,所述偶联反应中金属m为醋酸钯、溴化镍中的一种。
33、可选地,所述偶联反应中配体l为dppp与dppe中的一种。
34、可选地,所述偶联反应中碱e为叔丁醇锂、叔丁醇钠、叔丁醇钾中的一种。
35、可选地,所述偶联反应中溶剂z为1,4-二氧六环、甲苯、四氢呋喃中的一种。
36、可选地,所述偶联反应中化合物d所示y可独立的选自br、cl、i其中一种。
37、可选地,所述偶联反应中非活性气氛选自氮气、氩气中的至少一种。
38、可选地,所述偶联反应的条件温度t3为100-110℃。
39、可选地,所述偶联反应的时间为10~72小时。
40、可选地,所述脱去羟基保护反应的反应条件温度t2为室温,反应时间为30~60分钟。
41、可选地,所述式ii所示脱去羟基保护反应,式iii化合物c在溶剂v中的摩尔浓度为1.0摩尔每升。
42、可选地,所述酸w为甲酸、三氟乙酸中的一种。
43、可选地,所述溶剂v为二氯甲烷、氯仿、乙酸乙酯中的一种。
44、可选地,所述溶剂v与酸w的比例体积比为1∶1~1∶3。
45、根据本技术的又一个方面,提供一种上述所述的手性羟基吡啶噁唑啉骨架的化合物及其衍生物、上述所述的制备方法制备的手性羟基吡啶噁唑啉骨架的化合物及其衍生物中的至少一种作为配体,在银催化亚胺基酯与n-苯基马来酰亚胺的不对称1,3-偶极环加成反应中的应用。
46、作为一个具体的实施方式,本发明通过下述技术方案实现:
47、一类手性羟基吡啶噁唑啉骨架的化合物及其衍生物的合成方法,该化合物可以是消旋的或光学活性的,基于手性羟基吡啶噁唑啉骨架的化合物及其衍生物的结构式为下述式i化合物的结构:
48、
49、其中:
50、r1、r2独立地选自氢、苯基、苄基、叔丁基、异丙基中的一个或两个,但r1、r2不能同时为氢;或r1、r2相连,结构为
51、x独立地选自nr、o、s中的一种;所述nr中r取自c1-c5的烷基、苄基、boc、ts取代基中的一种;
52、r3独立地选自吡啶基团、取代吡啶基团、异喹啉基团;所述取代吡啶的取代基选自c1-c5的烷基、甲氧基、苯基、三氟甲基中的一种。
53、本发明提供的是一类基于手性羟基吡啶噁唑啉骨架的化合物及其衍生物的设计和合成,其合成路线如下:
54、
55、r1、r2独立地选自氢、苯基、苄基、叔丁基、异丙基中的一个或两个,但r1、r2不能同时为氢;或r1、r2相连,结构为
56、x独立地选自nr、o、s中的一种;所述nr中r取自c1-c5的烷基、苄基、boc、ts取代基中的一种;
57、r3独立地选自吡啶基团、取代吡啶基团、异喹啉基团;所述取代吡啶的取代基选自c1-c5的烷基、甲氧基、苯基、三氟甲基中的一种。
58、反应步骤为:
59、方法一:包括一步环化反应和一步脱去羟基保护反应
60、步骤一环化反应
61、氮气保护下,向schlenk瓶中加入式ii所示化合物a和化合物b,溶剂u,40~60℃下搅拌,反应24~72小时,得到化合物c。
62、步骤二脱去羟基保护反应
63、向反应瓶中加入化合物c、酸w、溶剂v,室温下搅拌,反应30~60分钟,得到手性羟基吡啶噁唑啉骨架的配体及其衍生物(式i所示化合物)。
64、方法二:包括一步偶联反应和一步脱去羟基保护反应
65、步骤一偶联反应
66、氮气保护下,向schlenk瓶中加入式iii所示化合物d、化合物e,金属m、配体l、碱e、溶剂z,100-110℃下搅拌,反应10~72小时,得到化合物c。
67、步骤二脱去羟基保护反应
68、向反应瓶中加入化合物c、酸w、溶剂v,室温下搅拌,反应30~60分钟,得到手性羟基吡啶噁唑啉骨架的配体及其衍生物(式i所示化合物)。
69、本技术中,“烷基”是由烷烃化合物分子上失去任意一个氢原子所形成的基团。所述烷烃化合物包括直链烷烃、支链烷烃、环烷烃、带有支链的环烷烃。
70、本技术中,“苯基”是甲苯失去苯环上氢原子所形成的苯基。
71、本技术中,“c1~c5的烷基”是指直链或支链的具有1~5个碳原子的烷基;优选的“c1~c5的烷基”包括甲基、乙基、正丙基、异丙基等。
72、本技术技术实现要素:部分,“室温”为20℃-30℃。
73、本技术能产生的有益效果包括:
74、1)本发明可有效合成一类新型的手性羟基吡啶噁唑啉骨架的配体及其衍生物,其合成路线短,能够以高收益率得到目标化合物。
75、2)本发明合成的基于手性羟基吡啶噁唑啉骨架的配体及其衍生物,可应用于银催化亚胺基酯与n-苯基马来酰亚胺的不对称1,3-偶极环加成反应中,具有优秀的催化活性和对映选择控制能力。
本文地址:https://www.jishuxx.com/zhuanli/20241021/317932.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表