基于无膜式器官芯片构建肝纤维化模型的方法与流程
- 国知局
- 2024-09-05 14:59:07
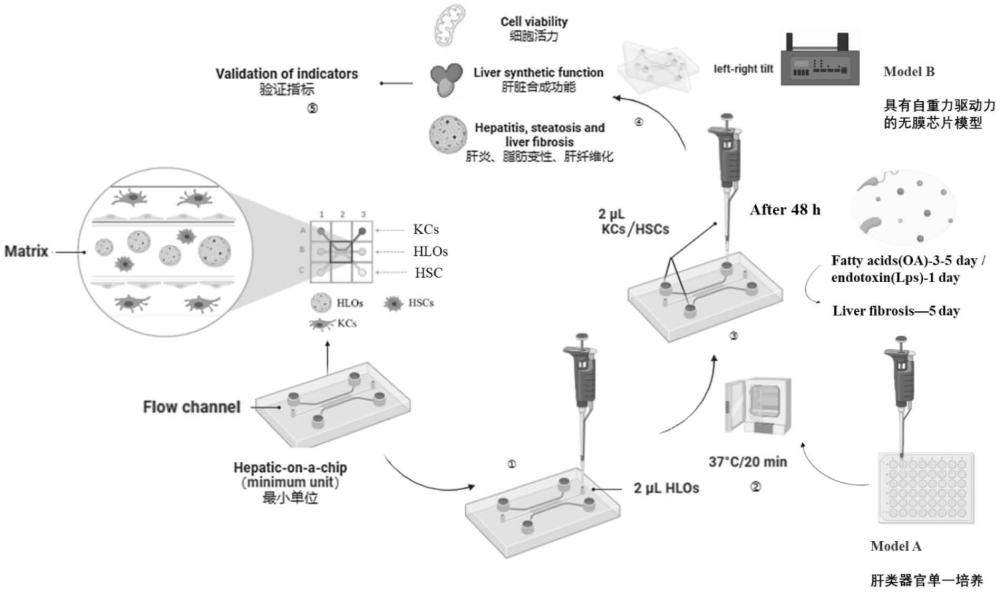
本发明涉及体外肝脏纤维化模型构建,尤其是一种基于无膜式器官芯片构建肝纤维化模型的方法。
背景技术:
1、肝脏是人体最大的消化腺,负责合成、代谢、分解、解毒等500多种功能。它主要由肝细胞和非实质细胞组成,如肝窦内皮细胞(lsecs)、肝星状细胞(hepatic stellatecell,hsc)和kupffer细胞(kcs),它们通过直接或间接的细胞串扰事件共同调节肝功能。肝纤维化(liver fibrosis)是多种病因导致的慢性肝脏疾病。其主要特征是肝脏内弥漫性的、过量的细胞外基质沉积,尤其是胶原。研究表明,如果能给予有效的病因治疗,或能直接抑制细胞外基质的合成或促进其降解,已经形成的肝纤维化甚至是可以逆转的,但是当病变继续进展产生肝硬化(cirrhosis)及肝细胞肝癌(hepatocellular carcinoma)时,肝脏结构和功能会发生不可逆损害,威胁患者生命。
2、由于缺乏足够的体外模型来复制肝脏纤维化存在的病理进程和生化刺激,相关机制研究以及新药药效评价因此受到一定程度的阻碍。关于体外肝纤维化模型,有研究证实体外多能干细胞分化而来的3d类器官经过不饱和脂肪酸孵育后,显示出脂肪肝的表型,进而出现非酒精性脂肪性肝病相关的结构变化。然而,这些研究未能再现更多依赖于细胞环境的纤维化表型,如脂肪性肝炎以及星状细胞活化导致的纤维化的表型,基于此,以上模型存在的主要局限性是没有其他肝脏细胞类型,例如kupffer细胞和星状细胞,据报道它们对nash的发展都很重要。另外,亦有相关研究证明肝细胞和星状细胞共培养模型可以通过细胞因子刺激,介导星状细胞直接激活,最终导致纤维化表型,然而违背了肝纤维化正常的发病进展,并且也只仅限于对单种星状细胞的研究,未考虑其他细胞的作用。近期也有研究将肝细胞、肝星状细胞和巨噬细胞共同混合于单孔内,并证实其在纤维化模型构建领域的可行性,但该模型仅考虑了具有多细胞成分的微环境,并未考虑细胞与细胞之间的空间结构和相互作用。此外,目前基于二维细胞和基于3d类器官平台培养的体外肝脏纤维化模型的构建方法缺乏必要的支持成分以及时间依赖条件,如促纤维化或炎症细胞类型,因此对炎症性疾病进行建模的能力有限。
技术实现思路
1、针对现有技术的不足,本发明提供一种基于无膜式器官芯片构建肝纤维化模型的方法,目的是模拟出肝脏从炎症到脂质积累再到纤维化的动态过程,更接近于人体肝脏纤维化的病变特征。
2、本发明采用的技术方案如下:
3、一种基于无膜式器官芯片构建肝纤维化模型的方法,包括:
4、s1、细胞培养,包括培养肝类器官、肝星状细胞、库普弗细胞;
5、s2、基于所培养的细胞采用自重力驱动的无膜芯片构建肝类器官的共培养模型;
6、s3、基于不同诱导条件对所述共培养模型进行纤维化诱导,获得肝纤维化模型;
7、所述自重力驱动模式的无膜芯片包括依次设置的a、b、c三个通道,相邻通道间设有导向结构,且无膜阻挡;
8、所述共培养模型的构建,包括:
9、s21、对所述肝类器官、肝星状细胞、库普弗细胞分别进行悬重混合、收集,获得包含肝类器官的基质胶、分别包含肝星状细胞和库普弗细胞的细胞悬液,使肝类器官、肝星状细胞、库普弗细胞数量比为(25~35):1:(5~10);
10、s22、将所述包含肝类器官的基质胶注入所述无膜芯片的b通道,然后转移到培养箱中静置,待胶凝固后进行后续操作;
11、s23、将肝星状细胞悬液、库普弗细胞悬液依次注入无膜芯片的其余两个通道,对每个通道加样完成之后,将无膜芯片以设定的倾斜角度放置一段时间;
12、s24、待三通道内细胞均铺满稳定后,向无膜芯片的a、c通道内各补充共培养基,所述共培养基由所述细胞培养时培养三种细胞所需的培养基按照1:1:1制备而成;
13、s25、将无膜芯片放置在培养箱内的摇摆灌注仪上进行培养;
14、所述基于不同诱导条件对所述共培养模型进行纤维化诱导,获得肝纤维化模型,包括:
15、待共培养模型的b通道内类器官直径达设定值,使用内毒素脂多糖或者内毒素脂多糖和不饱和脂肪酸的组合,对共培养模型进行不同时间的诱导处理,获得对应的肝纤维化模型。
16、进一步技术方案为:
17、步骤s23中,采用垂直加样方式向每个通道注液,注液的体积为1.5~2.5μl;
18、对每个通道加样完成之后,将无膜芯片倾斜75°~80°放置1~2h,使a或c通道中的细胞在b通道的基质胶上贴壁。
19、步骤s25中,将无膜芯片水平放置在摇摆灌注仪上,无膜芯片水平放置时,b通道处于中间,其余两通道位于b通道的上下两侧,摇摆过程中使a、c通道内液体相互冲击,摇摆角度设置为3°~7°/h。
20、步骤s22中,采用垂直加样方式向b通道注入所述基质胶,注入体积为1.5~2.5μl;
21、注入完成后,将芯片转移到37℃培养箱中静置10-20min,以待胶凝固。
22、步骤s24中,所述共培养基的加入量为50μl。
23、步骤s3中,设置三个诱导条件组,以获得三种肝纤维化模型,所述三个诱导条件组包括:
24、组一:给予内毒素脂多糖处理24h后,收集类器官球体以及培养基上清待检测;
25、组二:给予内毒素脂多糖处理24h后,更换含有不饱和脂肪酸的培养基进行孵育,48h后收集类器官球体以及培养基上清;
26、组三:给予内毒素脂多糖处理24h后,更换含有不饱和脂肪酸的培养基进行孵育,48h后换液,继续使用含有不饱和脂肪酸的培养基进行孵育48h,在实验终期第五天收集类器官球体以及培养基上清。
27、所述给予内毒素脂多糖处理,包括:将包含内毒素脂多糖的培养基分别注入无膜芯片的三通道中;
28、所述含有不饱和脂肪酸的培养基进行孵育,包括:将包含内毒素脂多糖的培养基分别注入无膜芯片的三通道中。
29、组二和组三中,更换的含有不饱和脂肪酸的培养基中不饱和脂肪酸为500μm。
30、步骤s1中培养肝类器官,包括:
31、肝类器官复苏后最少传代一次,待生长发育至直径为50-100μm,形态为具有管腔结构的球体;然后进行消化处理,细胞计数后进行培养实验操作,使得类器官的数量达到2.5×106个/ml;
32、培养肝星状细胞,包括:
33、在肝星状细胞生长到70%~80%融合度时消化处理,细胞计数后进行培养实验操作;
34、培养库普弗细胞,包括:
35、收集处于对数生长期的人白血病单核细胞系thp-1细胞,以(4~6)×105/ml细胞密度进行操作:使用含有佛波酯的rpmi-1640培养基重悬,使佛波酯最终浓度为50~100ng/ml。
36、本发明的有益效果如下:
37、本发明集成了肝脏内不同类型的细胞构建肝脏类器官与肝星状细胞和kcs细胞共培养体系,基于无膜芯片利用重力驱动的方式实现一种动态培养以及营养物质的充分交换,通过内毒素和不饱和脂肪酸不同刺激因子的处理,通过不同时间条件,在一定程度上模拟出肝脏从炎症(肝炎)到脂质积累(脂肪肝)再到纤维化的动态过程,能呈现出更加真实的发病进程以及肝损伤程度,更接近于人体肝脏纤维化的病变特征。
38、本发明构建的基于无膜芯片的共培养肝纤维化模型更好地还原了人体内的复杂的肝脏微环境,在肝功能表型方面,与单独培养肝类器官体系相比,具有更敏感的刺激反应性以及更真实的肝炎-肝纤维化表型。
39、本发明的三通道结构无膜芯片能够规范、可重复地实施构建肝脏类器官与肝非实质细胞以及免疫细胞共培养模型的实验方法。
40、本发明的其它特征和优点将在随后的说明书中阐述,或者通过实施本发明而了解。
本文地址:https://www.jishuxx.com/zhuanli/20240905/289002.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表