核酸递送载体、核酸递送载体组、核酸递送组合物和核酸递送方法与流程
- 国知局
- 2024-11-25 15:04:21
【】本文所述的实施方式通常涉及核酸递送载体,核酸递送载体组,核酸递送组合物和核酸递送方法。
背景技术
0、背景技术:
1、最近,已经发现了许多可用于基因工程的功能蛋白,包括特异性地切割dna的crispr关联蛋白9(cas9)和切出靶dna并将其插入细胞基因组中的转座酶。为了基因工程学地利用这种功能蛋白,已经寻求一种技术可以以更有效的方式细胞内导入和表达功能蛋白。
2、例如,已经使用了方法,其包括将编码功能性蛋白的dna(例如,载体)递送到细胞中以细胞内表达功能蛋白。不幸的是,单独的dna难以穿过质膜渗透入细胞。将dna导入细胞中的方法的实例包括使用脂质体的方案。脂质体可以与核酸结合形成复合物,使其容易将核酸导入细胞中。
3、【附图简述】
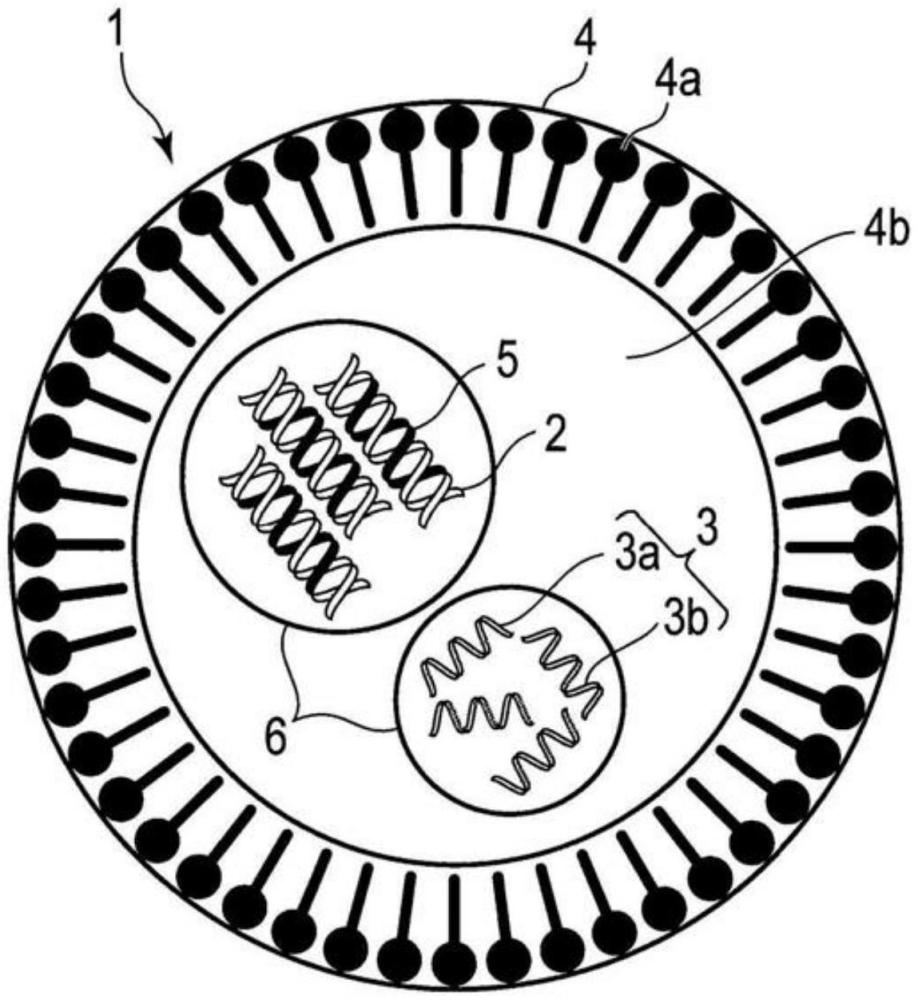
4、图1是显示根据一实施方式的核酸递送载体的实例的剖视图。
5、图2是显示根据一实施方式的核酸递送方法的实例的流程图。
6、图3是显示根据一实施方式的核酸递送载体的实例的截面图。
7、图4是显示根据一实施方式的核酸递送载体组的实例的截面图。
8、图5是显示实施例1的实验结果的图。
9、图6是显示实施例1的实验结果的显微镜照片。
10、图7是显示实施例2的实验结果的直方图。
11、图8是显示实施例3的实验结果的直方图。
12、图9是显示实施例4的实验结果的图。
13、图10是显示实施例4的实验结果的直方图。
14、图11是显示实施例5的实验结果的图。
15、图12是显示实施例6的实验结果的电泳照片。
16、图13是显示实施例6的实验结果的显微镜照片。
17、【发明详述】
18、通常,根据一实施方式,根据实施方式的核酸递送载体用于将第1序列整合到细胞基因组中。核酸递送载体包含:含有第1序列的供体dna;至少含有编码蛋白的rna的rna剂,所述蛋白涉及将第1序列整合到基因组中;和包封供体dna和rna剂的脂质粒子。
19、下面将参考附图描述各实施方式。每个图是实施方式及用于促进其理解的示意图。另外,附图具有与实际形式,尺寸和比例不同的位点。如果合适,可以修改这些设计,同时考虑以下描述和已知技术。
20、根据一实施方式的核酸递送载体包含:含有第1序列的供体dna,至少含有编码蛋白的rna剂,该蛋白涉及将第1序列整合到基因组中,以及包封供体dna和rna剂的脂质粒子。该核酸递送载体用于将第1序列整合到细胞基因组中(即,将第1序列导入细胞中)。另外,实施方式提供:核酸递送载体组,其包含单独的脂质粒子,每个脂质粒子包封供体dna或rna剂;核酸递送组合物,其包含核酸递送载体或核酸递送载体组;和使用核酸递送载体或核酸递送载体组的核酸递送方法。下面详细描述核酸递送载体,核酸递送载体组,核酸递送组合物和核酸递送方法。
21、(第1实施方式)
22、【核酸递送载体】
23、图1是显示第1实施方式的核酸递送载体的实例的剖视图。该核酸递送载体1包含供体dna 2,rna剂3和包封供体dna 2和rna剂3的脂质粒子4。供体dna 2包含第1序列5,其待整合到细胞基因组中。rna剂3包含rna 3a和向导rna 3b。rna 3a是编码蛋白的rna,所述蛋白涉及将第1序列5整合到基因组中。向导rna 3b是含有对应于整合了第1序列5的基因组序列上的序列(下文中,称为“第2序列”)的序列的rna。供体dna 2和rna剂3在使用例如核酸凝缩肽6进行凝缩的状态下包封。脂质粒子4包含通过非共价排列的多脂质分子4a产生的脂质膜。脂质粒子4是近似球形的中空体,其在其中心腔4b中包封供体dna 2和rna剂3。
24、在下文中,将详细描述每个构成。
25、供体dna 2例如是双链线性dna。供体dna 2可以是单链dna或环状dna。供体dna 2的长度例如是3~约20000个核苷酸。
26、包含在供体dna 2中的第1序列5是待整合到细胞基因组中的序列,并且实施方式包含:含有启动子序列,特定基因和终止子序列的基因表达盒;编码特定基因或基因的部分的核苷酸序列:或不是基因的天然存在的核苷酸序列或非天然核苷酸序列。第1序列5可以是编码1个~数个氨基酸的核苷酸序列或由3个~数十个核苷酸组成的序列。第1序列5的长度例如是3~约20000个核苷酸。
27、例如,除了第1序列5之外,供体dna 2可以含有其他序列。这种序列可以是由rna3a编码的蛋白的识别序列或向导rna 3b的识别序列。
28、供体dna 2的结构如何将在后面详述,即,根据核酸递送载体1的用法,选择第1序列5的种类,附加序列的种类,核苷酸长度等。
29、优选的是,核酸递送载体1中包含1~100分子的供体dna 2。
30、rna 3a是编码蛋白的rna,所述蛋白涉及将第1序列5整合到基因组中。该蛋白具有dna切断,接合,插入和/或修复的活性,并且是通过使用这些活性将dna序列整合到基因组中的酶。在下文中,这种蛋白也被简称为“酶”。优选酶的实例包括:具有内切核酸酶活性的酶;转座酶;逆转录酶和整合酶(反转录病毒型逆转座子用酶);逆转录酶和内切核酸酶(非反转录病毒型逆转座子用酶)等。
31、内切核酸酶活性的酶的实例包括:crispr-关联蛋白质9(crispr-assosiatedprotein 9:cas9)、锌指核酸酶(zfn)、转录活化用效应子核酸酶(talen)或大范围核酸酶等。如稍后详细描述的那样,每种内切核酸酶涉及通过切割第1序列5整合到基因组上的位置的磷酸二酯键来将第1序列5整合到基因组中。
32、转座酶的实例包括:piggybac、sleepingbeauty、frog prince、hsma、minos、tol1、tol2、passport、hat、ac/ds、pif、harbinger、harbinger3-dr、himar1、hermes、tc3或mos1等。每个转座酶具有从供体dna 2中切除含有第1序列5的序列,并将其整合到基因组中的活性,因此涉及将第1序列5整合到基因组中。
33、rna 3a可以是例如编码任何上述酶的基因的mrna。rna 3a可以具有除编码酶基因的序列之外的另外的序列。附加序列的实例包括5'-末端前导序列,ires(内部核糖体进入位点),终止子序列或聚(a)序列。可以将rna 3a封端。
34、rna 3a的长度例如为约20~约5000个核苷酸。优选的是,核酸递送载体1中包含1~约1000分子的rna 3a分子。rna 3a可含有编码不同种类的酶的多个rna。
35、向导rna 3b是具有对应于第2序列或其互补序列的核苷酸序列的rna。第2序列例如在将第1序列5导入细胞基因组的位置处或是附近的15~25聚体序列。第2序列是dna,向导rna 3b是rna。因此,“相应的核苷酸序列”是指除了第2序列的t(胸腺嘧啶)在向导rna 3b中是u(尿苷)之外是相同的核苷酸序列或其互补序列。
36、当rna 3a是编码cas9的rna时,优选使用向导rna 3b。此时,向导rna 3b可以是可以根据本领域技术人员的共同知识基于第2序列在crispr-cas9系统中设计的向导rna。在这种情况下,向导rna 3b可以是其中含有pam序列的3'端侧crrna的rna连接到第2序列的3'末端,或者可以是将包含含有pam序列的3'末端crrna和tracrrna的一部分的序列连接到第2序列的3'末端的rna(sgrna)。这种向导rna 3b的长度例如为约40~约150个核苷酸。
37、向导rna 3b与从rna 3a表达的内切核酸酶形成复合体,并发挥将内切核酸酶引导到第2序列的作用。因此,使用向导rna 3b允许第1序列5的位点特异性整合。当不需要的第1序列5的位点特异性整合或cas9不用作酶时,不必使用向导rna 3b。
38、优选的是,在核酸递送载体1中包含1~约1000分子的向导rna 3b。
39、rna剂3可包括另外的rna。附加rna的实例包括具有dna修饰功能的rna,例如dna甲基化,去甲基化,修复和/或接合。例如,这些rna各自是编码具有上述修饰活性的蛋白的rna。包含这种rna使得可以将修饰添加到已被整合到基因组中的第1序列5中及其周围序列。因此,例如,可以进一步在功能上修改细胞。
40、优选的是,包括在rna剂3中的rna可以被修饰以对降解具有抗性。例如,修饰可以是使rna不被细胞内或细胞外rna酶降解的本领域已知的修饰。例如,这种修饰涉及在rna中使用/导入天然发生的修饰核苷酸或非天然核苷酸,使用/附加非天然序列,或添加天然存在/非天然帽结构。
41、天然发生的修饰核苷酸的实例包括:假尿苷,5-甲基胞苷,1-甲基腺苷等。非天然核苷酸的实例包括bna(桥核酸),lna(锁核酸),pna(肽核酸)等。
42、非天然序列的实例包括人工合成的非自然核苷酸序列,例如随机核苷酸序列或由天然/非天然氨基酸和核酸的咋交体序列。优选将非天然序列添加到例如rna的末端。
43、天然存在的帽结构的实例包括cap0(m7gpppn)、cap1(m7gpppnm)等。非天然帽结构的实例包括arca(anti-reversecapanalog)或lna-鸟苷等。优选的是,非天然帽结构被添加到例如rna的5'末端。
44、如上所述使用修饰的rna可避免rna被细胞内或细胞外存在的rna酶降解。这可能导致第1序列5的整合效率增加。
45、核酸凝缩肽6用于将许多核酸凝缩成小体,以有效地在脂质粒子4中包封核酸。优选使用例如阳离子性肽作为这种肽。阳离子性肽可以进入例如阴离子核酸的螺旋间隙并缩短间隙以凝缩核酸。
46、优选的核酸凝缩肽6例如含有阳离子氨基酸的肽,其量相对于总量为45%或更高。更优选的核酸凝缩肽6在一端是rrrrrr(第1氨基酸序列),另一端是序列rqrqr(第2氨基酸序列)。此外,0个或更多由rrrrrr或rqrqr组成的中间序列包括在上述2个氨基酸序列之间。另外,2个或更多个中性氨基酸包括在第1氨基酸序列,第2氨基酸序列和中间序列的任何2个相邻序列之间。中性氨基酸的实例包括g或y。
47、上述核酸凝缩肽6优选具有以下氨基酸序列:
48、rqrqryyrqrqrggrrrrrr(seq id no:1);或者
49、rqrqrggrrrrrr(seq id no:2)。
50、由于r的阳离子性,这种核酸凝缩肽可以有效地引起核酸的凝缩,并且可以削弱核酸的阴离子性质,从而更有效地将核酸包封在脂质粒子4中。此外,该核酸凝缩肽可以有效地解离细胞中的核酸,从而可以在细胞中有效地表达导入细胞中的核酸。
51、或者,核酸凝缩肽6在一端具有rrrrrr(第3氨基酸序列),并在另一端具有rrrrrr(第4氨基酸序列)。另外,0个或更多由rrrrrr或rqrqr组成的中间序列包括在上述2个氨基酸序列之间。另外,2个或更多个中性氨基酸包括在第3氨基酸序列,第4氨基酸序列和中间序列的任何2个相邻序列之间。中性氨基酸的实例包括g或y。
52、这种核酸凝缩肽6优选具有以下氨基酸序列:
53、rrrrrryyrqrqrggrrrrrr(seq id no:3)。
54、这种核酸凝缩肽6在两端具有强阳离子性质,因此可以有效地结合核酸。因此,核酸可以更有效地凝缩,从而可以将更多的核酸包封在脂质粒子4中。这降低了残留在脂质粒子4之外的核酸水平,从而防止核酸递送载体之间的聚集。因此,每个核酸递送载体可能掺入细胞中。
55、此外,具有以下氨基酸序列的核酸凝缩肽6可以与任何上述核酸凝缩肽组合使用:
56、gnqssnfgpm kggnfggrss gpyggggqyf akprnqggy(m9)(seq id no:4)。
57、该肽可以进一步凝缩由上述核酸凝缩肽凝缩的聚集核酸6。因此,可以获得更小尺寸的核酸递送载体。这种核酸递送载体容易掺入细胞中,使核酸与细胞基因组的整合更有效。
58、例如,在脂质粒子4中的包封之前,通过将供体dna 2和rna剂3与核酸凝缩肽6搅拌混合来进行供体dna 2和rna剂3的凝缩。供体dna 2和rna剂3可以在一同凝缩或也可以单独凝缩。
59、由于发挥上述效果,因此优选使用核酸凝缩肽6。然而,根据使用的供体dna 2和rna剂3的种类,或使用的细胞的种类,也不一定使用核酸凝缩肽6。
60、脂质粒子4可以由脂质单层或脂质双层制成。另外,脂质粒子4可以由单层膜或多层膜制成。
61、作为脂质粒子4的材料,例如,可以使用作为生物膜的主要成分的脂质。这种脂质的实例包括二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、二氢鞘磷脂、脑磷脂及脑苷脂等。使用二酰基磷脂酰胆碱和二酰基磷脂酰乙醇胺的情况是优选的,因为脂质粒子4的结构和粒度易于控制,并且可以赋予膜融合能。脂质中包含的酰基的烃链的长度优选为c10~c20。该烃链可以是饱和烃基或不饱和烃基。
62、可以优选使用的脂质的实例包括:
63、1,2-二油酰-sn-甘油基-3-磷酸乙醇胺(dope),
64、1,2-硬脂酰-sn-甘油基-3-磷酸乙醇胺(dspe),
65、1,2-二棕榈酰-sn-甘油基-3-磷脂酰胆碱(dppc),
66、1-棕榈酰-2-油酰-sn-甘油基-3-磷脂酰胆碱(popc),
67、1,2-二-o-十八烷基-3-三甲基铵丙烷(dotma),
68、1,2-二油酰-3-二甲基铵丙烷(dodap),
69、1,2-二肉豆蔻酰-3-二甲基铵丙烷(14:0dap),
70、1,2-二棕榈酰-3-二甲基铵丙烷(16:0dap),
71、1,2-二硬脂酰-3-二甲基铵丙烷(18:0dap),
72、n-(4-羧基苄基)-n,n-二甲基-2,3-双(油酰氧基)丙烷(dobaq),
73、1,2-二油酰-3-三甲基铵丙烷(dotap),
74、1,2-二油酰-sn-甘油基-3-磷酸胆碱(dopc),
75、1,2-二亚油酰-sn-甘油基-3-磷酸胆碱(dlpc),
76、1,2-二油酰-sn-甘油基-3-磷酸-l-丝氨酸(dops),或
77、胆甾醇。
78、它们具有形成脂质粒子4的功能,以及当将核酸递送载体递送到细胞中时,具有质膜融合和/或胞吞作用的效果。
79、脂质粒子4可以由单一脂质组成,但优选是包括多种脂质的脂质混合物。考虑对象脂质粒子4的尺寸,包封物的种类,导入的细胞中的稳定性等而适当地选择用于脂质粒子4的脂质的种类。
80、除了上述脂质之外,脂质粒子4优选包括第1可生物降解的脂质化合物。第1可生物降解的脂质化合物可由下式表示:
81、q-chr2
82、其中
83、q是含有2个或更多个叔氮原子的无氧含氮脂肪族基,
84、r各自独立地是c12~c24脂肪族基,和
85、至少一个r在其主链中或侧链中含选自-c(=o)-o-、-o-c(=o)-、-o-c(=o)-o-、-s-c(=o)-、-c(=o)-s-、-c(=o)-nh-、及-nhc(=o)-的连接基lr。
86、当脂质粒子4含有第1可生物降解的脂质化合物时,脂质粒子4的表面是非阳离子性的。因此,降低了细胞导入的困难,从而可以增加核酸递送效率。结果,可以将第1序列5有效地将第1序列5整合到细胞基因组中。
87、由于核酸包封量和核酸递送效率更好,作为第1可生物降解的脂质化合物,优选使用,例如,具有由下式表示的结构的脂质。
88、
89、
90、
91、
92、另外,脂质粒子4优选还包括例如第2可生物降解的脂质化合物。第2可生物降解的脂质化合物可以由式表示:
93、p-[x-w-y-w'-z]2
94、其中
95、p是在主链中含有至少一个醚键的亚烷基氧基,
96、x各自独立地是含有叔胺结构的2价连接基,
97、w各自独立地是c1~c6亚烷基,
98、y各自独立地是选自单键、醚键、羧酸酯键、硫代羧酸酯键、硫代酯键、酰胺键、氨基甲酸酯键和脲键的2价连接基,
99、w'各自独立地是单键或c1~c6亚烷基,
100、z各自独立地是脂溶性维生素残基、甾醇残基或c12~c22脂肪族烃基。
101、在包括第2可生物降解的脂质化合物的情况下,因为可以在构成p中所含的醚键的氧原子和包封的核酸之间形成氢键,因此可以增加核酸等的包封量。
102、由于核酸包封量和核酸递送效率更好,优选使用具有以下结构的第2可生物降解的脂质化合物。
103、
104、
105、
106、在使用包括上述第1和第2可生物降解的脂质化合物的脂质粒子4的情况下,改善了核酸递送效率,并且可以减少转染细胞的细胞死亡。在含有第1可生物降解的脂质化合物和第2可生物降解的脂质化合物两者的情况下,容易适用于基因治疗,核酸医疗,基因组诊断等。特别优选使用式(1-01)或式(1-02)表示的化合物及由式(2-01)表示的化合物,因为特别优异的核酸包封量和核酸递送效率。
107、脂质粒子4还可含有另外的脂质。这种另外的脂质可以任选地选自脂质粒子中常用的那些。此外的物质的实例包括:例如,聚乙二醇(peg)修饰脂质、特别聚乙二醇(peg)二肉豆蔻酰甘油(dmg-peg)、从ω-氨基(寡乙二醇)链烷酸单体衍生的聚酰胺寡聚体(美国专利第6,320,017号)、降低单唾液酸神经节苷脂等的脂质粒子4彼此的凝集的脂质;用于调整毒性的相对毒性的低的脂质;具有向脂质粒子4结合配位子的官能团的脂质;甾醇、例如胆甾醇等的用于抑制包封物的漏出的脂质等。
108、由于特别优异的核酸包封量和核酸递送效率,在脂质粒子4优选含有例如式(1-01)或式(1-02)表示的化合物,式(2-01)表示的化合物,dope和/或dotap,胆甾醇和dmg-peg。例如,优选这些组分包括在下表1中列出的任何组合物1~6中。
109、表1:脂质粒子的组成(摩尔比)
110、
111、除了供体dna 2和rna剂之外,脂质粒子4还可以包封另外的化合物。这种化合物的实例包括:视黄酸、环状腺苷一磷酸(camp)或抗坏血酸等的调节细胞内的核酸的表达的化合物;肽、多肽、细胞因子、生长因子、凋亡因子、分化诱发因子、细胞表面受体及其配体、抗炎症化合物、抗抑郁药、兴奋药、镇痛药、抗生物质、避孕药、解热剂、血管扩张药、血管新生抑制剂、细胞血管激动药、信号传递抑制剂、心脏血管药、肿瘤药、激素及类固醇等的治疗剂等。
112、核酸递送载体1可以通过使用例如在脂质粒子中包封小分子时使用的已知方法来制造,所述方法包括bangham方法,有机溶剂萃取,表面活性剂去除,冷冻解冻等。例如,可通过向使脂质粒子4的材料含在醇等的有机溶剂中而得到的混合物添加含供体dna2及rna剂3的水性缓冲液,搅拌悬浮而制作核酸导入载体1。通过改变水性缓冲液中两者之间的体积比,可以容易地调节脂粒子子4中包封的rna剂3与供体dna 2的体积比。
113、通过使用例如可商购的dna和rna定量试剂盒,可以确定dna和rna的包封量。
114、核酸递送载体1的平均粒度为约50nm~约300nm,优选约50nm~约200nm。当核酸递送载体1用于医疗用时,优选核酸递送载体1是纳米级水平粒子。例如,通过超声波可以使粒度较小。另外,可以通过使核酸递送载体1通过聚碳酸酯膜或陶瓷膜来调节尺寸。核酸递送载体1的平均粒径可以通过例如使用动态光散射的ζ分选机测量。
115、【核酸递送方法】
116、下面描述使用上述核酸递送载体的核酸递送方法。核酸递送方法是将第1序列整合到细胞基因组中的方法,并包括使核酸递送载体与细胞接触。
117、图2是显示核酸递送方法的一例的概略流程图。例如,核酸递送方法包括以下步骤:
118、(s1)使核酸递送载体与细胞接触;
119、(s2)通过接触,在细胞中从包含在rna剂中的rna表达蛋白;和
120、(s3)通过使用蛋白的活性将第1序列整合到细胞基因组中。
121、在核酸递送方法中,所述方法的实施者进行步骤(s1),则通过核酸递送载体中包含的分子的活性和细胞内原本存在的内在机制而自发性发生步骤(s2)和步骤(s3)。
122、该细胞可以衍生自人,动物或植物,或者可以衍生自诸如细菌或真菌的微生物。细胞优选是动物细胞,更优选哺乳动物细胞,最优选是人细胞。细胞优选是血液和免疫细胞,间充质细胞,上皮细胞,内皮细胞或组织干细胞或多能干细胞。
123、细胞可以是例如离体收集的细胞,并且可以是例如与体液(如血液)、组织或活组织检查分离的细胞。细胞可以是例如分离的细胞或细胞系。或者,细胞可以是体内细胞。表述“a cell”,“the cell”和“cells”可包括一个细胞(单个)和多个细胞(数个,细胞群,细胞丛或细胞簇)。
124、当细胞是离体收集的细胞或微生物时,使核酸递送载体1与细胞7接触的步骤可包括,例如,将含核酸递送载体1的组合物添加到细胞或微生物上培养。例如,优选在添加后,在适合细胞存活的条件下培养细胞30~48小时。
125、如果细胞是动物的体内细胞,则通过在体内施用含有核酸递送载体1的组合物来实施接触。给药可由例如,非经口通路、例如,皮下、静脉内、肌肉内、关节内、滑膜内、胸骨内、髓腔内、眼内、肝内、病变内及向颅内的注射或点滴等进行。
126、如果细胞是植物细胞,则可以通过将植物浸泡在含核酸递送载体1的组合物中或使用注射器等将该组合物到注入植物中。
127、本实施方式的核酸递送方法中使用的酶不限于cas9和转座酶,并且同时可以通过使用涉及其他核酸转移的酶来导入第1序列5。
128、根据该实施方式的核酸递送方法,可以以rna形式导入酶。因此,与以dna形式的递送的情况相比,可以省略转录步骤,从而可以更快且有效地表达酶。因此,第1序列5可以更有效地整合。
129、另外,如果导入蛋白形式的酶,则需要根据所包封的蛋白的尺寸和特征来调节脂质粒子4的尺寸和组成。相比之下,如果在本实施方式的核酸递送方法中采用rna形式,则脂质粒子4的组成相对不受限制。因此,与以蛋白形式的递送的情况相比,可以减少制造核酸递送载体时的时间和成本。
130、另外,当导入dna形式的酶时,酶基因可以整合到细胞基因组中,有给细胞或含该细胞的生物带来体内不良影响的可能性。相比之下,根据本实施方式的核酸递送方法,酶以rna形式导入。因此,酶未整合到细胞基因组中,因此可以防止不利影响。
131、另外,当将核酸与脂质体等的脂质结合而导入细胞时,核酸有降解或与不需要的分子聚集的可能性。而且,难以调节待导入核酸的丰度比。相比之下,根据本实施方式的方法,将供体dna 2和rna剂3包封在脂质粒子4的腔4b中。因此,可以保护供体dna 2和rna剂3免于被降解或聚集。此外,可以容易地调节待导入的供体dna 2和rna剂3之间的体积比。因此,可以将供体dna 2和rna剂3有效地导入细胞中,可以表达rna,然后可以整合第1序列5。
132、通过使用核酸凝缩肽6,通过使rna降解,和/或通过在脂质粒子4中包括可生物降解的脂质化合物,可以进一步增加递送效率。
133、本核酸递送方法适用于例如基因组编辑或基因重组的dna转染。例如,当第1序列5包含基因表达盒和基因或基因的一部分时,可以通过上述核酸递送方法将基因整合到细胞基因组中。因此,细胞可以获得基因介导的新功能。或者,基因的正常功能可以给予例如基因缺失的细胞,缺陷细胞,基因缺陷细胞或部分缺陷的细胞。
134、或者,可以将第1序列5整合以敲除细胞基因组上的基因。例如,可通过敲除表达对细胞有害的产物的基因或过表达的基因,以使细胞成为正常功能。此外,可以创建基因敲除(ko)模型生物。
135、核酸递送方法适用于但不限于各种领域,例如基因治疗,模型动物产生,基因功能分析,药物开发,基因驱动和/或转基因作物生产。本实施方式的方法使得靶基因能更有效地整合,从而能增加基因治疗疗效,模型动物生产效率,基因功能分析效果,药物开发效率,基因驱动效果或效率,或转基因生物的产生效果或效率。
136、【组合物】
137、一实施方式提供包括核酸递送载体1和载体的组合物。
138、载体的实例包括水,盐水(例如生理盐水),甘氨酸水溶液或缓冲液。
139、除核酸递送载体和媒质之外,本实施方式的组合物可包括另外的组分。另外的组分的实例包括但不限于例如,白蛋白、脂蛋白、载脂蛋白、球蛋白等的糖蛋白等的改善稳定性的药剂;医药用途的情况,例如ph调整剂、缓冲化剂、张度调整剂等,例如,乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙等的制药学上容许可能且使医药组合物与生理性状态接近的相关剂;抑制自由基导致的损伤的如α-生长酚一样的脂肪亲和性自由基猝灭剂,或抑制脂质的过氧化损伤的如铁草胺一样的水溶性螯合剂等的用于改良储藏稳定性的脂质保护剂等的化合物等。在形成核酸递送载体后,优选加入媒质和附加组分。
140、该组合物可以是例如药物组合物,其包含可以药学上给药的组分。另外,可以通过常规公知的方法对实施方式的组成进行灭菌。
141、组合物可以作为液体提供,或者可以作为干粉提供。粉末状组合物可以通过例如将其溶解在合适的液体中使用。
142、包含在本实施方式的组合物中的核酸递送载体的浓度不受限制,优选为0.01~30质量%,更优选0.05~10质量%。浓度根据目的适当地选择。
143、【试剂盒】
144、一实施方式提供包括核酸递送载体的试剂盒。本试剂盒例如包含上述组合物,其包含核酸递送载体,以及用于将核酸递送载体递送到细胞中的试剂。或者,提供将使脂质粒子4的材料分散在媒质中的分散物和供体dna2及rna剂3收容在个别容器中的试剂盒,或将干燥的脂质粒子4及供体dna2及rna剂3和媒质收容在个别容器中的试剂盒等。再者,也可将干燥的脂质粒子4或脂质粒子4的材料的分散物和供体dna2及rna剂3作为个别的制品,作为利用者可根据目的选择各制品的形态。
145、在另一个容器中,试剂盒可以包括可包含在上述组合物中的另外的化学试剂。
146、(第2实施方式)
147、第2实施方式提供核酸递送载体,其中供体dna 2和rna剂3具有核壳结构。图3是示出第2实施方式的核酸递送载体的截面图。
148、图3(a)所示的核酸递送载体100具备包含含供体dna2的供体dna核15、及含包被供体dna核15的rna剂3的rna剂壳16的核壳结构。核壳结构包封在脂质粒子4中。
149、例如,核酸递送载体100可以如下制造。首先,使用核酸凝缩肽凝缩供体dna 2以产生供体dna核15。接下来,通过使rna剂3与供体dna核15接触,rna剂3中所含的rna静电附着在供体dna核15的周围而形成rna剂壳16。可以用核酸凝缩肽预先凝缩rna剂3。这导致形成核壳结构。随后,将核壳结构加入含有脂质粒子4的材料的溶剂中。然后,搅拌混合物,由此将核壳结构包封在脂质粒子4中。以这种方式,可以生产核酸递送载体100。
150、这种结构允许顺序递送供体dna 2和rna剂3。例如,当将核酸递送载体100导入细胞中时,rna剂3作为壳的rna剂3比作为核的供体dna 2更快地释放。然后,从包含在rna剂3中的rna产生的酶比供体dna 2更快地达到核。由此,一旦供体dna 2到达核,就开始第1序列5整合,使得整合效率可以提高。
151、图3(b)所示的核酸递送载体101具备包含含rna剂3的rna剂核17、及含包被rna剂核17的供体dna2的供体dna壳18的核壳结构。核壳结构包封在脂质粒子4中。
152、对于核酸递送载体101,例如,使用核酸凝缩肽凝缩rna剂3以产生rna剂核17,并使供体dna 2接触核。以这种方式,形成供体dna壳18。供体dna 2可以预先用核酸凝缩肽凝缩。随后,将所得核壳结构加入含有脂质粒子4的材料的溶剂中。然后,可以搅拌混合物以产生核酸递送载体101。
153、由于具有这样的结构,例如,当核酸递送载体101被导入细胞中时,作为壳的供体dna 2释放得比rna剂3快,rna剂3经历持续释放。由于这一点,即使从rna剂产生的酶在细胞中降解,也可以提供酶,因为rna再次从rna剂核17释放。因此,第1序列5整合效果可以持续很长一段的时间。
154、可以根据所用的细胞种类来选择核酸递送载体的构型。例如,在具有缓慢蛋白降解的细胞中,即使从rna剂产生的酶转位至核,在无问题的细胞中,也可以使用图3(a)所示的核酸递送载体100来提高整合效率。或者,例如,在细胞周期快的细胞或蛋白质分解快的细胞等,酶易分解或消费的细胞中,使用图3的(b)中所示的核酸导入载体101能提高整合效率。
155、核中所含的核酸的释放速度及释放持续时间可根据核酸凝缩肽的组成或量、或者核酸的量等调节。
156、与第1实施方式的核酸递送载体类似,核酸递送载体100或101可用于核酸递送方法。另外,每个载体可以作为与第1实施方式类似的试剂盒或组合物提供。
157、(第3个实施方式)
158、第3实施方式提供包括单独的脂质粒子4的核酸递送载体组,每个脂质粒子4包封供体dna 2或rna剂3。图4是核酸递送载体组的实例。核酸递送载体组200包括第1载体201和第2载体202。第1载体201包含供体dna 2和包封供体dna 2的第1脂质粒子41。第2载体202包括rna剂3和包封rna剂3的第2脂质粒子42。供体dna 2或rna剂3各自在使用核酸凝缩肽凝缩的状态下被包封。
159、第1载体201和第2载体202可以单独制造。例如,第1载体201和第2载体202各自通过将供体dna2和rna剂3各自用核酸凝缩肽凝缩,与含脂质粒子的材料的分别的溶液混合、搅拌来得到。
160、核酸递送载体组200可以作为类似于第1实施方式的组合物或试剂盒提供。例如,第1载体201和第2载体202作为例如,收容在分别的容器的组合物或收容在相同的1个容器的组合物提供。
161、核酸递送载体组200适用于与第1实施方式的核酸递送载体类似的核酸递送方法。根据这种核酸递送载体组200,可以在核酸递送方法中使第1载体201或第2载体202之任意者首先接触细胞。
162、例如,在使用上述细胞的情况下,优选首先将rna剂3的载体3转移到核中,优选地使得第2载体202在第1载体201之前接触细胞。例如,优选接触第2载体202之后,在30分钟~48小时后接触第1载体201。
163、或者,如上所述,在使用优选使供体dna2首先迁移到核内,持续释放rna剂3的细胞时,优选使第1载体201比第2载体202先接触细胞。例如,优选在接触第1载体201之后,在30分钟~48小时后接触第2载体202。
164、任选地,可以两者同时接触细胞。
165、当通过使用核酸递送载体组300顺序导入供体dna 2和rna剂3时,递送时间差易于调节。
166、【实施例】
167、接下来描述根据实施方式的核酸递送载体的制备和使用的例。
168、【实施例1:dna包封载体的nanoluc基因导入效率和表达效率的评价】
169、【dna包封载体的制备】
170、作为dna,使用质粒dna,其中将nanoluc基因连接在巨细胞病毒启动子下游。向含有该dna的dna溶液中,加入阳离子性肽以形成凝缩的dna肽。接下来,将其添加到乙醇-可溶性脂肪溶液(fft10(由式(1-01)表示的可生物降解的脂质化合物)/dotap/胆甾醇/peg-dmg=73/44/59/4mol)中。此外,轻轻加入10mm hepes(ph7.3)。然后将混合物通过离心超滤洗涤并浓缩以产生dna包封载体。用quant-it(注册商标)picogreen dsdna测定试剂盒(由thermo fisher scientific制造)测量载体的dna包封量。然后,验证了dna被足量包封。
171、【jurkat制备和使用dna包封载体的核酸导入】
172、将人t细胞性白血病细胞(从atcc获得的jurkat)在texmacs培养基中培养(由miltenyi bioteck.k.制造)。通过离心回收细胞后,将细胞悬浮在新鲜texmacs中至成为0.65×107个细胞。然后,向48孔培养板各加150μl细胞悬浮液和texmacs至成为1.0×10 6个细胞/孔。
173、之后,将dna包封载体以0.5μgdna/孔加入到每个孔中,并将混合物在37℃和5%co2的气氛中培养。
174、【由脂质体3000将dna导入细胞】
175、作为对照,使用脂质体3000试剂(由invitrogen制造)将上述质粒dna导入jurkat。导入按照试剂附带的说明书进行。向jurkat加入质粒dna至成为0.5μg/孔,将混合物在37℃和5%co2的气氛中培养。
176、【nanoluc表达水平的测定(nanoluc发光测定)】
177、在加入与dna包封载体或脂质体3000混合的质粒dna之后48小时后,从培养箱收集培养板。然后,使用nano-glo荧光素酶测定系统(由promega制造)、使用发光计(infinite(注册商标)f200 pro,由tecan制造)测量nanoluc的发光强度。测量按照试剂盒和装置附带的说明书进行。
178、【nanoluc发光测定的结果】
179、图5显示了测量nanoluc的发光强度的结果。使用dna包封载体的导入引起比使用脂质体3000导入的更高的发光强度。该结果表明,在通过使用dna包封载体导入dna的细胞中,dna被很好地导入,并且nanoluc基因被良好表达。这表明,相比使用dna和脂质体的复合物的方法,通过载体包封的dna导入的方法具有更高的dna导入效率和基因表达效率。
180、【显微镜发光细胞检测】
181、接下来,使用由载体或脂质体3000导入了dna的细胞,通过使用发光显微镜系统(lv200,由olympus制造)来检测发光细胞。在导入后24小时,将100μl细胞培养液转移到4孔培养皿中,并加入nanoluc基质(由promega制造的活细胞荧光素酶测定试剂盒)。在将培养皿设置在发光显微镜系统(由olympus制造的lv200)中的预定位置之后,捕获明场图像和细胞的发光图像。
182、【显微镜观察的结果】
183、图6示出了发光细胞的捕获图像(由matamorph软件合并明场图像和发光图像的图像)。照片中的箭头表示的白色点是发光细胞。图6(a)显示使用dna包封载体的细胞的显微镜图像,而图6(b)是使用脂质体3000的细胞的显微镜图像。将这2者进行了比较。显而易见的是,使用dna包封载体的情况具有比使用脂质体3000的情况大得多的数量的发光细胞。该结果已经证明,如同nanoluc发光测定,即相比使用脂质体和dna的复合物的情况,使用dna包封载体的情况具有更高的dna导入效率和基因表达效率。
184、【实施例2:由mrna包封载体评价绿色荧光蛋白(gfp)基因的导入效率和表达效率】
185、【rna包封载体的制备】
186、作为信使rna(mrna),使用作为报告基因的绿色荧光蛋白(gfp)的mrna(由ozbiosciences制造)。将含有该mrna的rna溶液加入到乙醇-可溶性脂肪溶液(fft10/dope/胆甾醇/peg-dmg=73/44/59/4mol)中,并通过移液器吸吐悬浮混合物。然后,轻轻加入10mmhepes(ph7.3)。将该溶液用离心超滤洗涤并浓缩以产生rna包封载体。用quantifluor(注册商标)rna系统(promega制造)测量载体的rna包封量,并核实mrna以足量被包封。
187、【jurkat制备和使用rna包封载体导入核酸】
188、将jurkat在texmacs培养基中进行培养。通过离心回收细胞后,将细胞悬浮在新鲜texmacs中至成为0.65×107个细胞。然后,向48孔培养板各加入150μl细胞悬浮液和texmacs至成为1.0×106个细胞/孔,。
189、之后,向上述孔加入rna包封载体至mrna成为0.5μg/孔,并将混合物在37℃和5%co2的气氛中培养。
190、【由脂质体3000将mrna导入细胞】
191、作为对照,使用脂质体3000试剂将上述mrna导入jurkat。导入按照试剂附带的说明书进行。向孔中加入mrna至成为0.5μg/孔,并将混合物在37℃和5%co2的气氛中培养。
192、【gfp表达的检测】
193、在加入与rna包封载体或脂质体3000混合的mrna后24小时,从培养箱收集培养板。通过离心回收后,将细胞悬浮在含有1%bsa(由gibco,thermo fishific制造)的磷酸盐缓冲溶液pbs中。然后,使用荧光活化细胞分选仪(facs;facsverse(注册商标)、bdbioscience制)进行了检测gfp的绿色荧光。
194、【结果】
195、图7显示了检测结果。图7(a)显示了使用rna包封载体的结果,图7(b)显示了使用脂质体3000的结果。每个图显示纵坐标代表细胞计数(%)横坐标表示gfp表达强度的直方图。每个实线直方图显示导入rna的细胞的分布,并且每个虚线直方图显示未导入rna的细胞(对照)的分布。
196、如图7(a)的图所示,在用rna包封载体导入的情况下,与对照相比,细胞的荧光强度的分布显著向右侧移位,表明gfp很好地在细胞中表达。这揭示了gfp mrna被良好导入,并且gfp良好表达。
197、相比之下,如图7(b)所示,在使用脂质体试剂导入rna的情况下,荧光强度的分布几乎与对照的相同,表明gfp mrna导入或表达较弱。
198、因此,这表明,通过使用载体包封的mrna导入的方法具有比使用mrna和脂质体的复合物的方法更高的mrna导入效率和基因表达效率。
199、【实施例3:以mrna形式(rna包封载体)导入和以dna形式(dna包封载体)导入的gfp基因的导入效率和表达效率的评价】
200、【rna包封载体的制备】
201、作为mrna,使用实施例2中描述的gfp mrna。将含有gfp mrna的rna溶液加入到乙醇-可溶性脂肪溶液(fft10/dope/胆甾醇/peg-dmg=73/44/59/4mol)中,并将混合物通过移液器吸吐悬浮。然后,轻轻加入10mm hepes(ph7.3)。将该溶液用离心超滤洗涤并浓缩以产生rna包封载体。用quantifluor(注册商标)rna系统测量载体的rna包封量,验证mrna以足量被包封。
202、【dna包封载体的制备】
203、作为dna,使用质粒dna,其中将gfp基因连接在巨细胞病毒启动子下游。接下来,将阳离子性肽加入含有该dna的dna溶液中以凝缩dna。然后,将其加入到乙醇-可溶性脂肪溶液(fft10/dotap/胆甾醇/peg-dmg=73/44/59/4mol)中。然后,轻轻加入10mm hepes(ph7.3)。然后将混合物通过离心超滤洗涤并浓缩以产生dna包封载体。用quant-it(注册商标)picogreen dsdna测定试剂盒(由thermo fisherscientific制造)测量载体的dna包封量。然后,验证了dna以足量被包封。
204、【jurkat制备和使用载体导入核酸】
205、将jurkat在texmacs培养基中进行培养。通过离心回收细胞后,将细胞悬浮在新鲜texmacs中至成为0.65×107个细胞。然后,向48孔培养板各加入150μl细胞悬浮液和texmacs至成为1.0×10 6个细胞/孔。
206、向单独孔培养板中每个孔中加入rna包封载体或dna包封载体。将每个板在37℃和5%co2的气氛中温育。
207、【gfp表达的检测】
208、在加入载体后24小时,从培养箱中取出每个培养板。通过离心回收后,将细胞悬浮在含有1%bsa(由gibco,thermo fisher scientific制造)的磷酸盐缓冲溶液(pbs)中。然后,由facs检测细胞的绿色荧光(gfp)。
209、【结果】
210、图8显示了检测结果。图8(a)显示了使用rna包封载体的结果,图8(b)显示了使用dna包封载体的结果。每个图都显示了纵坐标表示细胞计数(%),并且横坐标表示gfp表达强度的直方图。每个实线直方图显示了使用相应的载体导入rna或dna的细胞的分布,并且每个虚线直方图显示了未导入rna或dna的细胞的分布。
211、如图8(a)所示,与对照相比,在以mrna形式导入gfp基因的情况下,荧光强度的分布显著向右侧移位,表明gfp很好地被细胞表达。这揭示了gfp mrna良好导入,并且gfp良好表达。
212、相反,如图8(b)所示,以dna形式导入gfp基因的情况下的荧光强度分布几乎与对照的相同,表明dna导入或gfp表达较弱。
213、总的来说,已经证明,以mrna形式导入gfp导致核酸导入效率和基因表达效率高于以dna形式导入的情况。
214、【实施例4:利用dna/rna共包封载体的gfp基因的导入效率和表达效率的评价】
215、【rna/dna共包封载体的制备和向jurkat的导入】
216、将含有实施例1中所述的含nanoluc基因的质粒dna和实施例2中所述的gfp基因编码的mrna的混合溶液加入到乙醇-可溶性脂肪溶液(fft10/dope/胆甾醇/peg-dmg=73/44/59/4mol)中。此外,轻轻加入10mm hepes(ph7.3)。然后将混合物通过离心超滤洗涤并浓缩以产生rna/dna包封载体。用quantifluor(注册商标)rna系统测量载体的rna包封量,并用quant-it(注册商标)picogreen dsdna测定试剂盒测量dna包封量。然后,验证mrna和dna以足量被包封。
217、将jurkat在texmacs培养基中进行培养。通过离心回收细胞后,将细胞悬浮在新鲜texmacs中至成为0.65×107个细胞。然后,向48孔培养板各加入150μl细胞悬浮液和texmacs至成为1.0×10 6个细胞/孔。之后,将dna/rna包封载体加入到每个孔中至成为0.5μg mrna和0.5μg dna/孔,并将混合物在37℃和5%co2的气氛中培养。
218、【由脂质体3000将mrna和dna导入细胞】
219、作为对照,使用脂质体3000试剂将mrna和质粒dna导入jurkat。导入按照试剂附带的说明书进行。向jurkat各自加入mrna和质粒dna至成为0.5μg/孔,将混合物在37℃和5%co2的气氛中培养。
220、【nanoluc及gfp的表达检测】
221、用nano-glo荧光素酶测定系统检测从nanolucdna的nanoluc的表达,并通过facs检测从gfp mrna的gfp的表达。各自通过实施例1或2中描述的方案进行检测。
222、【结果】
223、图9显示了检测nanoluc表达的结果。图9所示的图表揭示了使用载体导入dna和rna的情况引起比使用脂质体3000的情况更高的相对发光强度。该结果表明使用载体的情况具有更好的dna导入效率和自dna的基因表达效率。
224、图10示出了检测gfp表达的结果。图10(a)显示了使用载体的结果,图10(b)显示了使用脂质体3000的结果。这些直方图揭示了使用载体的情况比使用脂质体3000的情况引起更高的gfp荧光强度。该结果表明使用载体的情况具有更好的mrna导入效率和自mrna的基因表达效率。
225、上述结果表明,dna/rna共包封载体可以通过同时导入增加dna和rna导入效率和表达效率。
226、【实施例5:dna包封载体和rna包封载体的dna和rna顺序导入的评价】
227、【dna包封载体的制备】
228、作为dna,使用质粒dna,其中整合了将巨细胞病毒启动子和nanoluc基因连接的nanoluc基因表达盒。通过实施例1中描述的方法制备了dna包封载体。
229、【rna包封载体的制备】
230、作为rna,使用转座酶rna。通过实施例2中所述的方案制备了rna包封载体。
231、【细胞制备和使用载体导入核酸】
232、将市售冷冻人外周血单核细胞(pbmc,lonza)在37℃下在恒定温度培养箱中解冻,并通过离心回收细胞。将细胞悬浮在含有2种不同细胞因子(10ng/ml il-7和5ng/ml il-15(miltenyi))的texmacs中,然后在6cm培养皿上播种。然后将细胞在37℃和5%co2的气氛下在培养箱中培养。过夜培养后,从培养箱中取出培养皿。通过离心回收细胞,并悬浮在texmacs(含有10ng/ml il-7和5ng/ml il-15)中,然后在包被了抗cd3抗体(miltenyi)和抗cd28抗体(miltenyi)的48孔培养板上,在37℃和5%co2的气氛中培养过夜。
233、将转座酶rna包封载体(4μg)加入细胞培养液中,并将混合物在5%co2的气氛中培养。2小时后,进一步加入nanolucdna包封载体(4μg),继续培养。
234、作为对照,将转座酶rna包封载体(4μg)和nanolucdna包封载体(4μg)同时加入到相同的型细胞培养液中,并将混合物在5%co2的气氛中培养。
235、【nanoluc发光的检测】
236、在加入第1载体后48小时,从培养箱中取出每个培养板。然后,使用nano-glo荧光素酶测定系统(由promega制造),使用发光计(infinite(注册商标)f200 pro,由tecan制造)测量各nanoluc发光强度。根据试剂盒和装置附带的说明书测量每个发光。
237、【结果】
238、图11显示了测量nanoluc的发光强度的结果。在加入rna包封载体在2小时后,相比同时加入dna包封载体和rna包封载体的情况,加入dna包封载体的情况下检测到更高的nanoluc发光强度。该结果表明,辅助dna导入的转座酶mrna和含有待整合序列的dna的顺序导入有效地增加自dna的蛋白表达水平。另外,已经证明了该实施方式的方法使得可在通常认为具有低核酸导入效率的pbmc中也有效地导入(转染)并表达dna。
239、【实施例6:通过具有dna/rna核壳结构的载体评价核酸导入效率】
240、【dna/rna核/壳包封载体的制备】
241、作为dna,使用质粒dna,其中整合了将巨细胞病毒启动子和car基因连接的car基因表达盒;并作为rna,使用实施例2中描述的gfp mrna。将阳离子性肽加入含有该dna的dna溶液中以形成dna核。然后,加入上述rna以在dna核周围形成rna壳。结果,制备了含有dna/rna核/壳的溶液。接下来,将其加入到乙醇-可溶性脂肪溶液(fft10/dotap/胆甾醇/peg-dmg=73/44/59/4mol)中。此外,轻轻加入10mmhepes(ph7.3)。然后将混合物通过离心超滤洗涤并浓缩,以产生具有dna/rna核/壳结构的载体。
242、【dna/rna混合包封载体的制备】
243、作为对照,将阳离子性肽加入含有上述dna和rna的混合溶液中以制备含有dna/rna混合核的溶液。将其加入到乙醇-可溶性脂肪溶液(fft10/dotap/胆甾醇/peg-dmg=73/44/59/4mol)中。此外,轻轻加入10mm hepes(ph7.3)。然后将混合物通过离心超滤洗涤并浓缩,以产生dna/rna混合包封载体。
244、【载体内dna/rna包封的确认】
245、接下来,为了检查dna和rna是否包封在所得到的载体中,每个载体被破坏(通过加入表面活性剂:十二烷基硫酸钠),并且每个核结构崩解(通过加入聚谷氨酸)。然后,通过琼脂糖电泳检测每个释放的dna/rna。
246、图12显示了检测结果。在dna/rna核/壳包封载体和dna/rna混合核包封载体中,当载体破坏和核结构崩解都进行了一次时,检测dna和rna信号(在图像中的箭头)。该结果表明,dna/rna核/壳包封载体和dna/rna混合核包封载体含有dna和rna聚集体。
247、【细胞的荧光显微镜观察】
248、在用dna/rna核/壳包封载体或dna/rna混合核包封载体导入到jurkat之后,在荧光显微镜下检测到发绿色荧光的细胞(gfp表达细胞)。图13显示了表明结果的显微镜照片。在dna/rna混合核包封载体的情况下,在载体递送后在20小时的时间点(图13(b))未检测到gfp表达细胞。但是,在4天后检测到gfp表达细胞(图13(d))。相比之下,在dna/rna核/壳包封载体的情况下,在载体添加后在20小时(图13(a))检测到gfp表达细胞。这些结果表明,dna/rna核/壳中rna的表达比dna/rna混合核中的速度快。总之,已经证明,在dna/rna核/壳包封载体的情况下,dna/rna核在细胞内依次崩解,并且相应的蛋白可以从壳rna到核dna的顺序表达。
249、虽然已经描述了某些实施例,但是仅作为示例的方式呈现了这些实施例,并且不旨在限制本发明的范围。实际上,本文描述的新实施例可以以各种其他形式实施;此外,可以在不脱离本发明的精神的情况下进行本文描述的实施例的形式的各种省略,替换和变化。随附的权利要求及其等同物旨在涵盖将属于本发明的范围和精神的形式或修改。
技术实现思路
本文地址:https://www.jishuxx.com/zhuanli/20241125/335950.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表